Миома матки – доброкачественная моноклональная, хорошо отграниченная, капсулированная опухоль, происходящая из гладкомышечных клеток шейки или тела матки – одна из наиболее распространенных доброкачественных опухолей женской половой системы. Она встречается у 40–50% женщин репродуктивного возраста, чаще в позднем репродуктивном и пременопаузальном периодах [1, 2]. Однако в последние десятилетия участились случаи диагностики данного заболевания и у молодых женщин до 30 лет [3].
Миома матки может быть представлена как единичными, так и множественными узлами, при этом чаще диагностируется множественная миома матки. Симптомы заболевания, также как и прогнозы, могут быть самыми разными, в зависимости от размеров, расположения, темпов роста и развития опухолей. Чаще всего у пациенток с миомой матки выявляются боли, кровотечения и нарушение функции соседних органов вследствие сдавления их разрастающейся опухолью. Современные методы лечения включают в себя гормонотерапию и хирургические методы – выполняемые лапароскопическим, лапаротомическим и влагалищным доступами миомэктомии. К сожалению, именно миома матки является наиболее распространенной причиной гистерэктомий во всем мире, что особенно нежелательно у женщин в репродуктивном возрасте [4]. Однако ни один из методов лечения миомы матки не лишен недостатков и не может исключать осложнения и рецидивы. Развитие миомы может вести к бесплодию, осложнять течение беременности, а также вызывать проблемы при вынашивании и в родах [5]. Все это делает миому матки одной из важнейших угроз репродуктивному здоровью женщин и определяет актуальность изучения патогенеза миомы матки, оптимизации диагностики, тактики ведения пациенток и прогнозирования риска рецидивирования данного заболевания.
Несмотря на многочисленные исследования факторов, влияющих на развитие и рост лейомиомы матки, патогенез этого заболевания остается недостаточно изученным. Особый интерес среди факторов, вызывающих развитие миомы матки, представляет генетическая предрасположенность к данному заболеванию, которая подтверждается обнаружением «семейных форм» миомы у 5–10% больных [3], однако конкретных механизмов такой предрасположенности до недавнего времени описано не было [6, 7].
Наиболее значимым открытием последних лет в области изучения генетических механизмов развития миомы матки стало описание соматических мутаций в гене MED12, который кодирует одну из субъединиц медиаторного комплекса РНК-полимеразы II. Многочисленные исследования, опубликованные на протяжении последних 6 лет, показали, что с частотой 50–85% соматические мутации в миомах встречаются именно в экзоне 2 гена MED12 [8–12]. При этом чаще всего обнаруживаются однонуклеотидные замены в 43 и 44 кодонах.
В 2015 году группой авторов было опубликовано исследование [13], согласно которому встраивание в геном мышей мутантного аллеля гена MED12 (самой распространенной мутации, 131G>A) ведет к развитию миом из тех клеток, где работает только мутантный аллель. Если же наблюдалась полная инактивация гена MED12 в некоторых клетках мезенхимы матки мышей, то ни одна копия гена в таком случае не работала, то есть не происходило его экспрессии, при этом никаких изменений в тканях миометрия у таких мышей обнаружено не было. На основании этих результатов авторами был сделан вывод, что полная утрата функции продукта гена MED12 не вызывает развития миом. В случае же мышей, в некоторых клетках миометрия которых экспрессировался только мутантный вариант гена MED12, были обнаружены патологические изменения миометрия, гистологически сходные с лейомиомами. Такая картина наблюдалась уже с 8 недели развития животных.
В предыдущем нашем исследовании мы выявили, что в 50% случаев изученных образцов ткани миом присутствовали соматические мутации в экзоне 2 гена MED12. Хотя полученные нами частоты и оказались несколько меньше данных по другим популяциям, несомненно, что и в российской популяции частота соматических мутаций в гене MED12 довольно высока (около 50% по нашим данным и около 70% в ранее опубликованной работе группы авторов из России) [14]. Также нами была выявлена однонуклеотидная замена в положении 107 Т>G – в двух миоматозных узлах одной и той же пациентки. Эта замена является уникальной, в литературных источниках и базах данных она отсутствует [15]. В ранее опубликованной работе по российской популяции [14] в той же позиции была обнаружена соматическая мутация 107 Т>С.
Учитывая данные о наличии «семейных случаев» развития миом, крайне актуальным представляется изучение соматических мутаций в гене MED12 у женщин с отягощенной наследственностью по миоме. Отдельного изучения также требует вопрос о том, насколько гетерогенными могут быть такие мутации в различных миоматозных узлах, развивающихся у пациенток с множественными миомами.
Цель исследования. Выявление генетического маркера развития миомы матки с целью оптимизации диагностики, тактики ведения пациенток с миомой матки и прогнозирования риска рецидивирования путем оценки и сравнения частот и характера соматических мутаций в экзоне 2 гена MED12 у женщин с одиночной и множественной миомой в 2-х группах: 1 группа – женщины с отягощенным анамнезом по миоме, 2 группа – без отягощенного анамнеза, и определение изменчивости вышеуказанного экзона в разных узлах у пациенток с множественными узлами.
Материал и методы исследования
В 2016 году в отделении оперативной гинекологии НЦАГиП были собраны образцы ткани 167 миом от 65 пациенток (от 1 до 5 миоматозных узлов от каждой), а также аликвоты крови всех пациенток.
Всем пациенткам было проведено полное клинико-анамнестическое обследование: сбор анамнеза, общий и гинекологический осмотр, ультразвуковое исследование органов малого таза, клинико-лабораторное обследование. Эндоскопическую операцию проводили по стандартизированной методике с помощью эндовидеохирургического оборудования фирмы KarlStorz (Германия). Сбор образцов тканей миом производился непосредственно во время операций по миомэктомии или гистероэктомии в зависимости от размера и количества узлов. Фрагменты тканей помещались в физиологический раствор, отправлялись в биобанк ФГБУ НЦАГиП им. В.И. Кулакова, и замораживались на –70°С для последующего хранения в коллекции. Образцы каждого узла также подвергались гистологическому исследованию с целью подтверждения наличия исключительно ткани миоматозного узла в образце и отсутствия в нем ткани капсулы или миометрия, в которых, как следует из литературных данных [16] соматические мутации в гене MED12 не встречаются.
Выделение ДНК проводили набором Qiagen (США). Амплификацию ДНК проводили на приборе ДТ прайм (ООО “ДНК-Технология”, Россия). ПЦР-реакция проводилась с праймерами (прямой праймер 5’-TAGTGACCATGGGAGTGAGG–3’ и обратный праймер 5’-GAAGGCAAACTCAGC CACTTAG–3’) на участок экзона 2 гена MED12 (общая длина фрагмента 320 н.п.) [17]. Последовательности фрагментов были определены путем секвенирования методом Сенгера на приборе ABI PRISM 3130 (AppliedBioSystems, США).
В случае детектирования мутации в экзоне гена MED12 проводилось выделение ДНК из крови пациентки и последующий анализ на мутации в экзоне 2 гена MED12. Отсутствие мутации в ДНК крови служило основанием для подтверждения того факта, что обнаруженные в ДНК миомы мутации являются соматическими.
Выборка и данные по пациенткам
В исследовании принимали участие 65 пациенток, разделенных на 2 группы: женщины с отягощенным анамнезом, у которых миома была диагностирована у ближайших родственниц по материнской линии (мама, бабушка, сестра, тетя) – 35 пациенток, собрано 95 образцов миоматозных узлов, из них у 9 была диагностирована одиночная миома, следовательно, получено 9 образцов узлов; у 26 – множественная миома, собрано 86 образцов миом.
Во вторую группу вошли женщины без отягощенного анамнеза по миоме матки (сведения об отягощенности анамнеза получены нами в ходе беседы с пациентками) – 30 пациенток, собрано 72 образца узлов, из них у 13 пациенток диагностирована одиночная миома, собрано 13 образцов миом, у 17 – множественные миомы, собрано 59 образцов миоматозных узлов.
Средний возраст в первой группе составил 38,7 лет, во второй группе – 39,5 лет.
Результаты исследования
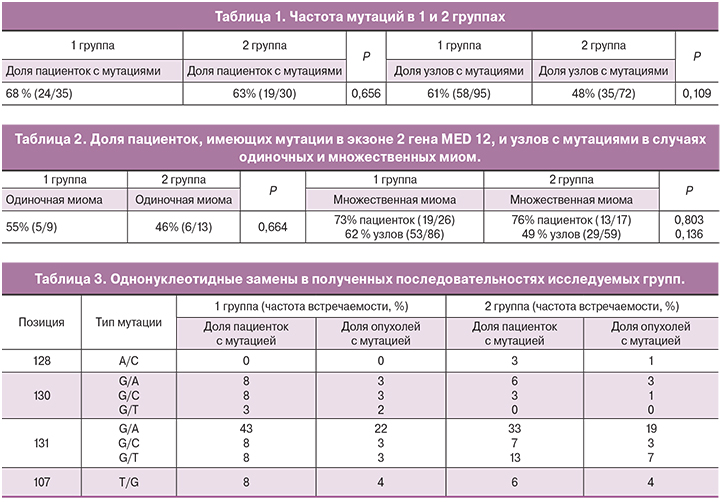
Анализ полученных выборок позволил сравнить группы пациенток по количеству полученных образцов миоматозных узлов. В первой группе одиночный узел обнаружен у 9 пациенток, 2 узла – у 7 пациенток, 3 узла – у 3 пациенток, 4 узла – у 5 пациенток, 5 узлов и более – у 11 пациенток. Во второй группе наблюдалась практически аналогичная картина: одиночный узел – у 13 пациенток, 2 узла – у 4 пациенток, 3 узла – у 4 пациенток, 4 узла – у 3 пациентки, 5 и более узлов – у 6 пациенток. На рисунке 1 приведено сравнение обеих выборок, которое демонстрирует тот факт, что разница в количестве образцов миоматозных узлов в обеих группах небольшая и не влияет на достоверность результатов.
Анализ полученных последовательностей показал, что различные варианты соматических мутаций в экзоне 2 гена MED12 встречались в разном количестве не только в 1 и 2 группах, но и в подгруппах с одиночными и множественными узлами. Доля пациенток 1 группы, у которых были обнаружены мутации, составила 68% (у 24 пациенток из 35), доля миоматозных узлов с мутациями составила 61% (58 узлов из 95). Во второй группе доля пациенток с мутациями составила 63% (19 пациенток из 30), при этом доля миоматозных узлов с мутациями составила 48% (35 узлов из 72 образцов). Данные приведены в таблице 1.
В результате анализа мутаций, обнаруженных в подгруппах женщин с одиночной и множественной миомой, нам удалось выявить возможную взаимосвязь количества узлов у женщин с наличием у них мутаций в экзоне 2 гена MED12. Таким образом, мы выявили, что у 55% пациенток с отягощенным анамнезом и диагностированной одиночной миомой (у 5 пациенток из 9) имеются мутации в гене MED12. У 26 женщин первой группы была обнаружена множественная миома матки, при этом доля пациенток с мутациями в гене MED12 составила 73% (у 19 пациенток из 26), доля миоматозных узлов в данной подгруппе с соматическими мутациями в исследуемом гене составила 62% (53 узла из 86). Только 9 пациенток из 26 (35%) имели однообразные мутации.
Во второй группе одиночный узел был диагностирован у 13 пациенток, у 6 из которых в экзоне 2 гена MED12 были обнаружены различные варианты соматических мутаций гена MED12, что составило 46%. 13 пациенток с множественной миомой также имели мутации в данном гене, что составило 76% (13 пациенток из 17), при этом доля миоматозных узлов с мутациями составила 49% (29 узлов из 50 образцов). Однообразные мутации наблюдались только у 41% (у 7 из 17). Для сравнения двух групп данные приведены на рисунках 2, 3 и 4 и в таблице 2.
При сравнении данных показателей с результатами, полученными в предыдущем исследовании, где доля мутаций в случайной выборке составила 50% [15], мы можем сделать вывод, что мутации в гене MED12, вероятно, имеют связь с наследственной отягощенностью. Высокая частота встречаемости мутаций во второй группе, скорее всего, связана с недостаточной осведомленностью пациенток о своем семейном анамнезе.
Данная картина наблюдается и при сравнении пациенток и узлов с мутациями в случаях одиночных и множественных миом, где частота мутаций выше у пациенток с отягощенным анамнезом.
Однонуклеотидные замены
В экзоне 2 гена MED12 было выявлено 8 вариантов однонуклеотидных замен в 4 позициях (табл.3).
Так, в позиции 128 был обнаружен один вариант однонyклеотидной замены (А/С), выявленный у одной пациентки из 2 группы, для позиции 130 описано 3 варианта мутаций, встречающихся в обеих группах. Мутации 131 (G/A, G/C, G/T) выявляются чаще остальных, при этом замена G/A выявлена у большего количества пациенток. Для позиции 107 описан 1 вариант мутации, который также обнаруживается в обеих группах пациенток.
У всех пациенток с обнаруженными мутациями были проверены образцы крови. Все обнаруженные мутации оказались соматическими, так как изменений в ДНК крови в экзоне 2 гена MED12 обнаружено не было.
Выводы
Большее разнообразие и количество мутаций встречается в 1 группе пациенток, что свидетельствует о возможной взаимосвязи возникновения данной соматической мутации с отягощенным анамнезом пациенток.
У женщин с множественными миомами частота соматических мутаций в экзоне 2 гена MED12 выше по сравнению с женщинами с одиночной миомой, что указывает на преимущественное развитие множественного миоматоза в результате соматической мутации в гене MED12. Данный факт может быть использован в качестве прогностического фактора возможного развития множественной миомы у женщины, имеющей 1 узел на момент обследования.
У пациенток с множественными миомами также наблюдается одновременное носительство нескольких вариантов мутаций в разных узлах и сочетание разных однонуклеотидных замен и делеций у одной пациентки. Вероятно, это следствие неспецифичности механизма, вызывающего данные соматические мутации.
Делеции
При анализе полученной выборки был обнаружен еще один вариант соматической мутации – делеция. Они встречаются реже, чем однонуклеотидные замены в изучаемых последовательностях, однако локализация данных делеций в большинстве случаев именно те два кодона экзона 2 (43 и 44), в которых чаще всего обнаруживаются замены.
В 1 исследуемой группе делеции были обнаружены у 12 пациенток (34%). Данные делеции представлены в таблице 3. В 3-х случаях у одной и той же пациентки обнаружены разные делеции в 2-х разных узлах в случае множественных миом, при этом делеции в множественных миомах сочетаются с однонуклеотидными заменами.
Во 2 исследуемой группе, как и следовало ожидать, обнаружено меньшее количество делеций, у 4 пациенток (13%). Как и в первой группе, делеции в множественных миомах сочетаются с однонуклеотидными заменами (табл. 5).
Доля делеций в исследуемых образцах больше у женщин с отягощенным анамнезом и составляет 34% (у 12 пациенток из 35) против 13% во второй группе (у 4 пациенток из 30).
Выводы
У женщин с отягощенным анамнезом встречается большее количество и разнообразие делеций, по сравнению с женщинами без отягощенного анамнеза.
Локализация делеций определяется в пределах тех же участков, где обычно обнаруживаются однонуклеотидные замены.
В случаях множественных миом обнаруживается одновременное сочетание делеций разных длин и сочетание делеций и однонуклеотидных замен в разных узлах у одной пациентки.
Только некоторые делеции из обнаруженных зарегистрированы в dbSNP, тогда как все остальные, описанные в статье, а также вставка, являются новыми.
В одном единственном случае у пациентки с диагностированной множественной миомой матки в одном из узлов была обнаружена вставка длиною в 6 н.п. Данная мутация является уникальной, так как ранее она не была описана в литературных источниках и отсутствовала в базах данных. Пациентка 164 входила в группу женщин с отягощенным анамнезом по миоме матки. Данный диагноз также был поставлен ее матери и сестре-близнецу. У пациентки было взято 4 образца миоматозных узлов, в двух из них были обнаружены однонуклеотидные замены: 1 узел – G/T131, 2 узел – G/A 131, 3 узел – вставка 6 н.п., 4 узел – делеция 41 н.п.
Обсуждение
Сравнивая приведенные выше результаты с данными, полученными в нашем предыдущем исследовании, где доля соматических мутаций в экзоне 2 гена MED12 в случайной выборке составила 50% [15], мы считаем возможным высказать гипотезу о роли наследственного фактора в развитии данных мутаций, и, как следствие, развитии миомы матки, т.к. наследственная компонента в настоящей работе определила большую частоту мутаций у женщин с миомой матки.
Хотя мутации в экзоне 2 гена MED12 являются соматическими, а механизм, вызывающий эти мутации, направлен на конкретную мишень – экзон 2, но очевидно, что гипотетический механизм, вызывающий такого рода мутации, не является специфическим, то есть вызывает очень разнообразные изменения именно в эзконе 2 гена MED12, иногда затрагивая расположенный перед ним интрон. Иллюстрацией неспецифичности такого механизма является тот факт, что у одной пациентки с множественной миомой матки в разных узлах могут быть обнаружены различные мутации. Наиболее ярким клиническим примером данного предположения является случай, описанный выше. У пациентки с семейной формой миомы матки было взято 4 образца миоматозных узлов, и в каждом из них были обнаружены различные мутации: 1 узел – G/T131, 2 узел – G/A 131, 3 узел – вставка 6 н.п., 4 узел– делеция 41 н.п. Обнаруженная нами вставка является уникальной соматической мутацией в экзоне 2 гена MED12. Данные о ней в литературных источниках и базах данных отсутствуют.
Наиболее часто встречающейся однонуклеотидной заменой в экзоне 2 гена MED12 является замена G/A в положении 131, которая была описана в многочисленных исследованиях последних лет [7]. Согласно нашим данным, данная мутация обнаруживается у 43% женщин из первой группы и у 33% пациенток второй группы, что, действительно, подтверждает ее высокую распространенность.
Обнаруженная нами однонуклеотидная замена 107 T/G, которая впервые была описана в предыдущем нашем исследовании [15], в настоящей работе была обнаружена у большего числа женщин: у 3 пациенток с семейной формой миомы матки и у 2 пациенток без отягощенного анамнеза по миоме матки. Данный факт позволяет нам сделать вывод о том, что однонуклеотидная замена в положении 107 вероятно характерна для российской популяции. Ранее в этом положении была обнаружена еще одна замена Т/С [18]. Этот факт доказывает, что данная позиция, наряду с кодонами 43 и 44, также является «горячей точкой» для возникновения соматических мутаций в экзоне 2 гена MED12.
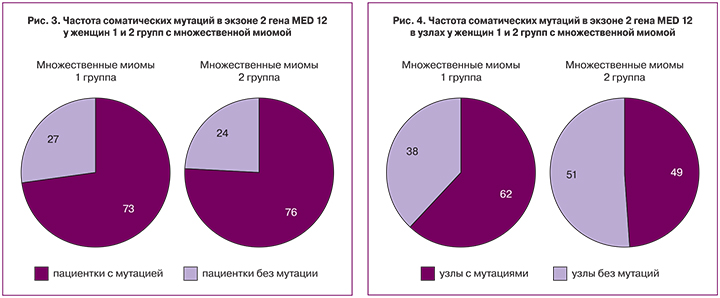
Последние публикации в области изучения генетических факторов развития миомы матки большей частью посвящены соматическим мутациям в экзоне 2 гена MED12. Согласно полученным в работе Осиновской Н.С. и соавторов данным, мутации у женщин с множественной миомой встречались в 61% образцов миоматозных узлов, в то время как у пациенток с одиночной миомой этот показатель был равен 32,5% [18]. Авторы данной работы сделали вывод, что множественные миомы преимущественно развиваются в результате мутаций в гене MED12, что, вероятно, не свойственно одиночным миомам. Полученные нами частоты встречаемости соматических мутаций в гене MED12 у женщин с множественной и одиночной миомой подтверждают данную гипотезу, а также указывают на связь наследственной компоненты, повышающей вероятность возникновения соматических мутаций в гене MED12, вызывающих развитие миом.
Дальнейшие исследования в области изучения соматических мутаций гена MED12 могут кардинально изменить подход к ведению и лечению пациенток с мутациями в исследуемом гене. У нас имеются предположения, согласно которым патогенез опухолей с мутациями несколько отличается от патогенеза опухолей, в которых мутации не обнаруживаются. Возможно, исследование этих различий поможет найти взаимосвязь между типом мутации и прогнозом течения заболевания, риском рецидивирования после хирургического удаления миом, то есть «агрессивностью» течения заболевания, а также выявить новый генетический маркер развития миомы матки для оптимизации диагностики, тактики ведения пациенток с миомой матки и прогнозирования риска рецидивирования.
Заключение
Изучение соматических мутаций гена MED12 подтвердило тот факт, что данный ген является одним из ключевых, связанных с патогенезом миомы матки.
Полученные нами данные подтвердили распространенность соматических мутаций в гене MED12 у женщин с миомой матки, а также обнаружили взаимосвязь соматических мутаций исследуемого гена с отягощенным анамнезом у пациенток. Согласно полученным нами результатам, наследственная компонента имеет определенное влияние на частоту и разнообразие соматических мутаций в экзоне 2 гена MED12, что объясняет роль мутаций данного гена в развитии семейных форм миомы матки.
Впервые нами была обнаружена соматическая мутация – вставка длиной 6 н.п., локализованная в экзоне 2 гена MED12, которая ранее в литературных данных не встречалась. Возможно, она специфична для российской популяции.
Насыщенность подгрупп пациенток с множественными миоматозными узлами соматическими мутациями в экзоне 2 гена MED12 свидетельствует о преимущественном развитии множественной миомы матки в результате соматических мутаций в гене MED12, что, согласно полученным нами данным, в меньшей степени свойственно одиночным узлам.
Таким образом, выявление соматических мутаций в экзоне 2 гена MED12 может быть использовано в качестве современного метода ранней диагностики развития миомы матки, предиктора развития семейных форм данного заболевания, а также оценки рисков рецидивирования, что в дальнейшем может сыграть ключевую роль в выборе тактики ведения пациенток (объем предполагаемого хирургического вмешательства, агрессивная противорецидивная терапия, подготовка к беременности, применение программ вспомогательных репродуктивных технологий и т.д.).
Основная задача дальнейших исследований – изучение молекулярных механизмов формирования соматических мутаций (в первую очередь наследственных факторов, обуславливающих повышенную частоту возникновения таких мутаций) и обнаружение возможной взаимосвязи между наличием мутации в исследуемом гене и риском развития рецидивирования миомы матки у пациентки, прошедшей хирургическое лечение по поводу данного заболевания.



