Выбор эмбриона с оптимальным имплантационным потенциалом является одной из главных нерешенных проблем в клинической практике вспомогательных репродуктивных технологий (ВРТ). Ни один из существующих на сегодняшний день неинвазивных методов оценки качества эмбрионов не позволяет достоверно определить его имплантационный потенциал и исключить наличие хромосомных аномалий. Известно, что даже при переносе морфологически качественного эмбриона в эндометрий, структурно соответствующий фазе менструального цикла, беременность наступает далеко не во всех случаях, и даже при успешной имплантации может прекратить свое развитие на ранних сроках [1]. Без сомнений, значительный вклад в этиологию неудач имплантации и ранних репродуктивных потерь беременности вносят хромосомные аномалии эмбрионов [2]. При этом значительная часть морфологически нормальных эмбрионов могут быть анеуплоидными [3]. Частота образования анеуплоидных эмбрионов в программах ВРТ достаточно высока и варьирует в пределах 54–84% в зависимости от возраста и анамнеза супружеской пары [3]. Поэтому в определенных клинических случаях традиционной оценки морфологических и морфокинетических критериев эмбрионов оказывается недостаточно для селективного переноса эмбриона в полость матки и улучшения исходов программ ВРТ.
Внедрение в клиническую практику преимплантационного генетического тестирования на анеуплоидии (ПГТ-А) открыло новые перспективы в диагностике хромосомных аномалий эмбрионов на доимплантационном этапе и вселило надежду на улучшение исходов программ ВРТ у пациентов с высокой вероятностью образования анеуплоидных эмбрионов. По мере своего развития ПГТ-А претерпело значительные изменения: были усовершенствованы техники биопсии эмбрионов, разработаны новые методы анализа молекулярного кариотипа, позволяющие с высокой точностью исследовать весь хромосомный набор эмбриона [4].
Однако на сегодняшний день роль ПГТ-А в исходах программ ВРТ является предметом острых дискуссий. Результаты многочисленных исследований продемонстрировали спорные данные в отношении влияния ПГТ-А на эффективность программ ВРТ у разных групп пациентов [5–8].
Согласно утвержденным клиническим рекомендациям по диагностике и лечению бесплодия от 2019 г. [9], проведение ПГТ-А может быть рекомендовано в следующих клинических случаях: старший репродуктивный возраст женщины; привычный выкидыш; повторные неудачные попытки имплантации; тяжелые нарушения сперматогенеза у мужчин.
Возраст женщины является ключевым фактором, ассоциированным с образованием анеуплоидных эмбрионов. Так, если в возрасте 26–30 лет частота образования анеуплоидных эмбрионов у женщин составляет 20–27%, то к 45 годам она достигает уже 95,5% [10]. На сегодняшний день нет сомнений в наличии высокой положительной корреляции между возрастом матери и частотой эмбриональных анеуплоидий [10]. Согласно данным литературы, проведение ПГТ-А пациентам старшего репродуктивного возраста улучшает исходы программ ВРТ. Однако результаты исследований в других группах пациентов не столь однозначны [11].
Частота ранних репродуктивных потерь в программах ВРТ составляет примерно 10–15% [12]. Одной из ведущих причин привычного выкидыша принято считать генетический фактор; при этом, чем меньше срок гестации, тем выше вероятность хромосомной анеуплоидии эмбриона [13]. Так, по результатам молекулярного кариотипирования в 65–70% случаев спонтанного самопроизвольного прерывания беременности до 10-й недели гестации диагностируются хромосомные аномалии абортивного материала [14]. Согласно опубликованным данным, проведение ПГТ-А может снизить риск спонтанного прерывания беременности в программах ВРТ [11].
Несмотря на колоссальное развитие ВРТ, около 60% женщин не способны забеременеть после первой программы экстракорпорального оплодотворения (ЭКО), а 20% пациенток – после третьей программы ЭКО [15]. Повторные неудачные попытки имплантации диагностируются примерно у каждой третьей женщины, использующей методы ВРТ для лечения бесплодия. Их причины могут быть ассоциированы с эмбриональным, маточным, ооцитарным, иммунологическими факторами, тромбофилическими состояниями, генетическими нарушениями у родителей, а также с тяжелой патозооспермией партнера [16, 17]. Считается, что роль эмбриона в повторных неудачных попытках имплантации составляет около 30-50%. Весомый вклад, по-видимому, вносят хромосомные аномалии эмбриона [18]. Существуют данные, свидетельствующее о двукратном увеличении частоты образования анеуплоидных эмбрионов с вовлечением 13, 16, 18, 21, 22, Х или Y хромосомы у женщин с повторными неудачными попытками имплантации в анамнезе, по сравнению с группой контроля [19].
Целесообразность проведения ПГТ-А при тяжелых нарушениях сперматогенеза у мужчин является спорной. Известно, что у пациентов с тяжелой олигоастенотератозооспермией отмечается высокая частота хромосомных аберраций, включая количественные и структурные аномалии кариотипа, которые могут приводить к сбоям в течении ключевых этапов первого мейотического деления и, как следствие, к образованию сперматозоидов и эмбрионов с несбалансированными хромосомными перестройками [20, 21]. Также было показано, что частота эуплоидных эмбрионов снижается, как у мужчин с низким содержанием морфологически нормальных сперматозоидов, так и с повышенной фрагментацией ДНК сперматозоидов [22–24]. Однако несколько недавно опубликованных исследований продемонстрировало отсутствие положительного влияния ПГТ-А на исходы программ ВРТ в данной группе пациентов [6–8].
Цель данного исследования: оценить влияние результата ПГТ-А на исходы программ ВРТ в различных группах пациентов.
Материалы и методы
В обсервационном исследовании было проанализировано 800 циклов ЭКО с криоконсервацией эмбрионов и последующими криопротоколами, проведенными на базе НМИЦ АГП им. В.И. Кулакова в период с 2018 по 2021 гг.
На основании анамнеза супружеских пар было сформировано 4 группы пациентов:
- I группу составили 165 супружеских пар со старшим репродуктивным возрастом женщины (38 лет и более), которые были разделены на 2 подгруппы: Iа (основная) включала 100 программ ЭКО/ИКСИ+ПГТ-А и 52 криопротокола, Ib (контрольная) – 100 программ ЭКО/ИКСИ без ПГТ-А и 61 криопротокол.
- II группу составили 178 супружеских пар с бесплодием и привычным выкидышем в анамнезе (2 и более самопроизвольных прерываний беременности на сроке до 22 недель), которые были разделены на 2 подгруппы: IIа (основная) включала 100 циклов ЭКО/ИКСИ+ПГТ-А и 90 криопротоколов, IIb (контрольная) – 100 циклов ЭКО/ИКСИ без ПГТ-А и 84 криопротокола.
- III группу составили 168 супружеских пар с повторными неудачными попытками имплантации (3 и более неудачных попыток селективного переноса «свежих» или размороженных эмбрионов), которые были разделены на 2 подгруппы: IIIа (основная) включала 100 циклов ЭКО/ИКСИ+ПГТ-А и 88 криопротоколов, IIIb (контрольная) – 100 циклов ЭКО/ИКСИ без ПГТ-А и 114 криопротоколов.
- IV группу составили 164 супружеские пары с тяжелыми нарушениями сперматогенеза у мужчин (тяжелая олигоастенотератозооспермия), которые были разделены на 2 подгруппы: IVа (основная) включала 100 циклов ЭКО/ИКСИ+ПГТ-А и 79 криопротоколов, IVb (контрольная) – 100 циклов ЭКО/ИКСИ без ПГТ-А и 98 криопротоколов.
Критериями включения в исследуемые группы послужили: отсутствие наступления беременности в течение 1 года и более, нормальный кариотип супругов. Для I группы – возраст женщины 38 лет и более; для II группы – 2 и более самопроизвольных прерываний беременности на сроке до 22 недель в анамнезе, возраст женщины менее 35 лет; для III группы – наличие 3 и более неудачных попыток селективного переноса «свежих» или размороженных эмбрионов, возраст женщины менее 35 лет; для IV группы – концентрация сперматозоидов – менее 5 млн/мл, количество прогрессивно подвижных сперматозоидов (а+b) – менее 29%, количество морфологически нормальных форм сперматозоидов – 2% и менее по результатам спермограммы, возраст женщины менее 35 лет.
Критериями невключения в исследуемые группы послужили: хронический эндометрит, верифицированный при гистологическом исследовании, толщина эндометрия менее 7 мм, наружный генитальный эндометриоз III–IV cтадии, синдром поликистозных яичников, антифосфолипидный синдром, тромбофилии высокого риска тромбоэмболических осложнений, а также все состояния, являющиеся противопоказаниями к проведению ВРТ и беременности в соответствии с приказом МЗ РФ от 31 июля 2020 г. № 803н.
Всем супружеским парам проведено полное клинико-лабораторное обследование в соответствии с приказом МЗ РФ от 31 июля 2020 г. № 803н.
Овариальная стимуляция проводилась по стандартным протоколам с антагонистом гонадотропин-рилизинг-гормона (антГнРГ) или с агонистом гонадотропин-рилизинг-гормона (аГнРГ). Все эмбрионы культивировались в индивидуальных каплях в мультигазовых инкубаторах. Оценка качества полученных эмбрионов проводилась на 5-е сутки культивирования на основании морфологических критериев в соответствии с классификацией Гарднера (ESHRE 2011 «модифицированная» классификация D. Gardner). В основных группах всем эмбрионам хорошего и отличного качества (3ВВ и выше) проводилась биопсия клеток трофэктодермы с последующей криоконсервацией эмбриона. Полученные клетки трофэктодермы переносили в пробирки типа Eppendorf, содержащие лизирующий буфер, для последующего ПГТ-А, которое проводилось методом высокопроизводительного секвенирования ДНК нового поколения (NGS, next-generation sequencing). Эуплоидный по результатам ПГТ-А эмбрион переносили в полость матки в рамках криопротокола на фоне циклической гормональной терапии или в естественном менструальном цикле при достижении толщины эндометрия более 7 мм. В контрольных группах эмбрионы хорошего и отличного качества подвергались криоконсервации для последующего селективного переноса в полость матки в рамках криопротокола. На 10-й день после переноса эмбриона в полость матки проводился анализ крови на β-субъединицу хорионического горнадотропина человека (ХГЧ). Для диагностики клинической беременности при положительном результате анализа крови на β-ХГЧ через 21 день после переноса выполняли трансвагинальное ультразвуковое исследование. Дальнейшее наблюдение и ведение беременности осуществлялось в индивидуальном порядке лечащим врачом.
Статистический анализ
Проведен статистический анализ исходов программ ВРТ с ПГТ-А и без него в различных группах пациентов. Статистическая обработка данных выполнена с использованием программ IBM SРSS Statistics. Для описания категориальных бинарных данных использовали абсолютные значения и процентные доли от общего числа в группе. Определение вида распределения данных проводилась с помощью построения диаграмм размаха. Непрерывные переменные c ассиметричным распределением представлены в виде медианы и межквартильных значений (Ме (Q1; Q3)). Для оценки различий в исследуемых группах использовали непараметрический критерий Манна–Уитни. Сравнение результатов исходов программ ВРТ в основных и контрольных группах проводили с помощью критерия Хи-квадрат (χ2). За величину порогового уровня статистически значимых различий показателей в исследуемых группах принимали значения p≤0,05.
Результаты
Клинико-лабораторные данные пациентов представлены в таблице 1.
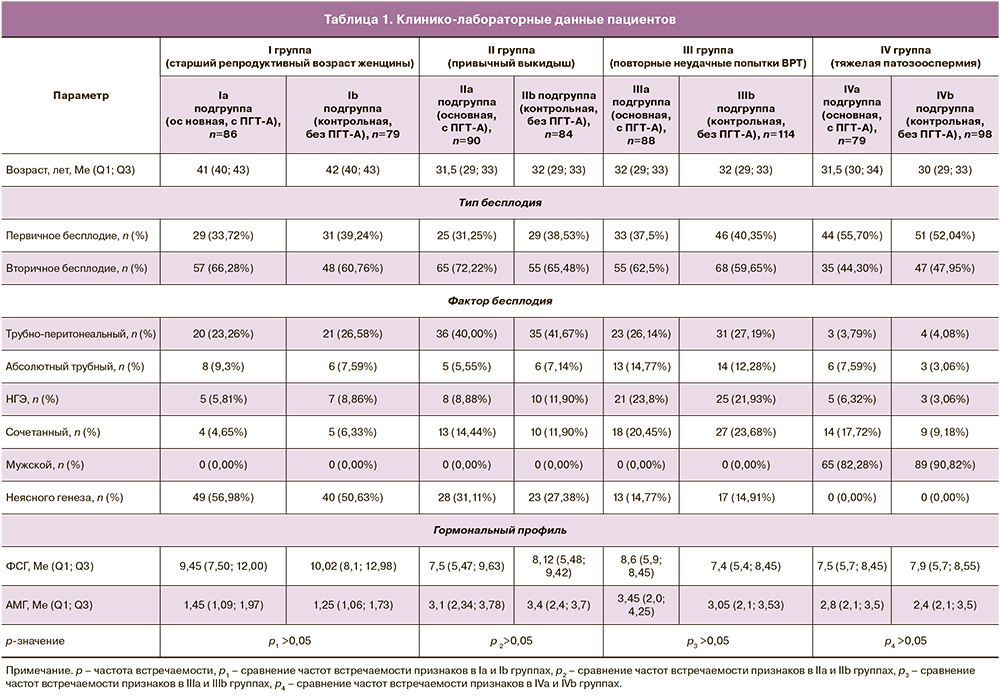
Исходы криопротоколов у пациенток старшего репродуктивного возраста представлены в таблице 2. Всего в Ia подгруппе (основная) было проанализировано 86 супружеских пар, 100 циклов программ ЭКО/ИКСИ+ПГТ-А (среднее значение циклов на пациентку – 1,2) и 52 криопротокола. В контрольной Ib подгруппе – 79 супружеских пар, 100 циклов программ ЭКО/ИКСИ без ПГТ-А (среднее значение циклов на пациентку – 1,3) и 61 криопротокол.
Всего в основной подгруппе (Ia) было получено и отправлено на ПГТ-А 211 эмбрионов из 305 бластоцист 5-х и 6-х суток культивирования, что составило 211/305 (69,2%). При этом доля эуплоидных эмбрионов составила 58/211 (27,5%). По результатам анализа исходов 52 криопротоколов в основной группе частота наступления клинической беременности составила 19/52 (36,5%), биохимических беременностей зафиксировано не было. Доля ранних репродуктивных потерь составила 3/19 (15,8%). Также однократно были зарегистрированы преждевременные роды – 1/19 (5,3%). Частота живорождения составила 16/19 (84,2%).
При анализе исходов в контрольной подгруппе (Ib) частота клинической беременности на перенос составила 7/61 (11,5%). Доля биохимических беременностей составила 1/61 (1,6%). Доля ранних репродуктивных потерь – 1/7 (14,3%), частота живорождения – 5/7 (71,4%). Также была зарегистрирована одна внематочная беременность – 1/7 (14,3%).
Таким образом, частота клинической беременности в Ia подгруппе была статистически значимо выше таковой в Ib подгруппе (р=0,002; ОР (95% ДИ)=3,18 (1,45; 6,97)). Однако не было выявлено статистически значимого увеличения родов живым плодом в Ia подгруппе, по сравнению с Ib подгруппой. Также не было выявлено статистически значимых различий в частоте ранних репродуктивных потерь.
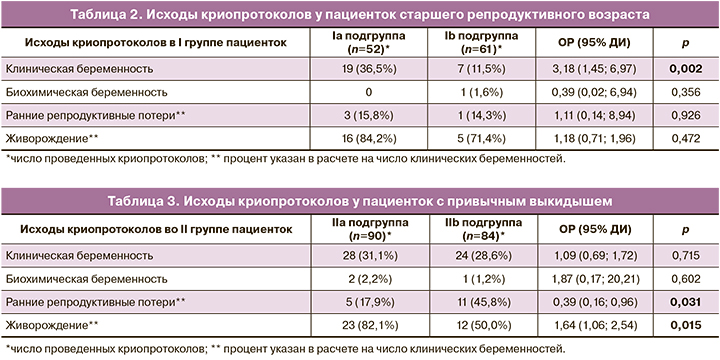
Исходы криопротоколов у пациенток с привычным выкидышем представлены в таблице 3. Всего в основной (IIa подгруппе) было проанализировано 90 супружеских пар, 100 циклов программ ЭКО/ИКСИ+ПГТ-А (среднее значение циклов на пациентку – 1,1) и 90 криопротоколов. В контрольной подгруппе (IIb) – 88 супружеских пар, 100 циклов программ ЭКО/ИКСИ без ПГТ-А (среднее значение циклов на пациентку – 1,1) и 84 криопротокола.
Всего в IIa подгруппе было получено и отправлено на ПГТ-А 341 эмбрион из 583 бластоцисты 5-х и 6-х суток культивирования, что составило 58,5%. При этом доля эуплоидных эмбрионов составила 162/341 (47,5%). В рамках криопротокола было перенесено 90/162 (55,6%) эмбрионов. Частота наступления клинической беременности составила 28/90 (31,1%), биохимической беременности – 2/90 (2,2%). Частота ранних репродуктивных потерь составила 5/28 (17,9%), частота преждевременных родов – 2/28 (7,2%); частота живорождения – 23/28 (82,1%).
При анализе исходов в IIb подгруппе частота клинической беременности составила 24/84 (28,6%), биохимических беременностей – 1/84 (1,2%); частота ранних репродуктивных потерь – 11/24 (45,8%), частота поздних выкидышей – 1/24 (4,7%), частота преждевременных родов – 1/24 (4,7%); частота живорождения – 12/24 (50,0%).
Таким образом, не было выявлено статистически значимых различий в частоте клинической беременности в IIa и IIb подгруппах. Частота живорождения в IIa подгруппе статистически значимо выше, по сравнению с таковой в IIb подгруппе (р=0,015; ОР (95% ДИ) = 1,64 (1,06; 2,54)). Выявлено статистически значимое снижение частоты репродуктивных потерь в IIa подгруппе по сравнению с IIb подгруппой (р=0,031; ОР (95% ДИ)=0,39 (0,16; 0,96)).
Исходы криопротоколов у пациенток с повторными неудачными попытками имплантации представлены в таблице 4. Всего в основной группе было проанализировано 80 супружеских пар, 100 циклов программ ЭКО/ИКСИ+ПГТ-А (среднее значение циклов на пациентку – 1,1) и 88 криопротоколов. В контрольной группе – 76 супружеских пар, 100 циклов программ ЭКО/ИКСИ без ПГТ-А (среднее значение циклов на пациентку – 1,1) и 114 криопротоколов.

Всего в IIIa подгруппе было получено и отправлено на ПГТ-А 277 эмбрионов из 424 бластоцист 5-х и 6-х суток культивирования, что составило 65,33%. При этом доля эуплоидных эмбрионов составила 150/277 (54,2%). Частота наступления клинической беременности в основной подгруппе составила 29/88 (33,0%), биохимических беременностей зарегистрировано не было. Частота ранних репродуктивных потерь составила 2/29 (6,9%); частота живорождения – 27/29 (93,1%), среди них был зарегистрирован один случай рождения ребенка с врожденным пороком сердца (дефект межжелудочковой перегородки).
При анализе исходов в IIIb подгруппе частота клинической беременности составила 19/114 (16,7%); частота биохимических беременностей – 4/114 (3,5%). Частота ранних репродуктивных потерь составила 2/19 (10,5%), частота живорождения – 17/19 (89,4%).
Таким образом, выявлено статистически значимое увеличение частоты клинической беременности в IIIa подгруппе, по сравнению с таковой в IIIb подгруппе (p=0,007; ОР (95% ДИ)=1,98 (1,19; 3,28)). Частота живорождения и ранних репродуктивных потерь значимо не различались в основной и контрольной подгруппах.
Исходы криопротоколов у пациенток с тяжелой патозооспермией супруга представлены в таблице 5. Всего в основной подгруппе было проанализировано 85 супружеских пар, 100 циклов программ ЭКО/ИКСИ+ПГТ-А (среднее значение циклов на пациентку – 1,1) и 79 криопротоколов. В контрольной подгруппе – 92 супружеских пары, 100 циклов программ ЭКО/ИКСИ без ПГТ-А (среднее значение циклов на пациентку – 1,1) и 98 криопротоколов.
Всего в IVa подгруппе было получено и отправлено на ПГТ-А 286 эмбрионов из 429 бластоцист 5-х и 6-х суток культивирования, что составило 66,7%. При этом доля эуплоидных эмбрионов составила 158/286 (55,2%). Частота наступления клинической беременности составила 30/79 (38,0%), биохимических беременностей – 2/79 (2,5%). Частота ранних репродуктивных потерь составила 3/30 (10,0%), также был зарегистрирован поздний выкидыш – 1/30 (3,3%). Частота живорождения составила 27/30 (90,0%).
В IVb подгруппе частота беременности составила 39/98 (39,8%). Биохимических беременностей диагностировано не было. Частота ранних репродуктивных потерь составила 5/39 (12,8%), частота преждевременных родов – 1/39 (2,6%), частота живорождения – 34/39 (87,2%).
Таким образом, не было выявлено статистически значимых различий в частоте клинической беременности, а также в частоте ранних репродуктивных потерь и в частоте живорождения между IVa и IVb подгруппами.
Обсуждение
В последние годы отмечается тенденция к увеличению использования ПГТ-А в программах ВРТ. Так, если в 2016 г. частота проведения программ ЭКО/ИКСИ+ПГТ-А составила 6%, в 2017 и 2018 гг. – 8%, то в 2019 г. уже 19% [2]. Считается, что применение ПГТ-А у супружеских пар с высоким риском образования анеуплоидных эмбрионов увеличивает частоту клинической беременности и живорождения, а также снижает частоту ранних репродуктивных потерь [11]. Однако все больше исследований демонстрируют спорные данные о влиянии ПГТ-А на исходы программ ВРТ в данных группах пациентов [11]. На сегодняшний день недостаточно достоверных данных, подтверждающих положительное влияние ПГТ-А на исходы программ ВРТ. В связи с этим целесообразность применения ПГТ-А в различных группах пациенток требует обсуждений.
В недавнем крупном обсервационном исследовании, включавшем 2538 женщин старшего репродуктивного возраста, было продемонстрировано положительное влияние ПГТ-А на исходы программ ВРТ. Отмечалось значительное увеличение частоты живорождения, снижение частоты ранних репродуктивных потерь и многоплодных беременностей в основной группе, по сравнению с контролем [25]. В нашем исследовании получены аналогичные результаты: у пациенток в возрасте 38 лет и старше частота клинической беременности была статистически значимо выше в группе ЭКО/ИКСИ+ПГТ-А, по сравнению с контролем. Вероятность родов живым плодом была выше в группе с ПГТ-А, по сравнению с контролем. Полученные данные подтверждают, что именно образование анеуплоидных эмбрионов у пациенток старшего репродуктивного возраста играет основную роль в неудачах ВРТ. Применение ПГТ-А в данной группе пациенток может нивелировать негативное влияние возраста на исход программы ВРТ при переносе эуплоидного эмбриона.
В крупнейшем на сегодняшний день исследовании, включавшем пациенток с идиопатическим привычным выкидышем разных возрастных групп, не было выявлено снижения частоты ранних репродуктивных потерь при использовании ПГТ-А [5]. Однако было продемонстрировано увеличение частоты клинических беременностей и живорождения при использовании ПГТ-А у женщин всех возрастных групп, в том числе младше 35 лет. Полученные результаты противоречат данным другого рандомизированного исследования, в котором частота клинических беременностей была выше только у женщин в возрасте от 35 до 40 лет, которые подвержены высокому риску образования анеуплоидных эмбрионов [26]. При этом ни в одной возрастной группе не было выявлено достоверных различий в частоте выкидышей и живорождения при использовании ПГТ-А, по сравнению с контролем. В нашем исследовании частота ранних репродуктивных потерь и живорождения была статистически значимо ниже в группе с ПГТ-А, по сравнению с контрольной. При этом частота наступления клинической беременности не различалась в обеих группах. Спорные результаты исследований могут быть связаны с различными методами проведения ПГТ-А. На результатах исследования также может сказаться ретроспективный анализ данных пациентов, недостаточное обследование пар, направленное на выявление других, не связанных с анеуплоидией, причин невынашивания. По-видимому, использование ПГТ-А может быть целесообразным в группе пациентов с привычным выкидышем при условии исключения других причин невынашивания беременности.
У пациентов с повторными неудачными попытками имплантации, согласно данным Sato et al. (2019), статистически значимых различий в показателях живорождения и частоте ранних репродуктивных потерь при использовании ПГТ-А и без него выявлено не было [27]. Однако частота имплантации была существенно выше в группе пациентов с ПГТ-А, по сравнению с контролем. Аналогичные результаты получены и в других исследованиях [28, 29]. Amelia Pantou et al. (2022) в своем исследовании продемонстрировали положительное влияние ПГТ-А и на частоту наступления клинической беременности, и на частоту живорождения [30]. В нашем исследовании также выявлено увеличение частоты наступления беременности при использовании ПГТ-А, по сравнению с контролем. Однако не было выявлено достоверных различий в частоте живорождения и ранних репродуктивных потерь между группами. По-видимому, перенос качественного здорового эмбриона играет более важную роль в исходах программ ВРТ, по сравнению с акушерско-гинекологическим анамнезом и, в том числе, с состоянием эндометрия. Однако на сегодняшний день опубликовано лишь небольшое количество исследований, направленных на оценку влияния ПГТ-А в данной группе пациентов. И, несмотря на то, что все они подтверждают улучшение исходов ВРТ после ПГТ-А, необходимо проведение многоцентровых рандомизированных контролируемых исследований с большей выборкой пациентов и более персонализированным подходом к выбору кандидатов для участия в работе.
Согласно данным нескольких исследований, у пациентов с мужским фактором бесплодия значительно возрастает частота образования мозаичных эмбрионов [31]. По результатам исследования Rossella Mazzilli et al. (2017), эмбрионы, полученные от пациентов с тяжелой патозооспермией, характеризуются сниженной скоростью оплодотворения и более медленным эмбриональным развитием на доимплантационном этапе [32]. Однако тяжелый мужской фактор не оказывал влияния на плоидность эмбрионов и их имплантационный потенциал. В недавнем исследовании Mehmet Resit Asoglu et al. (2022), включавшем пациентов с тяжелым мужским фактором было продемонстрировано отсутствие положительного влияния ПГТ-А на исходы программ ВРТ: не было статистически значимых различий ни в частоте клинической беременности, ни в частоте живорождения [33]. В нашем исследовании также не было продемонстрировано положительного влияния на исходы программ ВРТ у пациентов с тяжелой патозооспермией. По-видимому, тяжелый мужской фактор бесплодия не является критическим фактором в этиологии образования анеуплоидных эмбрионов. Это может быть связано с репаративной способностью ооцитов восстанавливать кариотип до момента активации зиготического генома или с тем фактом, что анеуплоидии отцовского генеза могут приводить к остановке в эмбриональном развитии на более ранних этапах [11]. Однако необходимы дальнейшие исследования для оценки влияния ПГТ-А на результативность программ ВРТ в данной группе пациентов.
Следует отметить, что отсутствие положительного влияния ПГТ-А на исходы программ ВРТ может быть связано и с ограничениями самого метода. Так, наиболее оптимальным среди всех существующих методов ПГТ-А является NGS, а самым безопасным с точки зрения инвазивности способом забора материала – биопсия клеток трофэктодермы. И хотя точность NGS стремится к 99%, не исключается получение ложноположительных результатов [11], что связано, по-видимому, с высокой частотой мозаицизма в эмбрионах человека и доказанной способностью бластоцисты к самокоррекции, то есть к активации апоптоза анеуплоидных клеток в процессе эмбрионального развития [11]. При этом в мозаичных, по результатам ПГТ-А, эмбрионах, доля анеуплоидных клеток в биопсийном материале не всегда отражает истинный хромосомный статус всего эмбриона. Так в исследовании Saifitdinova A.F. et al. (2020) показано, что в различных участках трофэктодермы и в клетках внутренней клеточной массы мозаичного эмбриона доля и вид мозаицизма могут различаться [34]. Согласно предварительным результатам исследования, если в бластоцисте методом ПГТ-А выявлен мозаичный набор хромосом, то вероятность эуплоидного хромосомного набора в других частях эмбриона мала. Следовательно, к переносу мозаичных эмбрионов в полость матки также следует относиться с осторожностью.
Заключение
ПГТ-А находится в фокусе современных научных исследований, направленных на оценку эффективности, безопасности, целесообразности применения в клинической практике и объективности результатов. На сегодняшний день это единственный метод, позволяющий с высокой точностью определить плоидность эмбриона и улучшить выбор эмбриона с оптимальным имплантационным потенциалом. Несмотря на это, роль ПГТ-А в улучшении исходов программ ВРТ все еще обсуждается. В нашем исследовании продемонстрировано улучшение исходов программ ВРТ у женщин старшего репродуктивного возраста, почти трехкратное уменьшение вероятности ранних репродуктивных потерь у женщин с привычным выкидышем, увеличение частоты клинической беременности у пациенток с повторными неудачными попытками имплантации. Однако не было выявлено статистически значимых улучшений результативности программ ВРТ у супружеских пар с тяжелой патозооспермией. Полученные результаты указывают на целесообразность применения ПГТ-А в отдельных группах пациентов. Однако проведение многоцентровых рандомизированных контролируемых исследований с качественным дизайном позволит дать более полную информацию о роли ПГТ-А в исходах программ ВРТ.



