Важнейшим условием успешного прогрессирования беременности является способность иммунной системы женщины обеспечивать защиту плода, несущего чужеродные антигены отца, от отторжения. Одним из способов индукции иммунологической толерантности, широко используемым при пересадке органов, является предтрансплантационная иммунизация реципиента антигенами донора. На основе положительного опыта использования аллоиммунизации в трансплантологии было предложено применять процедуру иммунизации женщин лейкоцитами их полового партнера – иммуноцитотерапию (ИЦТ) – для предотвращения потерь беременности у пациенток с привычным выкидышем в анамнезе [1–4].
Принципиальную роль в обеспечении иммунологической толерантности к плоду играет цитокиновый профиль иммунокомпетентных клеток. В многочисленных работах показано, что нарушение иммунологической толерантности, как и риск отторжения трансплантата, связаны с воспалительными реакциями, сопровождающимися повышенной продукцией провоспалительных цитокинов [5–7]. Функциональное состояние Т-хелперов (Th) определяет про- или противовоспалительную направленность иммунных реакций. T-хелперы первого типа (Th1), продуцирующие цитокины: интерферон гамма (IFN-γ), интерлейкин-2 (IL-2) и фактор некроза опухоли альфа (TNF-α), стимулируют воспалительные реакции. Т-хелперы второго типа (Th2), продуцирующие IL-10, IL-4 и IL-5, препятствуют воспалению. Физиологическая беременность развивается на фоне противовоспалительных Th2-реакций [5, 8–10]. В ряде работ установлено, что иммуномодулирующий эффект ИЦТ связан с Th2-поляризацией иммунного ответа, что позволяло рассматривать данный метод коррекции привычного невынашивания беременности как обоснованный и эффективный подход [11–14]. Предполагалось, что многократные предгестационные иммунизации могут усилить противовоспалительный фон при наступлении беременности.
Однако современные данные свидетельствуют о том, что имплантация и ранние стадии I триместра физиологической беременности протекают на фоне провоспалительных Th1-реакций, в то время как противовоспалительный Th2-фон формируется на более поздних этапах беременности [10, 15–17].
Таким образом, развитие избыточных противовоспалительных реакций после ИЦТ может препятствовать наступлению беременности. Очевидно, что оптимальный терапевтический эффект ИЦТ может наблюдаться лишь при «тонкой настройке» Тh1/Th2-баланса, обеспечивая преобладание провоспалительного фона при имплантации и на ранних этапах беременности и его своевременный переход в противовоспалительный фон на более поздних сроках.
Поэтому особую актуальность приобретает оценка взаимосвязи формируемого при предгестационной иммунотерапии Тh1/Th2-фона со сроками наступления беременности. Для изучения влияния различных факторов на имплантацию и ранние сроки беременности широко используется такой показатель, как длительность ожидания наступления беременности (TTP, time to pregnancy) [18–22]. Мы предположили, что наступление беременности в течение первых 6 месяцев после предгестационной аллоиммунизации обеспечивается своевременным развитием сбалансированных Th1/Th2-реакций, а в сроках более 6 месяцев может быть связано с доминированием Th2-реакций. Таким образом, ТТР может являться показателем, отражающим особенности формирования Th1/Th2-реакций при аллоиммунизации.
Поэтому целью исследования явилась оценка зависимости между Тh1/Th2-балансом, сформированным после предгестационной ИЦТ, и ТТР у женщин с привычным выкидышем в анамнезе.
Материалы и методы
В исследовании приняли участие 37 женщин с диагнозом «привычный выкидыш» (N96 по МКБ-10). Критериями включения являлись: возраст женщины от 20 до 40 лет, два или более самопроизвольных прерывания беременности до 20 недель беременности от одного и того же партнера, если в каждом случае был доказан нормальный кариотип абортуса, нормальный кариотип партнеров, нормозооспермия у партнера, самопроизвольное наступление предыдущих беременностей, отсутствие анатомических, аутоиммунных, гормональных нарушений, воспалительных заболеваний органов малого таза в фазе обострения, подписанная пациенткой форма информированного согласия на проведение исследования.
Всем женщинам перед планируемой беременностью проводилась ИЦТ в качестве монотерапии. Процедуру ИЦТ проводили лимфоцитами супруга в предгестационной подготовке в середине фолликулярной фазы двух последовательных менструальных циклов (м.ц.) и во время наступившей беременности в сроке 5–6 недель и 8–9 недель. Методика проведения ИЦТ утверждена на заседании Ученого совета «Научного центра акушерства гинекологии и перинатологии им. В.И. Кулакова» Минздрава России (протокол №19 от 25 декабря 2012 г.).
Забор крови осуществляли из локтевой вены в стерильную пробирку объемом 50 мл; в качестве антикоагулянта использовали 200 мкл раствора гепарина (концентрация раствора гепарина 5000 МЕ/мл). Образцы крови инкубировали при температуре 37°C в течение 1–1,5 ч. После разделения крови на 2 слоя верхний слой переносили в стерильную пробирку и центрифугировали. После удаления надосадочной жидкости осадок тщательно перемешивали в дистиллированной воде для обеспечения осмотического лизиса и удаления эритроцитов, затем добавляли двукратный натрий-фосфатный буфер. После отмывки выделенные клетки ресуспендировали в 2 мл стерильного физиологического раствора и оценивали концентрацию и жизнеспособность лейкоцитов (тест с трипановым синим) с помощью гемоцитометра. Жизнеспособность клеток составляла не менее 95%. Суспензию, содержащую 50×106 лейкоцитарных клеток, вводили внутрикожно в ладонную поверхность предплечья (10–12 точек по 0,2 мл).
В период проведения предгестационной подготовки была рекомендована барьерная контрацепция. С 3-го м.ц. контрацепция была отменена. Наступление беременности регистрировали в течение 12 последующих м.ц. ТTP определяли как порядковый номер м.ц., начиная с первого цикла после отмены негормональной контрацепции, в котором наступила беременность.
Продукцию провоспалительных (IFN-γ, IL-2, IL-6, IL-8, IL-12, IL-18, TNF-α, IL-1β) и противовоспалительных (IL-4, IL-5, IL-10) цитокинов после митогенной активации клеток цельной крови женщин с использованием наборов «Цитокин-Стимул-Бест» (ЗАО «Вектор-Бест») оценивали методом проточной цитофлуориметрии с помощью мультиплексного анализа с применением стандартных наборов FlowCytomix™ (eBioscience). Анализ цитокинов проводили в образцах крови, полученных через 2 недели после второй иммунизации.
Статистический анализ
Статистическая обработка результатов проводилась с использованием программы MedCalc v12.3.0. Проверку гипотезы о нормальном распределении осуществляли, используя критерий Шапиро–Уилка. Для выборок, не удовлетворяющих критериям нормального распределения, использовали значение медианы и указывали максимальное и минимальное значения соответствующих показателей. Для определения достоверности различия значений в двух независимых выборках, не удовлетворяющих критериям нормального распределения, использовали непараметрический критерий Манна–Уитни. В качестве статистической характеристики выборок использовали значение медианы и указывали максимальное и минимальное значения соответствующих показателей. Значимость различий относительных показателей, характеризующих частоту наступления беременности, оценивали с помощью критерия χ2. Различия считали значимыми при р<0,05. С целью оценки прогностической эффективности определения уровня цитокинов для предикции сроков наступления беременности после ИЦТ было использовано построение характеристических кривых (Receiver Operating Characteristics (ROC)), позволяющих определять значения параметра, при котором чувствительность и специфичность теста максимальны. Для изучения времени до наступления беременности использовали анализ времени до события (time-to-event analysis) с помощью построения кривых Каплана–Майера, сравнение кривых проводили с помощью логарифмического рангового критерия.
Результаты
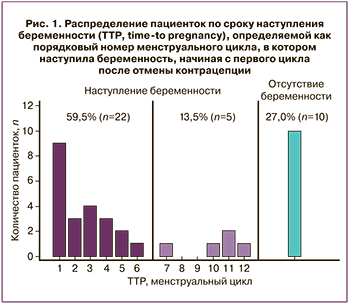 Из 37 женщин, включенных в исследование, у 22 (59,5%) было зарегистрировано наступление беременности в течение 6 м.ц. после иммунизации; еще у 5 женщин (13,5%) – в период 7–12 м.ц. При этом у 10 женщин (27%) беременность не наступила в течение 12 м.ц. после иммунизации (рис. 1). У 23 из 27 (85,2%) женщин беременность завершилась своевременным рождением живых детей. В двух случаях (7,4%) была зарегистрирована неразвивающаяся беременность на сроках 6–8 недель и в двух случаях (7,4%) – на сроках 14–16 недель.
Из 37 женщин, включенных в исследование, у 22 (59,5%) было зарегистрировано наступление беременности в течение 6 м.ц. после иммунизации; еще у 5 женщин (13,5%) – в период 7–12 м.ц. При этом у 10 женщин (27%) беременность не наступила в течение 12 м.ц. после иммунизации (рис. 1). У 23 из 27 (85,2%) женщин беременность завершилась своевременным рождением живых детей. В двух случаях (7,4%) была зарегистрирована неразвивающаяся беременность на сроках 6–8 недель и в двух случаях (7,4%) – на сроках 14–16 недель.
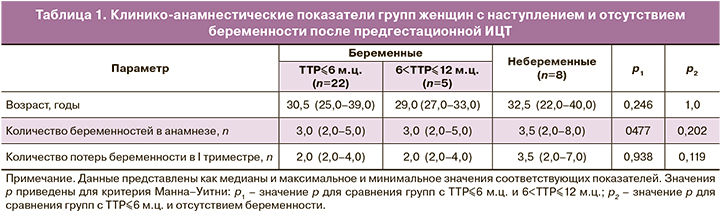
Таким образом, анализ TTP позволил сформировать 3 группы сравнения: группа с TTP, не превышающим 6 м.ц., группа с 6<TTP≤12 м.ц. и группа с отсутствием беременности в течение 12 м.ц. При этом сравнение клинико-анамнестических показателей пациенток из групп с наступлением и отсутствием беременности после предгестационной иммунизации достоверных различий не выявило (табл. 1).
Полученные данные позволили также оценить зависимость между ТТР и исходом беременности. Средний срок наступления беременности в группе женщин с успешным исходом лечения (доношенная беременность) составил 2 м.ц., а в группе с потерей беременности в I триместре – более 8 м.ц. (Р=0,007). В группе женщин с ТТР>6 м.ц. частота потерь беременности была значимо выше, чем в группе с ТТР≤6 м.ц., и составила 60,0% против 4,7% соответственно (Р=0,002).
Ретроспективный анализ выявил отсутствие зависимости ТТР от продукции цитокинов клетками периферической крови пациенток после двукратной иммунизации (табл. 2). Однако были выявлены уменьшение соотношения IL-12/IL-10, а также выраженная тенденция к уменьшению соотношения IFN-γ/IL-10 в группе женщин с 6<TTP≤12 м.ц. по сравнению с группой с ТТР≤6 м.ц. (P=0,039 и P=0,087 соответственно). Уменьшение показателей Th1/Th2-баланса выявлено также в группе с отсутствием беременности по сравнению с группой с ТТР≤6 м.ц. Соотношения IFN-γ/IL-4, TNF-α/IL-4, IL-12/IL4 и IL-1β/IL-4 в группе с 6<TTP≤12 м.ц. были существенно ниже по сравнению с группой с ТТР≤6 м.ц. (P=0,004, P=0,005, P=0,020 и P=0,023 соответственно). Также была обнаружена выраженная тенденция к уменьшению соотношения IFN-γ/IL-10 в группе женщин с отсутствием беременности по сравнению с группой с ТТР≤6 м.ц.

Нами было проведено сравнение продукции цитокинов в группе с ТТР ≤6 м.ц. и в объединенной группе, включающей группу с 6<TTP≤12 м.ц. и группу с отсутствием беременности в течение 12 м.ц. Полученные данные позволили нам оценить прогностическую значимость оценки цитокинового профиля для прогноза наступления беременности в течение 6 м.ц. С помощью RОС-анализа была установлена высокая значимость оценки концентрации цитокина IL-10, а также соотношений IFN-γ/IL-4, TNF-α/IL-4 и IL-12/IL-10 для прогноза наступления беременности (табл. 3).
Было проведена оценка зависимости ТТР после ИЦТ от уровня прогностически значимых показателей (рис. 2). Было установлено, что как уровень цитокина IL-10, так и соотношения IFN-γ/IL-4 и TNF-α/IL-4 достоверно влияют на ТТР (P=0,01, P=0,003 и Р=0,003).

Обсуждение
Полученные данные подтвердили, что ИЦТ является высокоэффективным подходом для терапии привычного выкидыша. Однако после предгестационной иммунизации у 27% пациенток с привычным выкидышем в анамнезе беременность не наступала в течение года после аллоиммунизации. Это совпадает с литературными данными, согласно которым наступление беременности у пациенток на фоне ИЦТ варьировало от 50,5% [4] до 84,8% [14].
До сих пор возможность влияния ИЦТ на срок наступления беременности практически не обсуждалась. В большинстве исследований, посвященных использованию ИЦТ для лечения привычного невынашивания беременности, использовался протокол, предложенный в работе J.F. Mowbray (1985) [4], предусматривающий однократное введение лимфоцитов до наступления беременности и повторное введение после наступления беременности. Авторы не обнаружили влияния предгестационной иммунизации на ТТР, но убедительно продемонстрировали увеличение процента доношенной беременности в группе женщин с привычным выкидышем после ИЦТ по сравнению с плацебо. После 1985 г. ИЦТ начала широко использоваться для терапии невынашивания беременности, но протоколы иммунизации существенно отличались от предложенного в работе J.F. Моwbray. Число предгестационных иммунизаций варьировало и в некоторых случаях доходило до 8 [23]; при этом срок наступления беременности при ИЦТ и в группе плацебо сравнивался лишь в нескольких исследованиях, и ни в одном исследовании, проведенном после 1985 г., не анализировалось ТТР.
Дизайн проведенного нами исследования обеспечил уникальную возможность объективной оценки ТТР, связанную с высокой степенью мотивированности пациенток к лечению невынашивания беременности и немедленным обращениям всех включенных в исследование пациенток к врачу в случае наступления беременности. Таким образом, использованный нами подход оценки ТТР отличается от использованных ранее субъективных способов оценки этого параметра с помощью анкетирования пациенток [21, 22].
Полученные нами данные свидетельствуют о том, что соотношение Th1/Th2 может существенно влиять на формирование иммунологического фона, определяющего вероятность наступления беременности после предгестационной ИЦТ. Было установлено, что усиление провоспалительного фона является благоприятным фактором для наступления беременности, что согласуется с литературными данными.
Нельзя исключить, что в ряде случаев аллоиммунизация приводит к обратимому подавлению Th1 воспалительного фона, приводящему к нарушениям имплантации. По-видимому, наступление беременности происходит при ослаблении противовоспалительных реакций, то есть ТТР определяется временем, необходимым для нормализации Th1/Th2-дисбаланса, сформированного в результате предгестационной иммунизации.
Эти предположения согласуются с опубликованными ранее данными о том, что одним из механизмов реализации иммунологической толерантности является формирование транзиторной анергии – неотвечаемости иммунокомпетентных клеток на стимуляцию, которая прежде всего проявляется в ингибировании активности Th1-клеток [24].
В представленной работе было проведено сравнение иммунологических параметров в группах пациенток с беременностью, наступившей в течение 6 м.ц. после иммунизации (ТТР≤6 м.ц.), и при отсутствии беременности в течение 12 м.ц. Ранее в мультицентровом исследовании, проведенном в 5 европейских странах, было установлено, что у 62–79% фертильных женщин беременность наступает в течение 6 м.ц., у 80–85% женщин – в течение 12 м.ц. [25]. Поэтому весьма вероятно, что полученные нами данные об особенностях преимплантационного иммунологического фона в группе женщин с ТТР≤6 м.ц. и доношенной беременностью могут соответствовать характеристикам состояния иммунной системы при физиологическом наступлении беременности у фертильных женщин. В то же время группа с наступлением беременности через 6 и более месяцев после аллоиммунизации, как и группа с отсутствием беременности, отличаются по иммунологическим параметрам от группы с ТТР≤6 м.ц. Причем соотношения Th1/Th2-цитокинов в обеих группах ниже по сравнению с группой с ТТР≤6 м.ц.
Полученные данные позволили нам оценить значимость определения цитокинового профиля для прогноза наступления беременности в течение 6 м.ц. Было установлено, что оценка продукции IL-10, а также соотношений IL-12/IL-10, TNF-α/IL-4 и IFN-γ/IL-4 может быть использована для прогноза наступления беременности в течение 6 м.ц. Ранее было показано, что у 81,7% женщин нарушения имплантации происходят на фоне изменения цитокинового профиля лимфоцитов эндометрия [26]. Согласно современным представлениям, существенный вклад в формирование преимплантационного иммунного профиля эндометрия вносит миграция иммунокомпетентных клеток крови [27]. Поэтому нельзя исключить, что особенности продукции цитокинов клетками периферической крови после предгестационной ИЦТ могут определять характер преимплантационных иммунологических изменений эндометрия.
Очевидно, что зависимость наступления беременности от продукции цитокинов наиболее выражена в цикле зачатия. Поэтому оценка цитокинового профиля в каждом из м.ц., предшествующих циклу зачатия, могла бы внести существенный вклад в понимание механизмов иммунорегуляции имплантации эмбриона. Отсутствие такой оценки является одним из ограничений представленного исследования.
Установленный в работе высокий уровень провоспалительных реакций в группе с ТТР≤6 м.ц. и его уменьшение в группах с задержкой наступления беременности и с отсутствием беременности согласуются с современными представлениями о том, что усиление провоспалительной направленности иммунных реакций обеспечивает рецептивность эндометрия в период окна имплантации [10]. Провоспалительный статус иммунокомпетентных клеток, присутствующих в эндометрии при успешной имплантации, был подтвержден в многочисленных исследованиях [7, 15, 28, 29]. Так, в работе Saito было показано, что соотношение Th1/Th2-клеток, локализованных в эндометрии во время секреторной фазы, было существенно выше, чем этот показатель, определенный для клеток периферической крови, что свидетельствует о формировании локального провоспалительного фона, предшествующего имплантации [27].
Положительная зависимость частоты наступления беременности от повышения в секретах эндометрия концентрации TNF-α подтверждает значимость Th1-реакций при имплантации [30]. Установлено, что механические повреждения эндометрия в результате биопсии, сопровождающиеся увеличением продукции провоспалительных цитокинов, в том числе и TNF-α, существенно увеличивают частоту наступления беременности в программе ЭКО [31]. Установлено, что IFN-γ, TNF-α и IL-1β стимулируют продукцию эндометриальными стромальными и эпителиальными клетками RANTES – хемокина, играющего ключевую роль в усилении миграции иммунокомпетентных клеток в эндометрий, в то время как IL-4 подавляет TNF-α-индуцированную продукцию RANTES [32, 33]. В ряде работ сообщалось, что увеличение продукции TNF-α и IFN-γ необходимо для наступления беременности, поскольку обеспечивает и активацию маточных NK клеток, играющих важную роль в ангиогенезе и плацентации [34]. Был выявлен высокий уровень TNFα-mRNA в период окна имплантации [35].
Механизмы, определяющие состояние иммунной системы женщин после ИЦТ, остаются невыясненными и требуют дальнейшего изучения. Нельзя исключить, что существенное влияние на формирование предгестационного иммунологического фона могут оказывать как субпопуляционный состав лимфоцитов, присутствующих в лейкоцитарной фракции крови, используемой для иммунизации [36], так и различия в интенсивности реакций на ИЦТ, связанные с особенностями иммунной системы женщин. Поэтому нельзя с уверенностью утверждать, что выявленные особенности иммунитета обусловлены процедурой ИЦТ. Формирование вторичного бесплодия у женщин с невынашиванием беременности может быть обусловлено целым рядом причин, включающих осложнения, возникшие вследствие перенесенных гинекологических хирургических вмешательств, которые привели к повреждению эндометрия; иммуномодулирующее воздействие антибиотиков, ингибирующих продукцию провоспалительных цитокинов [37], и другие факторы. В своей работе мы не выявили зависимости особенностей цитокинового профиля клеток периферической крови и сроков наступления беременности от возраста женщин. Несмотря на это, при работе с более обширными выборками пациентов кажется целесообразным проспективное распределение женщин на группы в зависимости от возраста. Очевидно, что причины репродуктивных дисфункций у женщин с привычным выкидышем в анамнезе требуют дальнейших исследований.
Полученные данные позволили также оценить зависимость между ТТР и исходом беременности. В группе женщин с ТТР>6 м.ц. частота выкидышей была значимо выше, чем в группе с ТТР≤6 м.ц. Полученные данные согласуются с современными представлениями о том, что увеличение ТТР является фактором риска развития целого ряда репродуктивных нарушений. Ранее была выявлена позитивная корреляция между ТТР и частотой эктопических беременностей, выкидышей и преждевременных родов [18]. Отмечалась также корреляция между ТТР, риском неонатальных осложнений [38] и даже риском неонатальной смертности [39].
Таким образом, иммунная дисфункция, определяющая увеличение ТТР, может являться патогенетическим фактором при различных репродуктивных патологиях. Поэтому изучение механизмов, приводящих к задержке наступления беременности на фоне ИЦТ, может явиться основой для понимания роли иммунных факторов в репродуктивной физиологии и патологии, а также для выбора оптимальных подходов к коррекции иммунологических нарушений.
Заключение
Полученные нами результаты свидетельствуют о том, что терапевтический эффект двукратной предгестационной ИЦТ может наблюдаться лишь при достижении оптимального баланса Тh1/Th2-цитокинов с преобладанием провоспалительного фона при имплантации. Оценка цитокинового профиля клеток периферической крови имеет значимость для прогноза наступления беременности в течение 6 м.ц. после двукратной аллогенной иммунизации. Возможно, персонифицированный подбор оптимальных схем аллогенной иммунизации, основанный на мониторинге изменений цитокинового профиля клеток периферической крови пациенток в процессе ИЦТ, позволит улучшить результаты коррекции привычного невынашивания беременности.



