Внутренний генитальный эндометриоз и гиперпластические процессы эндометрия (ГПЭ) являются одной из ведущих проблем в гинекологии. Они нарушают репродуктивное здоровье женщин, снижают качество жизни и влияют на трудоспособность женщин всех возрастов [1–4]. Внутренний генитальный эндометриоз встречается у 7–12%, ГПЭ – у 10–15% женщин репродуктивного возраста [5]. Все чаще отмечается увеличение числа пациенток с сочетанием данных заболеваний. Эта проблема имеет важное медико-социальное значение, так как от 12 до 50% операций в гинекологических стационарах приходится на внутренний генитальный эндометриоз и его сочетание с ГПЭ [6–8].
Причины и механизмы сочетанного развития внутреннего генитального эндометриоза и ГПЭ изучаются различными научными коллективами [9–12]. Известно, что в развитие данной патологии включены гормональные и генетические нарушения [11, 13, 14]. Растет число исследований, направленных на определение влияния генетических факторов в формировании данной патологии [15, 16]. Среди генов-кандидатов гиперпластических заболеваний матки важное значение играют гены хемокинов. Хемокины – семейство малых белков, обладающих способностью действовать как хемотаксические посредники путем передачи сигналов через рецепторы, сопряженные с G-белком. Известно, что они участвуют в ангиогенезе, гемопоэзе, эмбриологическом развитии, развитии В- и Т-клеток, созревании дендритных клеток, воспалении, инфекции, росте опухоли и метастазировании [17, 18], поэтому могут быть ассоциированы с развитием внутреннего генитального эндометриоза и его сочетания с ГПЭ. Роль межгенных взаимодействий генов хемокинов в формировании данного заболевания остается малоизученной.
Цель исследования: изучить связь между полиморфными вариантами генов хемокинов и развитием внутреннего генитального эндометриоза в сочетании с ГПЭ.
Материалы и методы
Исследуемые группы сформированы в отделении гинекологии ОГБУЗ БОКБ Святителя Иоасафа: 91 женщина с установленным диагнозом внутреннего генитального эндометриоза в сочетании с ГПЭ и 789 женщин без заболеваний репродуктивной системы. Все обследуемые – коренные русские жительницы Центрального федерального округа России [19]. Средний возраст больных – 40,89 (9,81) года, контрольной группы – 37,89 (7,76) года, сопоставимы по U-критерию Манна–Уитни, p>0,05.
Критерии включения в группу больных: наличие диагноза внутреннего генитального эндометриоза в сочетании с ГПЭ, подтвержденного эхографически, гистероскопически и морфологически. Работа проведена с разрешения Регионального комитета по этике Медицинского института БелГУ. Перед началом исследования все женщины подписали информированное согласие на проведение диагностических и лечебных и манипуляций. Образцы периферической крови, собранные в пробирки с ЭДТА, подвергали выделению ДНК методом фенольно-хлороформной экстракции.
Для анализа отобраны 6 однонуклеотидных полиморфизмов генов хемокинов: хемокиновый лиганд-5 (RАNТES rs2107538), интерфероном-γ-индуцируемый хемоаттрактант Т-клеток альфа (I-TAC rs4512021), макрофагальный воспалительный белок-1 (МIР1β rs1719153), интерлейкин-8 (IL-8 rs4073), моноцитарный хемоаттрактантный белок-1 (МСР1 rs2857657), стромальный клеточный фактор-1 (SDF1 rs1801157). Отобранные для исследования гены-кандидаты имеют важное медико-биологическое значение в организме человека и могут участвовать в патогенезе внутреннего генитального эндометриоза в сочетании с гиперплазией эндометрия.
Анализ молекулярно-генетических локусов проведен методом полимеразной цепной реакции в режиме реального времени с применением олигонуклеотидных праймеров и зондов (ООО «Синтол», Россия).
Статистический анализ
Для сравнения частот аллелей и генотипов между группами больных и контроля использовали таблицы сопряженности 2×2 и критерий χ2 с учетом поправки Йейтса на непрерывность. Эмпирическое распределение частот генотипов в группе больных и контроля по сравнению с теоретически ожидаемым определяли по закону Харди–Вайнберга с введением поправки Бонферрони, учитывающей множественные сравнения в соответствии с количеством изучаемых полиморфизмов (n=6); за статистически значимый уровень принимали pbonf<0,05:6=0,009.
Для выявления ассоциаций изучаемых генов с формированием внутреннего генитального эндометриоза и ГПЭ использовали показатель отношения шансов (ОШ) и его 95% доверительный интервал (95% ДИ). Статистический анализ проводили с использованием программного обеспечения STATISTICA for Windows 10.0.
Поиск комбинаций аллелей и генотипов хемокинов, ассоциированных с развитием заболевания, проводили с помощью программы АРSampler (https://sourceforge.net/projects/apsampler/), использующей метод Монте–Карло–Марковских цепей (MCMC) и байесовские статистические методы [20, 21]. Для валидации найденных ассоциаций при множественных сравнениях использовали пермутационный анализ (pperm). За статистически значимый уровень принимали pperm<0,05.
С помощью базы данных GTExportal (https://www.gtexportal.org/) проведена оценка влияния изученных полиморфных вариантов на уровень транскрипционной активности генов [22]. Для этого мы использовали результаты регрессионного анализа, представленного в онлайн-базе данных GTExportal [23]. Связь аллелей с уровнем экспрессии генов оценивали с помощью коэффициента линейной регрессии (β), определяющего изменение нормализованного показателя генной экспрессии на один полиморфный (альтернативный) генетический вариант [24]. С целью минимизации ошибок, связанных с ложноположительными результатами, в работе использовали данные с p<8×10-5 и показателем FDR (False Discovery Rate) ≤0,05. Регуляторные эффекты изучаемых генов оценивали по данным программы SNPinfo (https://npinfo.niehs.nih.gov/).
Результаты и обсуждение
Сравнительная характеристика групп больных и контроля по медико-биологическим показателям, наличию сопутствующих заболеваний представлена в таблице 1.

Группы больных и контроля не отличаются по основным медико-биологическим характеристикам, таким как возраст (p=0,058), рост (p=0,678), вес (p=0,135), индекс массы тела (p=0,236), возраст менархе (p=0,124), длительность менструации (p=0,785), продолжительность менструального цикла (p=0,147). В то же время среди больных выше процент наследственной отягощенности (p=0,001), большее количество абортов (p=0,0005), больший удельный вес заболеваний эндокринной системы (p=0,004), меньшее число родов (p=0,0005) и меньшее число женщин без соматических заболеваний (p=0,039).
Частоты аллелей и генотипов изучаемых хемокинов в основной группе и контроле представлены в таблицах 2 и 3. Следует отметить, что для полиморфного локуса rs4073 гена IL-8 в группе контроля был зарегистрирован более высокий уровень наблюдаемой гетерозиготности по сравнению с ожидаемой согласно равновесию Харди–Вайнберга (H0=0,546, HE=0,500, PHWE=0,012). По локусу rs2857657 гена МСР1 в группе контроля зарегистрирован более низкий уровень наблюдаемой гетерозиготности по сравнению с ожидаемой (H0=0,273, HE=0,300, PHWE=0,015), но при введении поправки Бонферрони, учитывающей множественные сравнения в соответствии с количеством изучаемых полиморфизмов (n=6, pbonf<0,009), данные различия оказались недостоверны и исследуемые полиморфные локусы прошли тест на HWE. Распределение частот генотипов по остальным локусам соответствовало равновесию Харди–Вайнберга (табл. 2, 3).
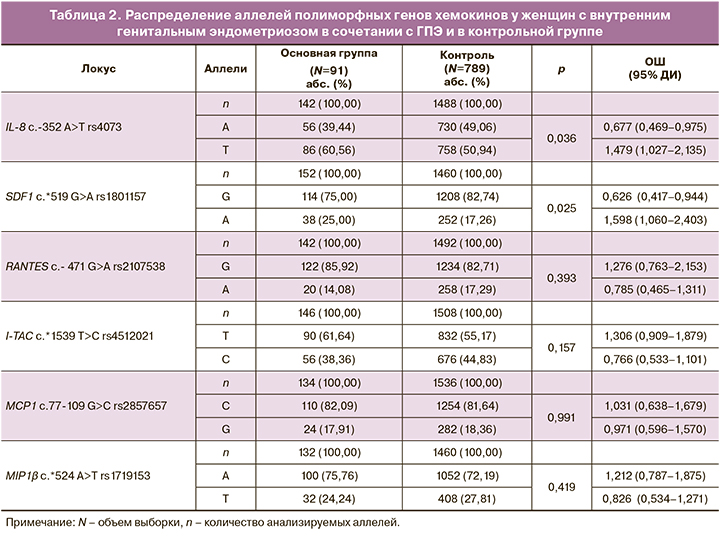
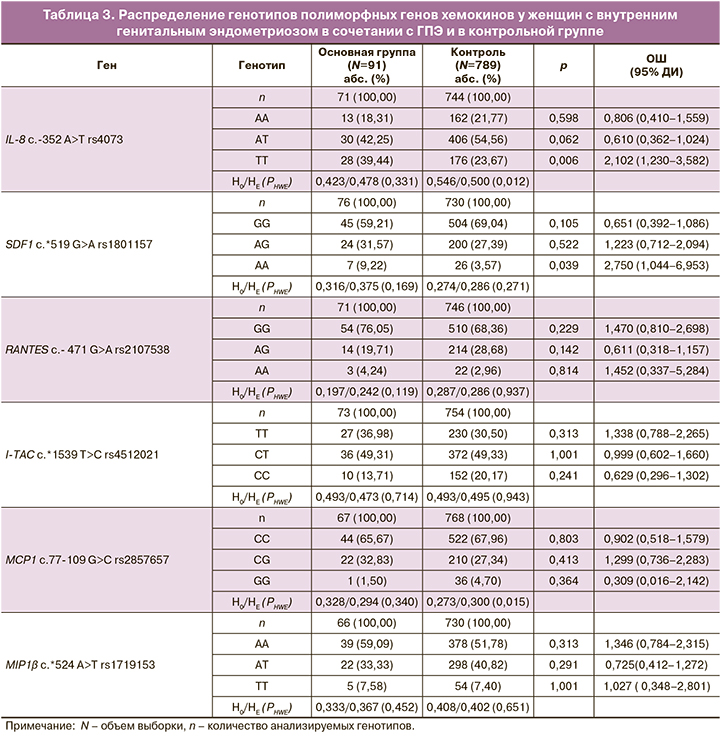
В результате сравнительного анализа установлено, что аллель Т rs4073 IL-8 встречается чаще в группе больных (86/142, 60,56%) по сравнению с контрольной группой (379/744; 50,94%; χ2=3,32; р=0,04; ОШ=1,479; 95% ДИ 1,027–2,135). Генотип ТТ rs4073 IL-8 встречается в 1,7 раза чаще (28/71, 39,44%) в группе больных по сравнению с группой контроля (88/372; 23,67%; χ2 =5,74; р=0,01; ОШ=2,102; 95% ДИ 1,230–3,582). Выявлена более высокая частота аллеля А rs1801157 SDF (38/152, 25,00%) у женщин с внутренним генитальным эндометриозом в сочетании с ГПЭ по сравнению с контрольной группой (126/730; 17,26%; χ2=4,47; р=0,03; ОШ=1,598; 95% ДИ 1,060–2,403).
С использованием программы АРSampler (https://sourceforge.net/projects/apsampler/) выявлены сочетания аллелей и генотипов, имеющих значение в развитии заболевания. Так, сочетание аллелей А rs1801157 SDF1, А rs4512021 I-ТАС и G rs2857657 МСР1 с генотипом ТТ rs4073 IL-8 в группе больных встречается значимо чаще (22,95%) по сравнению с группой контроля (6,13%; р=0,0002; pperm=0,001; ОШ=4,55; 95% ДИ 2,10–9,86). Данное сочетание является рисковым фактором развития внутреннего генитального эндометриоза в сочетании с ГПЭ. Протективным фактором развития заболевания является сочетание аллелей А rs4073 IL-8, G rs2107538 RАNТES и Т rs1719153 МIР1β. Частота распространенности данной комбинации в группе больных внутренним генитальным эндометриозом в сочетании с ГПЭ составляет 18,33%, в группе контроля – 37,85% (р=0,002; ОШ=0,36; 95% ДИ 0,18–0,73).
Выявлены 4 гена хемокинов, оказывающие влияние на экспрессию мРНК 8 генов в разных органах (http://www.gtexportal.org/). Установлено, что аллель Т rs2107538 гена RАNТES ассоциирован с повышенной экспрессией гена C17ORF50 в базальных ганглиях головного мозга (β=0,82; FDR≤0,05), гипофизе (β=0,39; FDR≤0,05), гиппокампе (β=0,63; FDR≤0,05), щитовидной железе (β=0,28; FDR≤0,05), надпочечниках (β=0,46; FDR≤0,05) и с низким уровнем транскрипции гена RDM1 в базальных ганглиях головного мозга (β=-0,41; FDR≤0,05), гипоталамусе (β=-0,51; FDR≤0,05), гена AC015849.16 в базальных ганглиях головного мозга (β=-0,41; FDR≤0,05). Аллель Т rs4073 гена IL-8 снижает уровень экспрессии гена CXCL6 в подкожной жировой клетчатке (β=-0,13; FDR≤0,05).
Аллель G гена rs4512021 I-ТАС ассоциирован с низким уровнем экспрессии гена NAAA в яичниках (β=-0,72; FDR≤0,05), матке (β=-0,62; FDR≤0,05), влагалище (β=-0,61; FDR≤0,05), щитовидной железе (β=-0,34; FDR≤0,05), фибробластах (β=-0,85; FDR≤0,05), скелетной мускулатуре (β=-0,67; FDR≤0,05), молочной железе (β=-0,50; FDR≤0,05), надпочечниках (β=-0,59; FDR≤0,05) и с высокой экспрессией гена ART3 (β=0,78; FDR≤0,05) в гипофизе, гена NUP54 в щитовидной железе (β=0,24; FDR≤0,05), матке (β=0,46; FDR≤0,05), скелетной мускулатуре (β=0,18; FDR≤0,05), в гипофизе (β=0,44; FDR≤0,05). Полиморфный вариант Т гена rs1719153 МIР1β ассоциирован с высоким уровнем экспрессии гена CCL4 в молочной железе (β=0,30; FDR≤0,05), скелетной мускулатуре (β=0,26; FDR≤0,05), щитовидной железе (β=0,24; FDR≤0,05).
Таким образом, данные базы GTExportal свидетельствуют о значимом влиянии изученных полиморфизмов на уровень экспрессии генов CCL4, ART3, CXCL6, C17ORF50, RDM1, AC015849.16, NUP54, NAAA в органах женской репродуктивной системы (матка, влагалище, яичники) и в органах, принимающих непосредственное участие в регуляции их деятельности (щитовидная железа, надпочечники, подкожная жировая клетчатка, скелетная мускулатура) и вовлеченных, соответственно, в патогенез внутреннего генитального эндометриоза в сочетании с ГПЭ.
Полиморфный локус SDF1 c.*519 G>А rs1801157 участвует в синтезе микро-РНК hsa-miR-149 (Score=153, Energy=-21,42), hsa-miR-1827 (Score=140, Energy=-14,97), miR-298 (Score=149, Energy=-28,51), miR-631 (Score=152, Energy=-21,69), miR-650 (Score=146, Energy=-25,03), miR-892b (Score=158, Energy=-24,45), miR-940 (Score=153, Energy=-29,24). В базе данных SNPinfo регуляторный потенциал (RegPotential) локуса rs1801157 гена SDF1 равен 0,43 (SNPinfo https://manticore.niehs.nih.gov/). Следует отметить, что показатель регуляторного потенциала характеризует степень участия локуса в регуляции экспрессии гена. Выявленное нами in silico значение регуляторного потенциала для локуса rs1801157, равное 0,43, указывает на его значимую роль в регуляции транскрипционной активности гена SDF1.
Аллель C гена RАNТES c.-471 G>А rs2107538 является сайтом связывания факторов транскрипции ETS_Q6 (Core Match Score=0,86), GATA4_Q3 (Core Match Score=0,68), GRE_C (Core Match Score=0,71), HAND1E47_01 (Core Match Score=0,86), PAX4_04 (Core Match Score=0,86) и др. Аллель G гена МСР1 c.77-109 G>С rs2857657 служит сайтом связывания факторов транскрипции AR_Q2 (Core Match Score=0,75), GATA_C (Core Match Score=0,60), GRE_C (Core Match Score=0,76), PAX4_04 (Core Match Score=0,86), HNF3B_01 (Core Match Score=0,93). Полиморфный вариант Т гена IL-8 rs4073 – сайт связывания транскрипционных факторов CDPCR3_01 (Core Match Score=0,74), CDP_02 (Core Match Score=0,68), EBOX_Q6_01 (Core Match Score=0,86), FXR_Q3 (Core Match Score=0,90).
Полученные нами данные доказывают важную роль хемокинов в организме [25]. Хемокин IL-8 инициирует направленную миграцию нейтрофилов и способен запускать процессы ангиогенеза повышением пролиферации эндотелиальных и мышечных клеток. IL-8 является фактором роста для эндометриальных клеток [26].
Согласно имеющимся литературным источникам, высокие концентрации RANTES наблюдаются в перитонеальной жидкости у пациенток с внутренним генитальным эндометриозом. Ген RANTES проявляет важную регулирующую активность в отношении ангиогенеза во время некоторых патофизиологических процессов. RANTES высвобождается многими типами клеток, такими, как тромбоциты или гладкомышечные клетки. Этот хемокин взаимодействует с GPCR (рецепторами, связанными с G-белками) и цепями GAG (гликозаминогликанов), связанными с HSPG, и участвует в процессах ангиогенеза путем повышения пролиферации и дифференцировки клеток эндометрия и апоптоза, поддерживает развитие сосудистого кровоснабжения в месте воспаления [27].
Ген I-ТАС, согласно литературным данным, является фактором риска внутреннего генитального эндометриоза, оказывая стимулирующее воздействие на стромальные клетки эндометрия [28]. МСР-1 играет важную роль в процессах тканевой инфильтрации моноцитами, а также служит маркером активности воспалительных реакций. Анализ концентрации хемокина МСР-1 в перитонеальной жидкости у пациенток с внутренним генитальным эндометриозом показывает его достоверное повышение в сравнении с группой контроля [29]. Ген SDF1 усиливает ангиогенез в эндометрии и повышает выживаемость клеток, ингибируя апоптоз, повышает патологическую пролиферацию эндометрия [30].
Заключение
В результате проведенного исследования установлена значимая роль молекулярно-генетических маркеров SDF1 c.*519 G>А rs1801157, RАNТES c.-471 G>А rs2107538, I-ТАС c.*1539 Т>С rs4512021, МСР1 c.77-109 G>С rs2857657, МIР1β c.*524 А>Т rs1719153, IL-8 c.-352 А>Т rs4073 в формировании внутреннего генитального эндометриоза в сочетании с ГПЭ. Факторами риска развития заболевания являются аллель Т гена rs4073 IL-8 (р=0,04; ОШ=1,479; 95% ДИ 1,027–2,135) и аллель А rs1801157 SDF (р=0,03; ОШ=1,598; 95%ДИ 1,060–2,403). Также фактором риска развития заболевания является комбинация генотипа ТТ rs4073 IL-8 с аллелями А rs1801157 SDF1, А rs4512021 I-ТАС и G rs2857657 МСР1 (ОШ=4,55; 95% ДИ 2,10–9,86; р=0,0002). Сочетание аллеля А rs4073 IL-8 с аллелем G rs2107538 RАNТES и аллелем Т rs1719153 МIР1β является протективным фактором развития данной патологии (ОШ=0,361; 95% ДИ 0,181–0,730; р=0,002).
Полученные нами данные могут быть использованы для определения групп риска развития внутреннего генитального эндометриоза в сочетании с ГПЭ с целью проведения в них профилактических мероприятий.



