Возраст менархе является важным показателем полового развития женщины, который маркирует начало ее репродуктивного периода [1, 2]. Менархе является одним из завершающих этапов полового развития. Возраст менархе характеризует функционирование гипоталамо-гипофизарно-яичниковой системы девочки-подростка [2]. Завершение становления репродуктивной функции, дефинитивный рост, метаболический статус и фертильность у взрослых во многом зависят от того, насколько полноценно протекает у подростка период полового созревания [3]. Следует отметить, что особенностью современного состояния репродуктивного здоровья девочек-подростков является широкая распространенность патологии становления менструального цикла, что предопределяет повышенный риск репродуктивных нарушений во взрослой жизни [3]. Литературные данные свидетельствуют о том, что возраст менархе связан с фертильностью женщины и возможными проблемами со здоровьем в ее дальнейшей жизни. Раннее менархе является известным фактором риска развития в дальнейшей жизни у женщины миомы матки [4, 5], эндометриоза [6], гиперплазии эндометрия [7, 8], а также рака молочной железы, эндометрия, яичников и ряда других заболеваний (ожирения, сахарного диабета 2-го типа, сердечно-сосудистых заболеваний, психических расстройств (депрессия) и психологических проблем и др.) [2, 9–11]. Наряду с этим, женщины с поздним менархе имеют повышенный риск развития остеопороза, преэклампсии [2, 9]. Следует отметить, что возраст менархе имеет значительные межиндивидуальные и межэтнические различия [1]. В результате проведенных многочисленных исследований возраста менархе в Российской Федерации (РФ) выявлены его региональные особенности на различных территориях РФ, показана связь с определенными медико-социальными и эколого-географическими факторами [3, 12–17].
Литературные данные свидетельствуют о существенной роли наследственных факторов (53–74%) в становлении менархе [1, 2, 18, 19]. Результаты проведенных полногеномных исследований (GWAS) указывают на вовлеченность в формирование менархе более 100 полиморфных локусов [20–26]. Вместе с тем, репликативные исследования этих полиморфных локусов в разных этно-территориальных группах показывают их слабую воспроизводимость. В репликативном мультиэтническом исследовании Carty C.L. et al. [27] трех SNPs, показавших ранее ассоциации с возрастом менархе среди женщин США европеоидного происхождения, выявлены ассоциации 2 SNPs с возрастом менархе только среди азиатских женщин, тогда как в других исследованных этнических группах (американские индейцы, афро-американцы, латино-американцы, гавайцы) рассматриваемые полиморфные локусы не были ассоциированы с возрастом менархе. Репликативное исследование 42 SNPs (ассоциированы с возрастом менархе у женщин европеоидного происхождения по данным работы Elks C.E. et al. [25]), выполненное Demerath E.W. et al. [24], показало значимые ассоциации с возрастом менархе у афро-американских женщин 25 полиморфных локусов (изучена выборка из 18089 женщин). Из 33 SNPs, ранее показавших ассоциации с возрастом менархе у женщин европеоидного происхождения [20–23, 28] и включенных в репликативное исследование Tanikawa С. et al. [9] на выборке из более 15000 японских женщин, значимые ассоциации с возрастом менархе были установлены только для 2 SNPs. В исследовании Pyun J.A. et al. [29], проведенном среди 3452 корейских женщин, не выявлено значимых ассоциаций с возрастом менархе 42 SNPs, ранее продемонстрировавших ассоциации с менархе [28]. В работе Yermachenko A. et al. [30], при репликативном исследовании 53 SNPs у 416 женщин Украины ассоциации с возрастом менархе были выявлены лишь для 1 SNP.
Следует отметить, что проведение репликативных исследований имеет важное значение в понимании роли отдельных генов-кандидатов в формировании возраста менархе в различных этно-территориальных группах населения, отличающихся разной историей формирования и факторами среды обитания. Обращает на себя внимание тот факт, что до настоящего времени молекулярно-генетические факторы, связанные с формированием возраста менархе у населения России не изучены.
Для данного репликативного исследования были отобраны полиморфные локусы rs4946651, rs7759938, rs314280, rs314276 гена LIN28B, показавшие ранее в 6 GWAS исследованиях значимые ассоциации с возрастом менархе [20–24, 26]. Согласно материалам базы данных GeneCards:The Human Gene Database (http://www.genecards.org/) ген LIN28B (lin-28 homolog B) кодирует белок семейства LIN28, который участвует в регуляции синтеза микроРНК, вовлеченных в различные биологические процессы в организме (клеточный цикл, эмбриональное развитие, пубертатное созревание, процессы метаболизма, репродукции и др.).
Цель исследования – изучить ассоциации полиморфных локусов гена LIN28B с возрастом менархе у русских женщин Центрального Черноземья РФ, рассмотреть их регуляторный потенциал и влияние на экспрессию генов.
Материал и методы
Выборка для исследования включала 696 женщин и формировалась при профилактических осмотрах на базе перинатального центра Белгородской областной клинической больницы Святителя Иоасафа с 2010 по 2013 гг. При формировании выборки учитывались национальность и место рождения женщин [31]: в нее включались женщины русской национальности, родившиеся в Центральном Черноземье России, не являющиеся родственниками, добровольно согласившиеся на проведение исследования. Средний возраст сформированной выборки составил 26,37±4,90 лет (варьировал от 16 лет до 35 лет).
Информация о возрасте менархе была получена при опросе женщин. Возрастом менархе считался возраст (полных лет) первых менструальных кровянистых выделений от даты рождения. Исследование проводилось под контролем этического комитета медицинского института Белгородского государственного национального исследовательского университета. У всех женщин предварительно было получено информированное согласие на проведение данного исследования.
Материалом для молекулярно-генетического исследования послужила ДНК, выделенная из венозной крови исследуемых индивидуумов. Забор венозной крови производился из локтевой вены обследуемых в пластиковые пробирки системы «Vacutainer» с консервантом ЭДТА (0,5М раствор, рН=8,0) в объеме 5 мл. Выделение геномной ДНК из лимфоцитов периферической венозной крови осуществлялось стандартным методом фенольно-хлороформной экстракции. При отборе полиморфных локусов для исследования учитывались критерии, изложенные в работе [32]. Генотипирование полиморфных локусов rs4946651, rs7759938, rs314280, rs314276 гена LIN28B проводилось методом полимеразной цепной реакции синтеза ДНК с использованием олигонуклеотидных праймеров и зондов. Оценка соответствия наблюдаемого распределения генотипов ожидаемому согласно равновесию Харди–Вайнберга проводилась с использованием теста χ2. Для изучения ассоциации полиморфизма с возрастом менархе использовался лог-линейный регрессионный анализ (тестировались аддитивная, доминантная и рецессивная генетические модели) с расчетом коэффициентов регрессии (β) и их ошибок (SE), характеризующих направленность изменения возраста менархе на один полиморфный генетический вариант (минорный аллель). Коррекцию на множественные сравнения проводили с помощью адаптивного пермутационного теста (pperm). Статистически значимым считали уровень pperm<0,05. Расчеты осуществлялись в программе PLINK v. 2.050 (http://zzz.bwh.harvard.edu/plink/).
Оценен регуляторный потенциал исследуемого полиморфизма с использованием онлайн программного обеспечения HaploReg (v4.1) (http://archive.broadinstitute.org/mammals/haploreg/haploreg.php): рассматривалось расположение SNP в области гистонов, маркирующих промоторы и энхансеры, в регионе гиперчувствительности к ДНКазе-1, эволюционно консервативном регионе, регионе регуляторных мотивов и регионе связывания с регуляторными белками. Изучена связь полиморфного локуса (референсного и альтернативного аллелей) с изменением регуляторных мотивов ДНК (афинность мотива к транскрипционным факторам). Для этого определялась разница между LOD scores альтернативного (alt) и референсного (ref) аллелей (ref): LOD (alt) − LOD (ref). Отрицательное значение этого показателя свидетельствует о повышении афинности мотива референсным аллелем, наоборот, положительное значение демонстрирует связь альтернативного аллеля с повышением афинности анализируемого мотива ДНК.
С использованием данных проекта Genotype-Tissue Expression (GTEx) (http://www.gtexportal.org/), изучен экспрессионный потенциал (cis-eQTL) исследуемых SNPs. Для идентификации значимых eQTL применялся показатель False Discovery Rate (FDR), в работе использовались результаты с p<8×10-5, pFDR≤0,05. Влияние аллельных вариантов рассматриваемого полиморфизма на уровень экспрессии гена оценивалось на основе коэффициента линейной регрессии (β), характеризующего изменение нормализованного показателя генной экспрессии на один полиморфный (альтернативный) генетический вариант [33].
Результаты и обсуждение
Среди 696 русских жительниц Центрального Черноземья России средний возраст менархе составил 12,62±1,05 лет (варьировал от 9 до 16 лет). Раннее менархе (до 12 лет) зарегистрировано у 9,63% женщин, а позднее (после 14 лет) – у 4,16% женщин. У 82,21% менархе было в возрасте 12–14 лет. Наблюдаемое распределение генотипов по исследуемым полиморфным локусам соответствовало ожидаемому при равновесии Харди-Вайнберга (рHWE>0,05).
Результаты проведенного анализа ассоциаций исследуемых полиморфных локусов гена LIN28B с возрастом менархе представлены в таблице. Выявлены ассоциации полиморфного локуса rs314276 с возрастом менархе у русских женщин Центрального Черноземья РФ в рамках доминантной модели взаимодействия аллелей – аллель А полиморфизма rs314276 гена LIN28B ассоциирован с поздним менархе (β=0,18±0,08, p=0,03, pperm=0,03). Таким образом, у женщин, имеющих в генотипе аллель А полиморфизма rs314276 гена LIN28B (генотипы A/A и C/A) менархе наступает на 0,18 года позже, по сравнению с женщинами, не имеющими в генотипе данного аллеля (генотип C/C). По другим рассматриваемым полиморфным локусам ассоциации были статистически не значимыми (p>0,05).
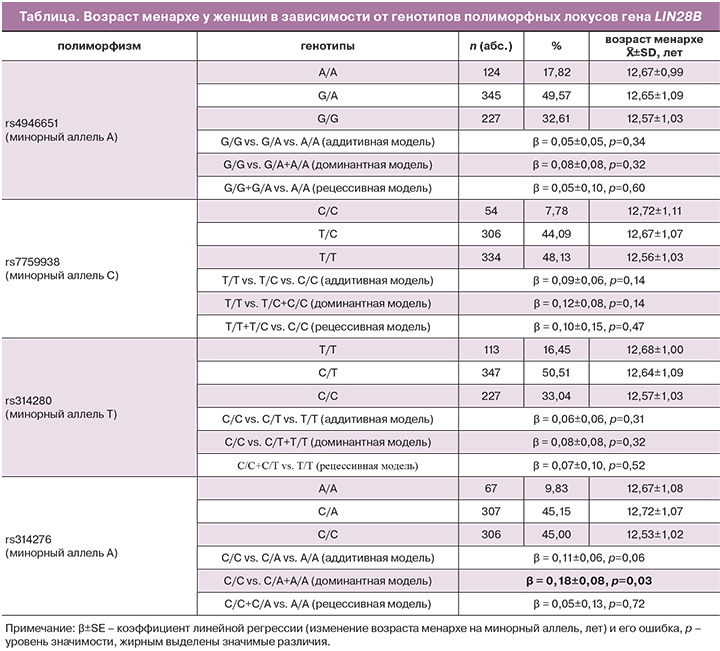
В ранее проведенном GWAS исследовании показана ассоциация полиморфизма rs314276 гена LIN28B с возрастом менархе среди женщин европеоидного происхождения [20]. При этом следует отметить, что в этой работе, как и в нашем исследовании, с поздним менархе ассоциирован аллель А. Также в данной работе установлена связь этого полиморфного локуса с темпами роста и развитием молочных желез у девочек, ростом взрослых женщин. Ассоциации полиморфизма rs314276 гена LIN28B с пубертатным развитием выявлены и в GWAS исследовании Cousminer D.L. et al. [34]. В лонгитудинальном исследовании Ong K.K. et al. [35] показаны ассоциации полиморфного локуса rs314276 гена LIN28B с индексом массы тела и весом у женщин, тогда как у мужчин данные ассоциации отсутствовали.
С помощью онлайн программы HaploReg (v4.1) выявлено, что полиморфизм rs314276 гена LIN28B находится в регионе гистонов, маркирующих промоторы в 5 тканях (культуры клеток эктодермы и энтодермы, предшественников нервной ткани и др.) и энхансеры в 2 тканях (клетки крови и печень). Установлено, что данный полиморфизм расположен в регионе регуляторных мотивов ДНК, являющихся сайтами связывания с 3 транскрипционными факторами (TFs): HNF1_7, OTX и Pou2f2_known5. Различия между LOD scores аллелей А (alt) и С (ref) составляют 1,2, -12,0 и 11,9 для HNF1_7, OTX и Pou2f2_known5 соответственно. Таким образом, аллель А rs314276 гена LIN28B, ассоциированный с поздним менархе, существенно снижает аффинность к транскрипционному фактору OTX и повышает аффинность к транскрипционным факторам HNF1_7 и Pou2f2_known5. Следует отметить, что данные факторы транскрипции играют существенную роль в регуляции процессов клеточного цикла (апоптоза, пролиферации, клеточной дифференцировки и др.), что имеет важное значения для пубертатного развития и формирования менархе [36].
С использованием он-лайн программы GTExportal (включает информацию об экспрессии генов в 48 различных органах и тканях) in silico установлена ассоциация полиморфизма rs314276 гена LIN28B с уровнем транскрипции гена LIN28B в гипофизе (коэффициент линейной регрессии для аллеля С равен β=-0,50, р=9,4×10-12, FDR≤0,05). Следует отметить, что аллель С полиморфизма rs314276 связан с пониженной экспрессией гена LIN28B.
Согласно литературным данным, продукт гена LIN28B (lin-28 homolog B) регулирует биосинтез let-7 семейства микроРНК, оказывая на него ингибирующий эффект [37]. Как показали экспериментальные исследования, проведенные на Caenorhabditis elegans, let-7 участвует в регуляции сроков развития организма. Также, let-7 микроРНК вовлечена в регуляцию генов клеточного цикла (Cyclin D1, D2, Cdc25a and Cdk6) и онкогенеза (Ras, c-Myc, HMGA-2). Мишени let-7 – Myc, Kras, Igf2bp1 and Hmga2, являются известными регуляторами размеров тела и метаболизма у млекопитающих [37, 38]. В исследовании Zhu H. et al. [39] при изучении Lin28/let-7 биологического пути на трансгенных мышах выявлены связи между уровнем экспрессии LIN28A (является гомологом LIN28), увеличением размеров тела и задержкой полового созревания. Также предполагается, что LIN28B может служить одним из «пусковых факторов» пубертатного развития у человека (в т.ч. менархе), инициируя пульсирующую секрецию гонадолиберинов гипоталамусом [40]. Резюмируя, следует отметить, важную роль молекулярно-генетических детерминант, как в формировании доброкачественных пролиферативных заболеваний женской репродуктивной системы у женщин Центрального Черноземья России (ранее проведенные исследования [41, 42]) , так и возраста становления менархе у женщин этого региона РФ (результаты настоящего исследования).
Заключение
Полиморфизм rs314276 гена LIN28B ассоциирован с возрастом менархе у русских женщин Центрального Черноземья РФ. Аллель А полиморфного локуса rs314276 гена LIN28B ассоциирован с поздним менархе (у женщин, имеющих в генотипе аллель А – генотипы A/A и C/A, менархе наступает на 0,18 года позже по сравнению с женщинами, не имеющими в генотипе данного аллеля – генотип C/C), снижает аффинность к транскрипционному фактору OTX, повышает аффинность к транскрипционным факторам HNF1_7 и Pou2f2_known5 и связан с повышенной транскрипцией гена LIN28B в гипофизе. Дальнейшие исследования генетических детерминант менархе среди населения России позволят установить полиморфные локусы, ассоциированные с менархе в различных этно-территориальных группах РФ и использовать их в дальнейшем при изучении генетических факторов, лежащих в основе развития менархе-ассоциированных заболеваний (лейомиома матки, эндометриоз, гиперплазия эндометрия, рак молочной железы, ожирение, сердечно-сосудистые заболевания, сахарный диабет и др.).



