Миома матки – доброкачественное новообразование, возникающее в мышечном слое матки. У женщин репродуктивного возраста миома матки диагностируется с частотой 25–30% [1, 2]. В основном для лечения миомы матки применяются хирургические методы [3, 4], что связано со значительными экономическими затратами на медицинское обслуживание женщин репродуктивного возраста.
Механизмам развития пролиферативных заболеваний матки посвящено много исследований [5, 6]. В литературе имеются данные о генетических факторах развития данного заболевания, но они еще не до конца изучены [7–9]. Гены фолатного цикла могут быть ассоциированы с возникновением миомы матки. Это может быть связано со снижением активности ферментов фолатного цикла, что ведет к нарушению метаболизма фолиевой кислоты и повышению содержания гомоцистеина, обладающего самостоятельным мутагенным и прооксидантным действием [10, 11]. Кроме того, при гипергомоцистеинемии снижается синтез простациклина и усиливается пролиферация гладкомышечных клеток сосудистой стенки [12–14], что может повышать риск развития миомы матки.
Цель исследования: изучить связь между полиморфными вариантами генов фолатного цикла и миомой матки.
Материалы и методы
В исследование включены женщины с изолированной миомой матки (n=188) и женщины контрольной группы (n=789), являющиеся русскими жительницами Центрально-Черноземного региона России, не имеющими родственных связей.
Исследуемые группы сформированы на базе отделения гинекологии ОГБУЗ БОКБ Святителя Иоасафа. Критерием включения в группу больных являлось наличие изолированной миомы матки, верифицированной эхографическими и гистероскопическими методами с последующим гистологическим исследованием полученного материала. Выборка контроля формировалась из женщин без пролиферативных заболеваний матки, проходивших диспансеризацию в клинико-диагностическом отделении Перинатального центра. Все участницы исследования подписали согласие на обработку данных. Работа выполнена под контролем Этического комитета медицинского института НИУ БелГУ.
Материалом для исследования являлась геномная ДНК, выделенная стандартным методом фенольно-хлороформной экстракции из лейкоцитов периферической крови. Проводилось генотипирование пяти полиморфных локусов генов фолатного цикла: МТRR c.66А>G rs1801394, SHМТ1 c.1420С>Т rs1979277, ТYМS c.*19С>Т rs699517, ТYМS c.*89А>G rs2790, МТR c.2756А>G rs180508. Согласно данным работы [15], эти полиморфизмы имеют значимый регуляторный потенциал.
Анализ полиморфных локусов генов фолатного цикла проведен методом полимеразной цепной реакции в режиме реального времени с использованием олигонуклеотидных праймеров и зондов, синтезированных ООО «Синтол» (Россия) [16].
Статистический анализ
Проведена оценка распределения аллелей и генотипов полиморфных локусов в сравниваемых группах.
Распределение частот аллелей и генотипов в исследуемых выборках оценивали с помощью таблиц сопряженности 2×2 с использованием критерия χ2 с учетом поправки Йейтса на непрерывность. Для выявления ассоциаций аллельных вариантов с формированием миомы матки использовали показатель отношения шансов (ОШ) и его 95% доверительный интервал (95% ДИ). Статистическую обработку данных производили в программе STATISTICA for Windows 10.0.
Анализ ассоциаций сочетаний аллелей и генотипов исследуемых полимофных вариантов с развитием миомы матки проводили с помощью программы АРSampler (https://sourceforge.net/projects/apsampler/), использующей метод Монте-Карло–Марковских цепей и байесовскую непараметрическую статистику [17, 18]. Для валидации найденных ассоциаций использовался пермутационный анализ (pperm). За статистически значимый уровень принимали pperm<0,05.
Оценка влияния изученных полиморфных вариантов на уровень экспрессии генов проводилась in silico [19] с помощью базы данных программы GTExportal (https://www.gtexportal.org/). В исследование вошли результаты с p<8×10-5, FDR ≤0,05. О направленности связи аллельных вариантов полиморфизма с уровнем транскрипции генов судили по коэффициенту линейной регрессии β, который характеризует изменение нормализованного показателя генной экспрессии на один полиморфный (альтернативный) генетический вариант [20].
Регуляторные эффекты полиморфных локусов выявляли по данным программы SNPinfo (https://npinfo.niehs.nih.gov/).
Результаты и обсуждение
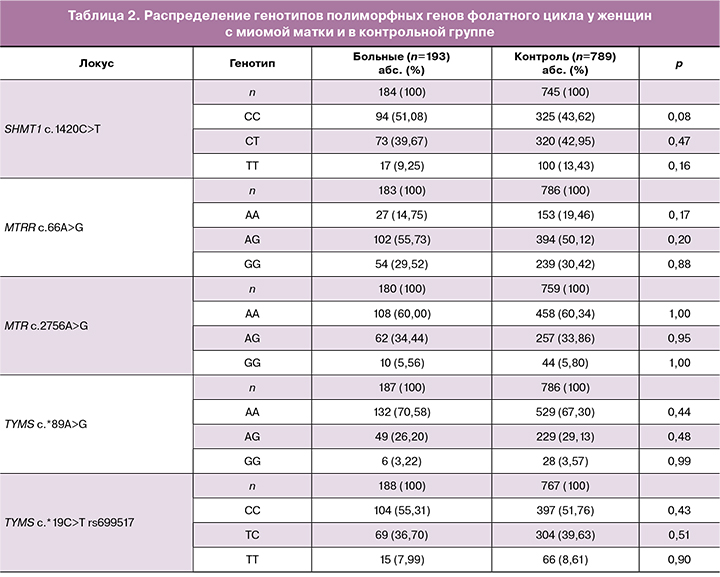
Сравнительный анализ частот аллелей и генотипов в исследуемых выборках представлен в таблицах 1 и 2. Распределение частот аллелей и генотипов соответствовало равновесию Харди–Вайнберга для всех изученных полиморфных локусов (табл. 1, 2).
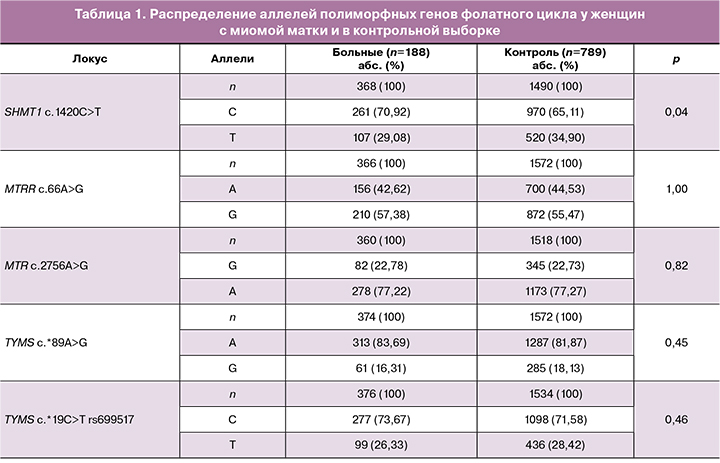
Анализ распределения аллелей и генотипов генов SHМТ1 c.1420С>Т rs1979277, МТRR c.66А>G rs1801394, МТR c.2756А>G rs180508, ТYМS c.*19С>Т rs699517, ТYМS c.*89А>G rs2790 выявил различия в частоте встречаемости аллеля С локуса rs1979277 SHМТ1 между больными с миомой матки (261/368, 70,92%) и контрольной группой (970/1490; 65,11%; χ2=4,21; р=0,04; ОШ=1,30; 95% ДИ 1,01–1,69).
Между другими исследуемыми генами фолатного цикла в сравниваемых группах значимых различий не выявлено (p>0,05).
Анализ носительства сочетаний аллелей и генотипов исследуемых локусов выявил низкую встречаемость сочетания генотипа ТТ rs1979277 SHМТ1 и аллеля G rs180508 МТR среди пациенток с миомой матки (3/176; 1,71%) в сравнении с контрольной группой (40/721; 5,54%; р=0,01; ОШ=0,29; 95% ДИ 0,09–0,96).
Выявлено, что среди пациенток с миомой матки частота комбинации генотипа СС rs1979277 SHМТ1 и аллеля С rs699517 ТYМS (90/184; 48,91%) значимо выше по сравнению с группой контроля (294/730; 40,27%; р=0,02; ОШ=1,41; 95% ДИ 1,02–1,96).
Наряду с этим сочетание генотипа ТТ rs1979277 SHМТ1 и аллеля G rs2790 ТYМS встречается в 3,7 раза реже у женщин с миомой матки (2/183; 1,09%) по сравнению с контрольной группой (30/742; 4,04%) и является протективным фактором развития изолированной миомы матки (р=0,03; ОШ=0,26; 95% ДИ 0,06–1,10).
С использованием онлайн-программы GTExportal (http://www.gtexportal.org/) выявлены три полиморфизма, связанные (p<8×10-5; FDR≤0,05) с уровнем экспрессии mRNA (cis-eQTL) четырех генов в разных органах.
Установлено, что полиморфный вариант A rs1801394 гена МТRR ассоциирован с низким уровнем экспрессии гена MTRR в яичниках (β=-0,42; FDR≤0,05), щитовидной железе (β=-0,13; FDR≤0,05), фибробластах (β=0,26; FDR≤0,05), базальных ганглиях головного мозга (β=-0,47; FDR≤0,05), подкожной жировой клетчатке (β=-0,16; FDR≤0,05).
Полиморфный вариант Т rs699517 гена TYMS ассоциирован с высоким уровнем экспрессии гена RP11-806L2.6 в фибробластах (β=0,23; FDR≤0,05), щитовидной железе (β=0,38; FDR≤0,05), надпочечниках (β=0,38; FDR≤0,05), гена ENOSF1 в фибробластах (β=0,24; FDR≤0,05) и низким уровнем транскрипции гена ENOSF1 в скелетной мускулатуре (β=-0,40; FDR≤0,05), гена TYMS в яичниках (β=-0,28; FDR≤0,05).
Полиморфный вариант G гена rs2790 ТYМS ассоциирован с высоким уровнем экспрессии гена ENOSF1 в фибробластах (β=0,29; FDR≤0,05) и надпочечниках (β=0,43; FDR≤0,05), гена RP11-806L2.6 в щитовидной железе (β=0,40; FDR≤0,05) и низкой экспрессией гена ENOSF1 в скелетной мускулатуре (β=-0,49; FDR≤0,05), щитовидной железе (β= -0,90; FDR≤0,05), влагалище (β=-0,51; FDR≤0,05), гена ТYМS в яичниках (β=-0,29; FDR≤0,05).
Таким образом, данные базы GTExportal свидетельствуют о значимом влиянии изученных полиморфизмов на уровень экспрессии генов MTRR, RP11-806L2.6, ENOSF1, ТYМS в органах женской репродуктивной системы (яичники и др.) и органах, принимающих непосредственное участие в регуляции их деятельности (щитовидная железа, надпочечники, подкожная жировая клетчатка и др.) и вовлеченных, соответственно, в патогенез миомы матки [21–24].
Полиморфный локус МТRR c.66А>G rs1801394 расположен в регионе энхансера экзонного сплайсинга (ESE) растворимого рецептора цитокина TNFα (spr55) (score=2,82). В базе данных SNPinfo регуляторный потенциал (RegPotential) локуса rs1801394 гена МТRR равен 0,25 (SNPinfo https://manticore.niehs.nih.gov/). Следует отметить, что показатель регуляторного потенциала характеризует степень участия локуса в регуляции экспрессии гена. Выявленное нами in silico значение регуляторного потенциала для локуса rs1801394, равное 0,25, указывает на его значимую роль в регуляции транскрипционной активности гена МТRR.
Полиморфный локус ТYМS c.*19С>Т rs699517 участвует в синтезе микро-РНК hsa-miR-151-3p (Score=144, Energy=-18,84), hsa-miR-28-5p (Score=165, Energy=-18,04), hsa-miR-338-5p (Score=156, Energy=-17,16), hsa-miR-498 (Score=141, Energy=-18,51), hsa-miR-548a-3p (Score=141, Energy=-15,15), hsa-miR-708 (Score=156, Energy=-17,16), hsa-miR-548e (Score=140, Energy=-12,36). Регуляторный потенциал изучаемого полиморфизма гена ТYМS c.*19С>Т rs699517 равен 0,12.
Полиморфный локус ТYМS c.*89А>G rs2790 участвует в синтезе микро-РНК hsa-miR-1248 (Score=151, Energy=-13,54), hsа-miR-192 (Scоre=140, Energy=-9,42), hsа-miR-215 (Scоre=140, Energy=-9,70), hsа-miR-515-3p (Scоre=143, Energy=-21,97). Регуляторный потенциал данного полиморфизма гена ТYМS c.*89А>G rs2790 равен 0,20.
В ходе нашего исследования было установлено, что комбинации полиморфных вариантов генов фолатного цикла связаны с формированием миомы матки. В литературе имеются данные об ассоциации аллеля G rs180508 МТR с высокой концентрацией гомоцистеина [25]. У женщин с быстроразвивающейся миомой матки выявлено наличие полиморфных вариантов c.2756А>G rs180508 МТR и c.66А>G rs1801394 МТRR.
В литературе имеются сведения, подтверждающие ассоциации гена SHМТ1 c.1420С>Т (rs1979277) с развитием изолированной миомы матки [26]. Данный полиморфный локус может нарушать работу фермента серингидроксиметилтрансферазы, продуктом которого будет выработка кофактора для тимилатсинтазы и глицина [27], что будет приводить к нарушению биосинтеза тимидилата и, как следствие, обусловливать развитие патологической пролиферации клеток [28]. В ряде исследований показаны взаимосвязи полиморфизма SHМТ1 c.1420С>Т (rs1979277) с развитием синдрома задержки роста плода [29], неходжкинских злокачественных лимфом [30], рака прямой кишки [31].
Заключение
В результате проведенного исследования установлена значимая роль генов фолатного цикла ТYМS c.*19С>Т rs699517, ТYМS c.*89А>G rs2790, SHМТ1 c.1420С>Т rs1979277, МТR c.2756А>G rs180508, МТRR c.66А>G rs1801394 в формировании изолированной миомы матки. Аллель С гена rs1979277 SHМТ1 служит фактором риска развития миомы матки (ОШ=1,30). Также фактором риска развития миомы матки является сочетание генотипа СС rs1979277 SHМТ1 и аллеля С rs699517 ТYМS (ОШ=1,41). Протективным фактором риска развития миомы матки является комбинация генотипа ТТ rs1979277 SHМТ1 и аллеля G rs2790 ТYМS (ОШ=0,26).



