Стимуляция функции яичников является важнейшим этапом программы экстракорпорального оплодотворения (ЭКО), во многом определяющим ее эффективность. Правильный выбор препаратов для овариальной стимуляции (ОС) необходим для получения достаточного числа ооцитов и, следовательно, для повышения шансов на успешные результаты лечения. В настоящее время ОС для мультифолликулярного роста проводится с помощью препаратов фолликулостимулирующего гормона (ФСГ) и/или человеческих менопаузальных гонадотропинов [1].
Первый препарат рекомбинантного ФСГ (рФСГ) фоллитропин альфа был разработан в Европе в 1995 г. (GONAL-f, Merck KGaA, Darmstadt, Germany) [2] и в США в 1997 г. (GONAL-f RFF; EMD Serono, Inc., Rockland, MA) [3]. Препарат фоллитропина бета (Puregon; NV Organon, Oss, Нидерланды) получил маркетинговую авторизацию в Европе в 1996 г. и в США (Follistim AQ) в 2004 г. [4]. Препараты рФСГ производятся с использованием генетически модифицированных клеток яичника китайского хомячка, культивированных в биореакторах, а иммунохроматографическая очистка с использованием аффинных антител, которые специфически связываются с ФСГ, приводит к получению высокоочищенного препарата с постоянным профилем изоформ ФСГ и высокой специфической активностью [5]. Эти препараты были сопоставимы по количеству полученных ооцитов и частоте живорождения при применении в программах вспомогательных репродуктивных технологий (ВРТ). Однако эталонным препаратом рФСГ признан фоллитропин альфа (GONAL-f, Merck KGaA, Darmstadt, Германия) [6], при применении которого на сегодняшний день проведено 19 245 492 цикла [7] и рождено более 4 млн детей [8, 9].
В связи с окончанием патентной защиты на фоллитропин альфа и необходимостью расширения рынка альтернативных препаратов для ОС в последние десятилетия в ряде европейских стран начались клинические разработки биоаналогичных препаратов фоллитропина альфа. Биоаналогичный лекарственный препарат (биоаналог, биоподобный лекарственный препарат, биосимиляр) – биологический лекарственный препарат, который содержит версию действующего вещества зарегистрированного биологического оригинального (референтного) препарата и для которого продемонстрировано сходство (подобие) на основе сравнительных исследований с референтным препаратом по показателям качества, биологической активности, эффективности и безопасности [10].
Согласно рекомендациям Европейского агентства по лекарственным средствам (EMA), сходство биоаналогичного препарата с оригинальным лекарственным препаратом должно быть установлено с точки зрения физико-химических свойств, качественных характеристик, биологической активности, безопасности и эффективности и основано на всесторонних исследованиях, прежде чем биоаналогичный препарат может быть одобрен для медицинского применения в клинической практике [6, 10–13]. Аналогичные требования предъявляются и к биоаналогичным препаратам, содержащим рФСГ [14, 15].
На сегодняшний день опубликованы результаты трех клинических исследований биоаналогов фоллитропина альфа, проведенных в соответствии с требованиями EMA для рФСГ [15]: Bemfola («Гедеон Рихтер», Венгрия), Ovaleap («Терамекс», Ирландия) и Примапур («АйВиФарма», Россия) [10].
Первый российский биоаналогичный препарат фоллитропина альфа (Примапур) был зарегистрирован в Российской Федерации в 2019 г. Были соблюдены все стадии его производства от активной фармацевтической субстанции до готовой лекарственной формы в виде раствора для подкожного введения в предзаполненной шприц-ручке [15–17], проведены все необходимые исследования в соответствии с Российскими рекомендациями [16] и рекомендациями EMA для рФСГ [15], в том числе сравнительные физико-химические и доклинические исследования [18, 19], а также исследование фармакокинетики с участием здоровых добровольцев (номер протокола и результатов исследования в международной базе данных клинических исследований ClinicalTrials.gov: NCT03857230) [20].
В отечественной литературе опубликованы результаты двух клинических исследований, посвященных оценке терапевтической эффективности биоаналогичного препарата фоллитропина альфа (Примапур). Барахоева З.Б. и соавт. (2018) в многоцентровом рандомизированном ослепленном на эмбриологическом этапе в параллельных группах сравнительном исследовании III фазы, посвященном подтверждению терапевтической эквивалентности биоаналогичного препарата фоллитропина альфа (Примапур) оригинальному лекарственному препарату (ГОНАЛ-ф) при проведении ОС в программе ЭКО, показали, что биоаналогичный препарат фоллитропин альфа эквивалентен оригинальному препарату по количеству аспирированных и зрелых ооцитов, зигот; количеству дней стимуляции; количеству введенного препарата на курс лечения; частоте наступления биохимической и клинической беременности (ClinicalTrials.gov: NCT03088137) [21]. Однако в это клиническое исследование были включены только женщины с нормальными параметрами овариального резерва (уровень антимюллерова гормона (АМГ) ≥1 нг/мл).
В 2021 г. были опубликованы результаты масштабного многоцентрового клинического исследования в реальной клинической практике, проведенного в 35 клиниках ВРТ России и оценивающего результаты 5484 циклов ОС с применением препарата «Примапур», которые подтвердили его эффективность и безопасность в неселективной популяции пациенток с применением различных протоколов овариальной стимуляции (ClinicalTrials.gov: NCT04854707) [22], однако в этом исследовании не была проведена сравнительная оценка эквивалентности форм выпуска отечественного препарата фоллитропина альфа в виде раствора для подкожного введения и оригинального препарата фоллитропина альфа в виде лиофилизата для приготовления раствора для подкожного введения, а также не выполнен анализ проведенных протоколов ОС в зависимости от параметров овариального резерва и предполагаемого овариального ответа пациенток, включенных в исследование.
Известно, что группа пациенток в программах ВРТ крайне неоднородна и включает в себя женщин со сниженным, нормальным и высоким овариальным резервом. В связи с этим представляет интерес сравнительная оценка эквивалентности биоаналогичного препарата фоллитропина альфа (Примапур, раствор для подкожного введения, «АйВиФарма», Россия) и оригинального препарата фоллитропина альфа (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения, «Мерк-Сероно», Италия) у женщин с различным ответом на овариальную стимуляцию в программе ЭКО.
Цель исследования: определить эквивалентность биоаналогичного препарата фоллитропина альфа (Примапур, раствор для подкожного введения) и оригинального препарата фоллитропина альфа (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения) у женщин с различным ответом на ОС в программе ЭКО.
Материалы и методы
Дизайн исследования. Ретроспективное неинтервенционное (наблюдательное) когортное сравнительное многоцентровое исследование эффективности и безопасности применения биоаналогичного препарата фоллитропина альфа (Примапур, раствор для подкожного введения, «АйВиФарма», Россия) и оригинального препарата фоллитропина альфа (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения, «Мерк-Сероно», Италия), применяемых в соответствии с показаниями, указанными в действующих утвержденных инструкциях по медицинскому применению.
Исследуемые препараты. Примапур (МНН: фоллитропин альфа, регистрационное удостоверение № ЛП-005826), раствор для подкожного введения, одноразовые предзаполненные шприц-ручки 900 МЕ (66 мкг); ГОНАЛ-ф (МНН: фоллитропин альфа, регистрационное удостоверение № ЛС-000200), лиофилизат для приготовления раствора для подкожного введения, 75 МЕ (5,5 мкг).
Клинические центры. Исследование проведено при участии ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России (Клинический центр № 1) и Уральского НИИ охраны материнства и младенчества Минздрава России (Клинический центр № 2).
Популяция пациенток. В исследовании приняли участие 240 пациенток, в том числе 120 пациенток в группе применения лекарственного препарата «Примапур», раствор для подкожного введения, и 120 пациенток в группе применения лекарственного препарата «ГОНАЛ-ф», лиофилизат для приготовления раствора для подкожного введения.
Пациентки были стратифицированы в зависимости от параметров овариального резерва и предполагаемого овариального ответа.
Основную группу (Примапур, раствор для подкожного введения) составили пациентки: 60 человек – с предполагаемым гиперответом (синдром поликистозных яичников (СПКЯ), мультифолликулярные яичники, АМГ более 3 нг/мл), более 15 ооцитов; 40 человек – с нормоответом (АМГ 2–3 нг/мл), 9–14 ооцитов; 20 человек – с гипоответом (АМГ менее 1 нг/мл), менее 8 ооцитов.
Группу сравнения (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения), стратифицированную по аналогичному принципу, составили женщины с гиперответом – 60 человек, нормоответом – 40 человек, гипоответом – 20 человек.
Критерии включения:
Установленные причины бесплодия и показания к применению методов ВРТ, согласно Приказу МЗ РФ от 31 июля 2020 г. N 803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Возраст 20–38 лет.
Не более двух попыток ЭКО/ИКСИ в анамнезе.
18≤индекс массы тела (ИМТ)≤30 кг/м2.
Базальный уровень ФСГ<12 МЕ/л.
Уровень АМГ не менее 0,5 нг/мл.
Критерии невключения:
Установленные противопоказания к применению методов ВРТ, согласно Приказу МЗ РФ от 31 июля 2020 г. N 803н «О порядке использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению».
Наличие эндометриоза III–IV стадии; гидросальпинкса.
Миома матки субмукозная независимо от размера; субсерозные и интерстициальные миоматозные узлы размерами более 4,5 см.
Уровень АМГ менее 0,5 нг/мл.
Менее 3 ооцитов, полученных в предыдущей программе ЭКО/ИКСИ.
Тяжелые формы олигоастенотератозооспермии, азооспермия: показания к ТESE/TESA/MESA, донорским сперматозоидам.
Анализ исходов протоколов овариальной стимуляции. Оценка антропометрических, демографических данных, продолжительности и причины бесплодия, количества попыток ЭКО/ИКСИ, общего количества аспирированных ооцитов, зрелых ооцитов (стадия MII), зигот (2PN), общей дозы введенного препарата, количества перенесенных эмбрионов, частоты наступления биохимических беременностей на перенос эмбриона (ПЭ) (уровень хорионического гонадотропина человека (ХГЧ) >20 МЕ/л на 12–14-й день после ПЭ), частоты наступления клинических беременностей на ПЭ (наличие плодного яйца и сердцебиения на 5–6-й неделе после ПЭ), частоты прогрессирующей беременности (более 12 недель), частоты ранних репродуктивных потерь (самопроизвольное прерывание беременности до 12 недель).
Протокол стимуляции. ОС в обеих группах проводили в протоколе с применением антагониста гонадотропин-рилизинг-гормона (антГнРГ). Стартовую дозу препаратов фоллитропина альфа (Примапур или ГОНАЛ-ф) подбирали с учетом параметров овариального резерва: при гипоответе она составляла 300 МЕ в сутки, нормоответе – 225 МЕ в сутки, гиперответе – 150 МЕ в сутки. Далее оценивали ответ яичников на 5–6-й день ОС и корректировали дозу при необходимости. АнтГнРГ вводили при диаметре доминантного фолликула 14–15 мм. Триггер овуляции (ХГЧ) назначали при диаметре доминантных фолликулов 17–18 мм при нормоответе и гипоответе. У женщин с гиперответом при риске развития синдрома гиперстимуляции яичников (СГЯ) проводили замену триггера ХГЧ на агонист гонадотропин-рилизинг-гормона (агГнРГ) в дозе 0,2 мг подкожно. Поддержку лютеиновой фазы проводили с использованием микронизированного прогестерона в дозе 600 мг в сутки интравагинально со следующего дня после трансвагинальной пункции фолликулов яичников (ТВП). Оплодотворение проводили методами ЭКО/ИКСИ в зависимости от параметров спермы. ПЭ проводили на 3-й или 5-й дни культивирования, не более 2 эмбрионов.
Биохимическую беременность диагностировали при уровне ХГЧ>20 МЕ/л на 12–17-й день после ПЭ, клиническую беременность (наличие плодного яйца, эмбриона и сердцебиения) – через 6 недель после ПЭ.
Статистический анализ
Для статистического анализа данных и построения графиков использовали программу для работы с электронными таблицами Microsoft Excel (Microsoft, США) и пакет статистических программ GraphPad Prism (GraphPad Software, США). Для определения нормальности распределения использовали обобщенный тест Д’Агостино–Пирсона. Данные с нормальным распределением представлены как среднее значение (стандартное отклонение), для их сравнения использовали t-test. Качественные данные представлены как абсолютное значение (n) и %, для их сравнения использовали точный тест Фишера. Различия считали статистически значимыми при p<0,05.
Результаты и обсуждение
После разработки и внедрения в клиническую практику биоаналогичных препаратов фоллитропина альфа в разных странах их эффективность и безопасность активно обсуждаются в литературе [23]. Это обусловлено тем, что для широкого внедрения в клиническую практику необходимо доказать эквивалентность биоаналога и оригинального препарата в отношении эффективности и безопасности не только в ходе рандомизированных контролируемых регистрационных клинических исследований, но и в различных группах пациенток, участвующих в программе ЭКО с применением препаратов фоллитропина альфа во всех лекарственных формах, существующих на рынке.
Настоящее исследование проведено с целью сравнительной оценки клинической (терапевтической) эквивалентности биоаналогичного препарата фоллитропина альфа (раствора для подкожного введения) и оригинального препарата фоллитропина альфа (лиофилизата для приготовления раствора для подкожного введения) в зависимости от овариального ответа на стимуляцию у 240 пациенток в программе ЭКО (табл. 1).
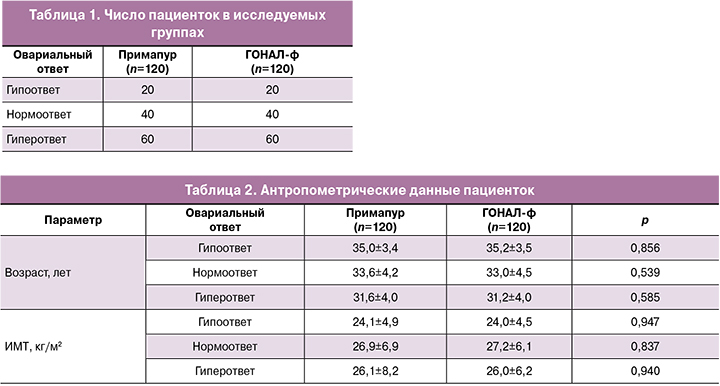
Основную группу (Примапур, раствор для подкожного введения) составили пациентки: 60 человек – с предполагаемым гиперответом (СПКЯ, мультифолликулярные яичники, АМГ более 3 нг/мл), более 15 ооцитов; 40 человек – с нормоответом (АМГ 2–3 нг/мл), 9–14 ооцитов; 20 человек – с гипоответом (АМГ менее 1 нг/мл), менее 8 ооцитов.
Группу сравнения (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения), стратифицированную по аналогичному принципу, составили женщины с гиперответом – 60 человек, нормоответом – 40 человек, гипоответом – 20 человек.
ОС проводилась в протоколе с применением антГнРГ.
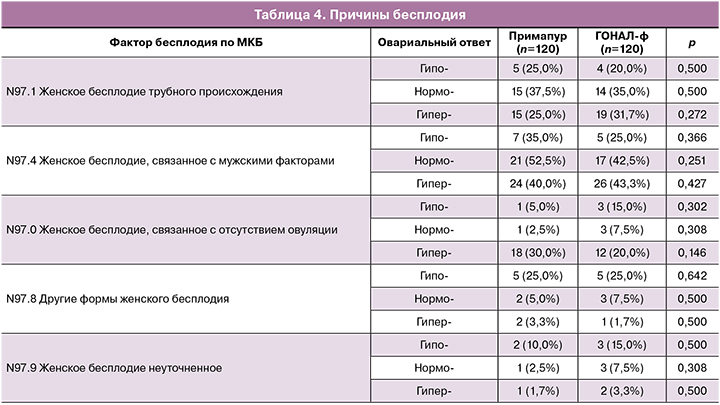
Пациентки основной группы (Примапур, раствор для подкожного введения) и группы сравнения (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения) в пределах подгруппы (гипоответ, нормоответ, гиперответ) были сопоставимы по антропометрическим данным (возраст, ИМТ), клинико-анамнестическим данным и факторам бесплодия (табл. 2).
Как видно из представленных данных, статистически значимых различий в возрасте и ИМТ у пациенток с различным овариальным ответом на гонадотропную стимуляцию между группами применения препаратов «Примапур» и «ГОНАЛ-ф» выявлено не было (p>0,05).
Анализ клинико-анамнестических данных пациенток, принявших участие в исследовании (табл. 3), показал, что частота встречаемости первичного бесплодия в группах применения препаратов «Примапур» и «ГОНАЛ-ф» была сопоставима у женщин с гипоответом: 8 (40,0%) и 10 (50,0%), p=0,376; нормоответом: 15 (37,5%) и 16 (40,0%), p=0,500 и гиперответом: 18 (30,0%) и 22 (36,7%), p=0,281. Аналогично частота вторичного бесплодия статистически значимо не отличалась в обеих группах: 12 (60,0%) и 10 (50,0%), p=0,376; 25 (62,5%) и 24 (60,0%), p=0,500; 42 (70,0%) и 38 (63,3%), p=0,281. По длительности бесплодия пациентки обеих групп также значимо не различались: 6,1±2,1 и 5,8±2,5 (p=0,683); 4,9±2,0 и 4,8±1,9 (p=0,819); 2,5±1,1 и 2,7±0,8 (p=0,257).

Наибольшая длительность бесплодия имела место у женщин с гипоответом по сравнению с женщинами с нормо- и гиперответом, однако не было выявлено статистически значимых различий в зависимости от применяемого препарата для ОС.
Анализ результатов предшествующего лечения бесплодия показал, что у всех пациенток в анамнезе отмечены 1–2 программы ВРТ с различными исходами, число которых было сопоставимо в группах применения препаратов «Примапур» и «ГОНАЛ-ф».
В структуре гинекологической патологии у женщин с гипоответом превалировал наружный генитальный эндометриоз (НГЭ), и в анамнезе имели место оперативные вмешательства на яичниках по поводу эндометриоидных кист, однако частота встречаемости НГЭ не различалась в зависимости от применяемого препарата для ОС – «Примапур» и «ГОНАЛ-ф» (5 (25,0%) и 8 (40,0%), р=0,250). Частота встречаемости миомы матки была сопоставима в группах пациенток с различным овариальным ответом и не зависела от применяемого индуктора овуляции. Гиперответ был обусловлен наличием СПКЯ или мультифолликулярных яичников, частота которых в обеих группах была сопоставимой (24 (40,0%) и 19 (31,7%), р=0,223).
Также анализ причин бесплодия не выявил существенных различий в пределах каждой подгруппы (гипо-, нормо- и гиперответ) в зависимости от применяемого индуктора овуляции (табл. 4).
Таким образом, статистически значимых различий в клинико-анамнестических характеристиках между исследуемыми группами применения препаратов «Примапур» и «ГОНАЛ-ф» выявлено не было.
Параметры ОС и эмбриологического этапа представлены в таблице 5.

Как видно из представленных данных, в пределах каждой подгруппы с различным овариальным ответом не выявлено значимых различий в суточной и суммарной дозах препаратов и длительности стимуляции в зависимости от применяемого препарата для ОС.
Однако у женщин с гипоответом применяли более высокие по сравнению с нормоответом суточные дозы индуктора как в группе применения препарата «Примапур», так и в группе применения препарата «ГОНАЛ-ф», которые способствовали росту 7,6±3,3 и 7,2±3,2 фолликулов соответственно (р=0,757).
Первичной конечной точкой регистрационного исследования при оценке эффективности биоаналогов фоллитропина альфа, установленной Европейскими и Российскими рекомендациями [15, 16], является оценка числа аспирированных ооцитов. Результаты сравнительной оценки полученных ооцит-кумулюсных комплексов (ОКК) в настоящем исследовании показали (рис. 1), что в группе женщин с нормоответом при применении препаратов «Примапур» и «ГОНАЛ-ф» было получено сопоставимое число ОКК (8,0±2,2 и 9,1±2,8 соответственно, р=0,125). Также сопоставимым оказалось число полученных ОКК при гиперответе (15,2±5,6 и 14,9±3,0, р=0,771).
Таким образом, у женщин с нормальными и повышенными параметрами овариального резерва (АМГ 2–3 нг/мл при нормоответе и АМГ>3 нг/мл при гиперответе) подтверждена эквивалентность препаратов «Примапур» и «ГОНАЛ-ф», что согласуется с результатами других исследований [10, 21, 24].
Как известно, женщины со сниженным овариальным резервом – особенно сложная категория пациенток ВРТ, и нередко на старте ОС врач, опасаясь отсутствия адекватного овариального ответа, выбирает необоснованно высокие стартовые дозы гонадотропинов. Поэтому важно отметить, что в группе с гипоответом (АМГ менее 1 нг/мл, менее 8 ооцитов) число ОКК, полученных при применении препарата «Примапур» значимо не отличалось от аналогичного показателя при применении препарата «ГОНАЛ-ф» (4,8±2,8 и 4,6±2,4, р=0,847) при сопоставимых стартовых дозах (300 МЕ в сутки), суточных и суммарных дозах индуктора. Этот факт подтверждает эквивалентность отечественного биоаналогичного препарата фоллитропина альфа оригинальному препарату фоллитропина альфа у женщин с субоптимальным овариальным ответом, что крайне важно для клинической практики.
Другим важным параметром эффективности является число зрелых ооцитов (МII), способных к оплодотворению.
Результаты оценки числа зрелых ооцитов (МII), в зависимости от применяемого препарата для ОС (Примапур и ГОНАЛ-ф), не выявили статистически значимых различий как при гипоответе (3,8±2,4 и 3,6±2,1, р=0,808), нормоответе (5,5±1,9 и 5,7±2,6, р=0,477), так и гиперответе (10,4±5,1 и 10,0±6,0, р=0,725). Аналогичные закономерности выявлены при оценке числа зигот с двумя пронуклеусами (3,0±2,2 и 2,8±2,0, р=0,765; 3,9±2,1 и 4,4±3,0, р=0,391; 8,2±4,6 и 7,1±4,4, р=0,183); числа бластоцист (1,7±0,6 и 1,6±0,5, р=0,570; 2,0±0,9 и 2,3±1,1, р=0,186; 3,9±2,1 и 3,5±1,9, р=0,276) и числа бластоцист отличного качества (1,4±0,4 и 1,2±0,4, р=0,122; 1,6±0,7 и 1,7±0,8, р=0,554; 3,0±1,8 и 2,6±1,6, р=0,201).
Таким образом, статистически значимых различий в параметрах ОС и эмбриологического этапа между группами применения препаратов «Примапур» и «ГОНАЛ-ф» выявлено не было.
ПЭ в группах применения препаратов «Примапур» и «ГОНАЛ-ф» проведен у всех пациенток с гипоответом, у 40 (100%) и 38 (95%), р=0,247, женщин с нормоответом и у 44 (73,3%) и у 40 (66,7%) женщин с гиперответом, р=0,275. Причинами отмены ПЭ в основном были риск развития СГЯ, а также выявление гидросальпинкса или полипа эндометрия в процессе стимуляции (несмотря на отсутствие патологии по данным обследования перед вступлением в программу ЭКО). Число женщин с переносом одного и двух эмбрионов было сопоставимо во всех группах. Частота криоконсервации эмбрионов в группах применения препаратов «Примапур» и «ГОНАЛ-ф» была сопоставима и значимо не различалась у женщин с гипоответом (5 (25,0%) и 8 (40,0%), р=0,250); нормоответом (23 (57,5%) и 20 (50,0%), р=0,327) и гиперответом (43 (71,7%) и 44 (73,3%), р=0,500).
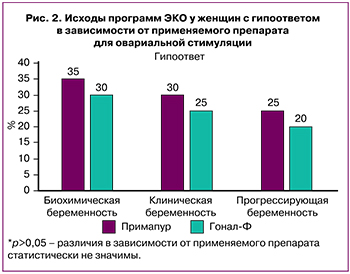
Результаты сравнительной оценки эффективности программ ЭКО в зависимости от применяемого препарата для ОС и характера овариального ответа представлены в таблице 6 и на рисунках 2–4.

Так, у женщин с гипоответом между группами применения препаратов «Примапур» и «ГОНАЛ-ф» не выявлено значимых различий в частоте биохимической беременности (7 (35,0%) и 6 (30,0%), р=0,500); клинической беременности (6 (30,0%) и 5 (25,0%), р=0,500); прогрессирующей беременности (5 (25,0%) и 4 (20,0%), р=0,500) и частоте ранних репродуктивных потерь (1 (5,0%) и 1 (5,0%), р=0,756). Аналогичная закономерность имела место в группах с нормоответом (15 (37,5%) и 17 (42,5%), р=0,410) и гиперответом (26 (43,3%) и 24 (40,0%), р=0,427), 21 (35,0%) и 18 (30,0%), р=0,348); 17 (28,3%) и 15 (25,0%, р=0,418).
Полученные в настоящем исследовании результаты не согласуются с данными метаанализа Longobardi et al. (2019) [25], проанализировавших результаты трех рандомизированных контролируемых клинических исследований [24, 26, 27], в которых при применении биоаналога рФСГ по сравнению с оригинальным препаратом рФСГ значительно ниже были частота клинической беременности (RR 0,83; 95% CI 0,71–0,96) и частота живорождения (RR 0,82; 95% CI: 0,70–0,97).
Напротив, в более позднем метаанализе Budani et al. (2021) не выявлено различий в частоте биохимической беременности и частоте живорождений в группе применения оригинального препарата рФСГ по сравнению с группой применения биоаналога [10].
Таким образом, исходя из результатов настоящего клинического исследования, результаты программ ЭКО при применении биоаналогичного препарата фоллитропина альфа (Примапур) и оригинального (референтного) препарата фоллитропина альфа (ГОНАЛ-ф) были сопоставимы в пределах подгрупп с гипоответом, нормоответом и гиперответом.
Не отмечено нежелательных реакций при применении обоих препаратов фоллитропина альфа.
Заключение
Результаты проведенного исследования подтвердили эквивалентность биоаналогичного препарата фоллитропина альфа (Примапур, раствор для подкожного введения) и оригинального препарата фоллитропина альфа (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения) у женщин с различным ответом на ОС, что подтверждено статистически сопоставимыми параметрами стимулированного цикла (стартовой, суточной и суммарной дозой препаратов), числом аспирированных ооцитов, зрелых ооцитов, зигот, бластоцист, бластоцист хорошего качества и криоконсервированных эмбрионов. Исходы программ ЭКО (частота биохимической беременности, клинической беременности, прогрессирующей беременности и ранних репродуктивных потерь) при сравнении биоаналога фоллитропина альфа (Примапур, раствор для подкожного введения) и оригинального препарата фоллитропина альфа (ГОНАЛ-ф, лиофилизат для приготовления раствора для подкожного введения) были также сопоставимы в пределах подгруппы с гипоответом, нормоответом и гиперответом.
Полученные данные позволяют рекомендовать отечественный биоаналогичный препарат фоллитропина альфа (Примапур) для широкого внедрения в клиническую практику у различных категорий пациенток в программах ЭКО независимо от параметров овариального резерва и типа овариального ответа.



