В декабре 2019 г. в Китайской Народной Республике в городе Ухань (провинция Хубэй) был впервые зарегистрирован первый случай тяжелого острого респираторного вирусного заболевания, вызванного новым коронавирусом – SARSCoV‑2 [1, 2]. Развитие пандемии, связанной с COVID‑19, привело к тяжелым социально‑экономическим последствиям, изменению общественной жизни и производственной деятельности [3, 4].
К наиболее уязвимой категории для развития острых респираторных вирусных инфекций, гриппа и COVID‑19 относятся не только люди пожилого возраста, но и беременные женщины [5–7].
Во время беременности происходят физиологические изменения в иммунной, сердечно‑сосудистой и дыхательной системах, которые позволяют предположить, что беременные женщины в большей мере уязвимы к воздействию патогенных инфекционных агентов, развитию инфекции и тяжелых осложнений. При развитии пневмонии у беременных чаще встречаются преждевременные роды и рождаются недоношенные дети с низкой массой тела, увеличивается частота проведения операций кесарева сечения [8, 9].
Смертность среди пациентов с SARS‑CoV‑2 может быть связана, с одной стороны, с наличием тяжелой хронической соматической патологии, а с другой – с присоединением вторичной бактериальной инфекции, вызванной устойчивыми штаммами микроорганизмов [10, 11].
Данные первых исследований показывали, что антибактериальные препараты (АБП) рекомендовались пациентам общего профиля с COVID‑19 в основном из‑за подозрения на сопутствующие бактериальные инфекции [11–13]. MacIntyre C.R. et al. обнаружили, что доля пациентов с COVID‑19 с наличием бактериальной ко‑инфекции ниже, чем во время предыдущих пандемий гриппа, и остается открытым вопрос об эмпирическом использовании АБП у большей части пациентов при диагностировании COVID‑19 [14].
Таким образом, различия между распространением бактериальной инфекции и назначением антимикробных препаратов (АМП) при COVID‑19 связаны с высоким риском роста резистентности бактерий к АМП и требуют микробиологического контроля у различных категорий пациентов, в том числе беременных и родильниц.
Цель исследования: оценить частоту назначения АМП и результаты микробиологического исследования у беременных, родильниц с COVID‑19 на основании анализа данных электронных карт проведенных телемедицинских консультаций (ТМК) пациенткам из различных регионов Российской Федерации.
Материалы и методы
На основании Приказа Минздрава России №171 от 16.03.2020 г. «О временном порядке организации работы медицинских организаций в целях реализации мер по профилактике и снижению рисков распространения новой коронавирусной инфекции» в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России организована работа федерального дистанционного консультативного центра анестезиологии‑реаниматологии для беременных по вопросам диагностики, лечения COVID‑19 и пневмонии.
Нами проведен ретроспективный анализ сведений о 2500 беременных и родильниц из базы данных пациенток различных регионов Российской Федерации с подтвержденным COVID‑19, которым осуществлялись ТМК в период с января по март 2021 г. На каждый случай ТМК оформлялся протокол.
Анализировали следующие показатели: возраст, срок гестации, анамнестические данные (наличие гестационного сахарного диабета (ГСД), преэклампсии, сахарного диабета 2 типа и ожирения (индекс массы тела (ИМТ)≥30 кг/м2) в анамнезе), объем поражения легких по данным компьютерной томографии органов грудной клетки (КТ ОГК), проведение респираторной поддержки (с искусственной вентиляцией легких (ИВЛ) и без ИВЛ), лабораторные показатели системного воспалительного ответа (количество лейкоцитов в общем анализе крови, уровень С‑реактивного белка (СРБ), прокальцитонина (ПКТ)), проведение микробиологических исследований, назначения АМП: АБП и противогрибковых, а также глюкокортикостероидов (ГКС).
Основным методом лучевой диагностики любой вирусной пневмонии, в том числе связанной с COVID‑19, является КТ ОГК. Для проведения лучевых исследований беременным женщинам обязательны наличие строгих клинических показаний и максимально возможное снижение лучевой нагрузки. Во время беременности проведение КТ ОГК рекомендовано пациенткам с тяжелым и крайне тяжелым течением заболевания; во всех других случаях решение принимается врачебной комиссией (согласно методическим рекомендациям «Организация оказания медицинской помощи беременным, роженицам, родильницам и новорожденным при новой коронавирусной инфекции COVID‑19», версия 3 (21.01.2021)). Лечение беременных и родильниц с подтвержденным случаем COVID‑19 включало поддерживающую патогенетическую и симптоматическую терапию. Консервативная терапия сопутствующих заболеваний и осложнений проводилась в соответствии с клиническими рекомендациями, стандартами оказания медицинской помощи по данным нозологиям (согласно методическим рекомендациям «Организация оказания медицинской помощи беременным, роженицам, родильницам и новорожденным при новой коронавирусной инфекции COVID‑19», версия 1–3).
Из анализа были исключены 33 беременные и родильницы, у которых был отрицательным тест на SARS‑CoV‑2 при оценке методом полимеразной цепной реакции (ПЦР).
Статистический анализ
Данные обрабатывались с помощью программного обеспечения на базе Python (библиотеки Pandas, Numpy). Статистический анализ и построение графиков выполнялись с помощью программ Origin 2016 (OriginLab Corp.) и Microsoft Excel.
Результаты
Проанализированы данные 2467 беременных и родильниц. Все пациентки имели положительный тест на определение вируса SARS‑CoV‑2 при оценке методом ПЦР. В результате анализа клинико‑анамнестических характеристик пациенток с COVID‑19 получены следующие данные: возраст пациенток колебался от 20 до 49 лет, средний срок беременности на момент поступления в стационар составлял 31 неделю. Включенные в исследование беременные женщины были преимущественно в III триместре беременности (53,4%); во II триместре – 29,3%, в I триместре – 7,2%, в послеродовом периоде – 10,1% (табл. 1).
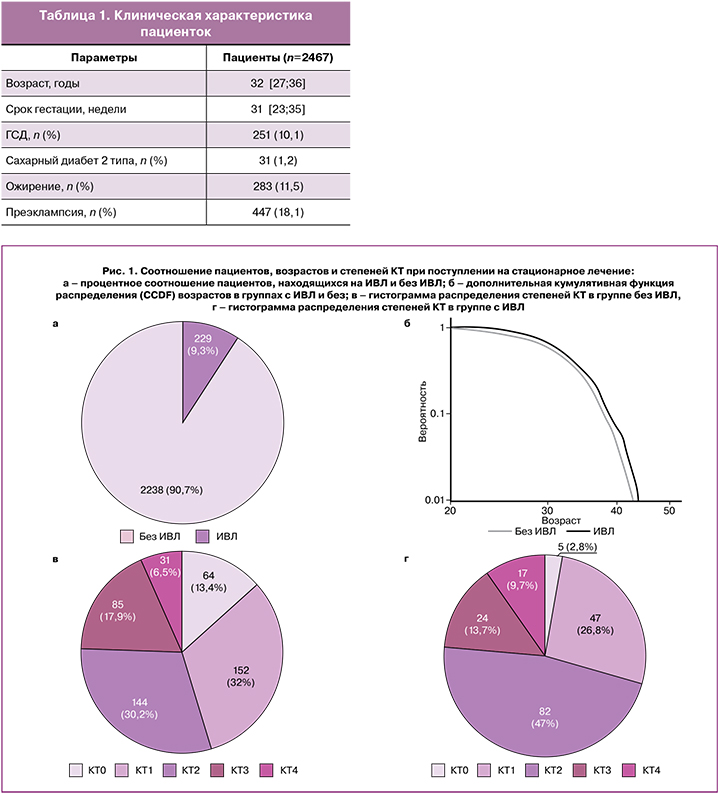
Учитывая изменения, происходящие во время физиологического течения беременности, и повышенный риск развития преэклампсии и ГСД, проведена оценка наличия данной экстрагенитальной патологии у беременных и родильниц (табл. 1).
КТ ОГК при поступлении в стационар проводилась в 19,3% случаев (n=476); при этом на ИВЛ находились 229 пациенток (9,3%) (рис. 1а), из них КТ ОГК была проведена 23,6% (n=54) пациенток, что связано с наличием строгих клинических показаний для проведения данного исследования (согласно методическим рекомендациям «Организация оказания медицинской помощи беременным, роженицам, родильницам и новорожденным при новой коронавирусной инфекции COVID‑19», версия 3 (21.01.2021)). При сравнении характера поражения легких по КТ ОГК у беременных и родильниц были отмечены характерные особенности: КТ‑1 встречалась в 32% случаев без ИВЛ и в 26,8% на ИВЛ; значимо увеличивалось количество женщин с КТ‑2 – с 30,2 до 47% и КТ‑3 – 17,9 и 13,7% соответственно. Наиболее тяжелое повреждение легких, КТ‑4, чаще было зарегистрировано на ИВЛ – в 9,7% случаев, в сравнении с 6,5% без ИВЛ. У 13,4% беременных и родильниц не выявлено изменений по данным КТ ОГК, но они все получали антибактериальную терапию (рис. 1).
В анализируемой группе беременных и родильниц выявлены статистически значимые различия в возрасте при проведении респираторной поддержки ИВЛ и без ИВЛ (без ИВЛ: среднее=31,43 года, SE=0,12; на ИВЛ: среднее=32,75 года, SE=0,35), p<0,05 считалось статистически значимым) (рис. 1б). В ранее опубликованных исследованиях показано, что пациенты с ожирением (ИМТ≥30 кг/м2) находятся в группе риска по развитию тяжелых осложнений, возникающих на фоне COVID‑19 [15]. В анализируемой нами когорте беременные и родильницы с ИМТ≥30 кг/м2 в 22,6% случаев находились на респираторной поддержке ИВЛ, в сравнении с 10,4% – без ИВЛ. Также частота ГСД при избыточной массе тела была выше и составляла 25,7%, в сравнении с женщинами без ожирения – 7,9%. Таким образом, избыточная масса тела в комбинации с ГСД осложняет течение COVID‑19 с развитием дыхательных нарушений, требующих респираторной поддержки ИВЛ.
В лабораторных показателях общего анализа крови наиболее часто у беременных и родильниц отмечался нормальный уровень лейкоцитов, а лейкоцитоз выявлялся у 839 пациенток, что соответствует 34% от общего количества исследуемых. Повышение уровня СРБ по сравнению с референсным значением встречалось в 71%; данный показатель коррелирует с тяжестью течения заболевания и воспалительной инфильтрацией в легочной ткани. Уровень ПКТ чаще определяли у пациентов на ИВЛ, и в 26,6% случаев он был повышенным. ПКТ находился в пределах референсных значений при COVID‑19 на фоне воспалительного повреждения легких вирусного характера и повышался при присоединении бактериальной инфекции, а также коррелировал с тяжестью течения заболевания. При проведении консервативной терапии наиболее часто использовались АМП и ГКС. АБП назначались в 78,8% случаев, противогрибковые препараты – в 49,6% и ГКС – в 55,8% (табл. 2) при лечении беременных и родильниц с COVID‑19.
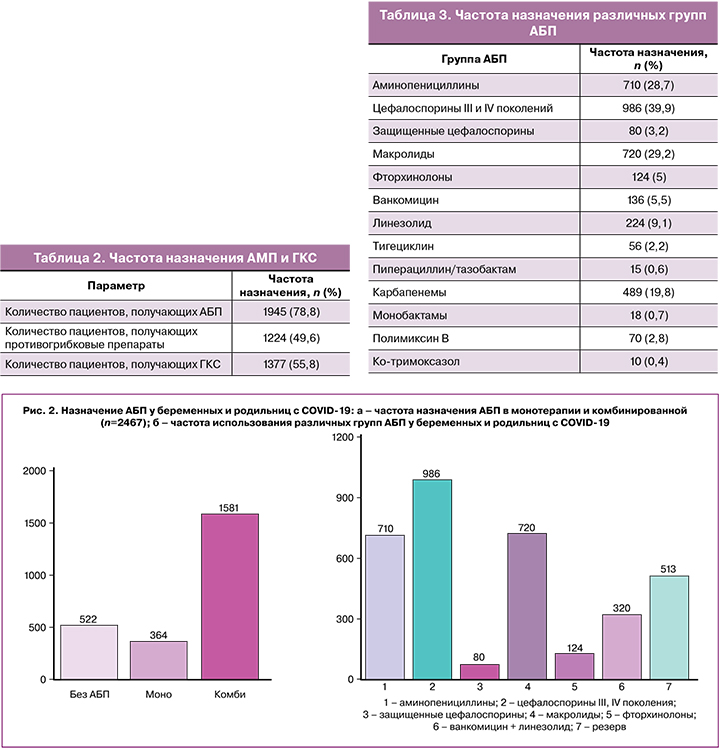
ГКС и противогрибковые препараты назначались беременным и родильницам на фоне проводимой антибактериальной терапии. Во время использования ГКС возможно развитие иммуносупрессивного действия с повышением риска присоединения вторичных бактериальных и грибковых инфекций, что может объяснять выявление в 30,4% грибов рода Candida spp. по результатам микробиологического исследования в анализируемых протоколах.
Монотерапия АБП проводилась в 18,7% (n=364) случаев, остальные пациентки получали два и более АБП из различных групп (рис. 2а). Чаще всего назначались цефалоспорины III–IV поколения – в 50,7% (n=986); с одинаковой частотой использовали аминопенициллины (ингибиторзащищенные аминопенициллины: амоксициллин/клавулановая кислота, ампициллин/сульбактам) и макролиды (азитромицин) – в 37 и 36,5% соответственно. Фторхинолоны (левофлоксацин, моксифлоксацин), которые использовали в послеродовом периоде, и защищенные цефалоспорины (цефоперазон/сульбактам, цефепим/ сульбактам, цефтазидим/авибактам, цефтолозан/ тазобактам) применяли в 6,4 и 4,1% соответственно (рис. 2б).
В качестве второй или третьей линии терапии в 42,8% использовали АБП резерва (карбапенемы, полимиксин В, тигециклин, пиперациллин/тазобактам, монобактамы, ко‑тримоксазол) в сочетании с препаратами, влияющими на грамположительную микрофлору, – ванкомицином, линезолидом. Из АБП резерва чаще всего применяли карбапенемы (меропенем, имипенем/циластатин) – у 489 пациенток (табл. 3).
Несмотря на широкое использование АБП, микробиологическое исследование у беременных и родильниц с COVID‑19 было отражено в протоколах ТМК только в 4% (n=98) случаев от общего количества пациенток; из них – у 10 пациенток (5,3%) с тяжелой и крайне тяжелой степенью тяжести течения заболевания. В ряде случаев результаты проведенных микробиологических исследований не были зафиксированы в протоколах ТМК. Сбор образцов для микробиологического исследования проводился из разных локусов: мокрота – 34,1%, центральный венозный катетер (ЦВК) – 11,4%, кровь из периферической вены – 3,8%, аспират трахеобронхиального дерева – 3% и другие локализации – 47,7% (аспират из брюшной полости, содержимое послеоперационной раны, отделяемое влагалища и цервикального канала и др.) (рис. 3а).
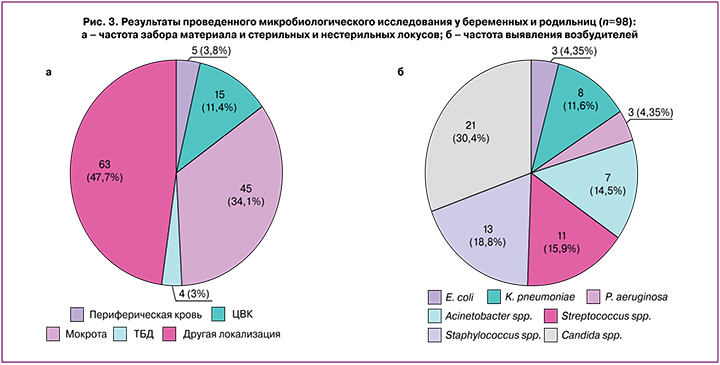
По результатам представленных в протоколах ТМК данных проведенных микробиологических исследований наиболее часто выделяемыми микроорганизмами были грибы Candida albicans – в 30,4% случаев. Среди грамположительных микроорганизмов чаще выявлялись Staphylococcus spp. – в 18,8% и Streptococcus spp. – в 15,9%, а из грамотрицательных – Acinetobacter spp. – в 14,5%, из них A. baumannii составлял 10,1%, на долю K. pneumoniae приходилось 11,6% (рис. 3б).
Обсуждение
Использование антибиотиков во время пандемии достигло катастрофических масштабов; их назначали в 90% случаев, хотя данные препараты нужны были лишь 10% пациентам, у которых развивались бактериальные осложнения. Назначение антибиотиков беспрецедентно выполнялось всем пациентам с COVID‑19, начиная с легких форм заболевания на амбулаторном звене, всем пациентам с лихорадкой в моноили комбинированной терапии. В результате пациенты получали АБП на каждом этапе – амбулаторное звено, при поступлении в обычные специализированные отделения и в ОРИТ стационара, вне зависимости от наличия показаний.
Полученные нами результаты по использованию АМП у беременных и родильниц с COVID‑19 фактически совпадают с данными опубликованного метаанализа 154 проведенных исследований. В анализ включены 30 623 пациента (общей популяции); из них 74,6% получали антибактериальную терапию (95% ДИ 68,3–80,0%) [16], а по нашим данным – 78,8%.
Выбор антибактериальной терапии, по данным нашего исследования, демонстрирует приоритетное назначение трех основных групп препаратов: цефалоспоринов III и IV поколения, макролидов и ингибиторзащищенных аминопенициллинов. Это отличается от результатов, полученных в исследовании Кароли Н.А. и соавт., в котором чаще всего назначались макролиды, далее фторхинолоны (только в послеродовом периоде) и цефалоспорины III поколения, но совпадает по использованию цефалоспоринов и макролидов в качестве лидирующей антибактериальной терапии [17].
Имеющиеся данные зарубежного систематического обзора, в котором проведен анализ 104 карт беременных женщин, свидетельствуют о несколько ином подходе к назначению и выбору антибактериальной терапии. В качестве лечения использовали антибиотики, противовирусные препараты и гидроксихлорохин. АБП назначались в 25,9% случаев, в сравнении с 78,8% пациенток, получающих АБП по нашим результатам. Чаще всего использовали цефалоспорин III поколения – цефтриаксон, что совпадает с нашими данными, далее ванкомицин и азитромицин [18].
В Центре вирусных исследований Великобритании проведено многоцентровое проспективное когортное исследование микробиологической диагностики инфекций у пациентов с COVID‑19. Микробиологическая диагностика выполнялась у 8649 (17,7%) из 48 902 пациентов, которые были госпитализированы в стационар, клинически значимые результаты культурального исследования имели место только у 1107 больных (12,7% от общего количества исследований) [19].
В начале пандемии, учитывая отсутствие знаний по течению новой COVID‑19‑инфекции у пациентов, фактически сразу назначали антибактериальную терапию даже при наличии легкой степени поражения легких КТ‑1, а многим больным – в начале заболевания одновременно с противовирусной терапией. Спустя некоторое время взгляд изменился и, начиная с версии 9 Временных методических рекомендаций «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID‑19)» (26.10.2022), антибактериальную терапию рекомендуется назначать при наличии убедительных признаков присоединения бактериальной инфекции (повышение ПКТ более 0,5 нг/мл, лейкоцитоз >10×109/л, появление гнойной мокроты). При этом в методических рекомендациях «Организация оказания медицинской помощи беременным, роженицам, родильницам и новорожденным при новой коронавирусной инфекции COVID‑19», версия 5 (29.12.2021) эмпирические антибиотики должны быть применены лишь в случае, если есть подозрение на бактериальную инфекцию с характерными симптомами (нейтрофильный сдвиг, долевое уплотнение на КТ или рентгене и т.д.), что может объяснять широкое использование антибиотиков и назначение при получении результатов поражения легких 1‑й степени по КТ ОГК. Выбор АМП и способ его введения осуществляется на основании тяжести состояния пациента, учитывая стратификацию, факторы риска полирезистентных возбудителей (наличие сопутствующих заболеваний, предшествующий прием антибиотиков и др.) и результаты микробиологической диагностики.
Заключение
Таким образом, проведенный анализ показал, что в представленных протоколах ТМК данные микробиологических исследований были отражены только в 4% случаев; при этом АБП использовались в 78,8%, и чаще всего выбор производился из препаратов широкого спектра действия и резерва; назначение происходило сразу же при поступлении в стационар без подтверждения наличия бактериальной инфекции. Смена антимикробной терапии чаще всего была эмпирической, что снижает эффективность, увеличивает длительность терапии и пребывания в стационаре, способствуя более частой смене АБП.
Чрезмерное использование АМП потенцирует как возникновение побочных эффектов, так и риск развития мультирезистентных штаммов микроорганизмов, что увеличивает частоту неблагоприятных клинических исходов. Проведение микробиологических исследований имеет важную роль в выборе рациональной антимикробной терапии и способствует сдерживанию роста резистентности бактерий и грибов.
Полученные данные могут помочь врачам‑клиницистам обеспечить лучшие подходы к лечению и реабилитации, поскольку важнейшими факторами предотвращения развития инфекционного заболевания являются своевременная диагностика и оказание медицинской помощи наиболее подверженным COVID‑19 группам населения. Считаем необходимым на основании полученных данных разработать и внедрить четкие критерии назначения АБП при COVID‑19, а также актуализировать методические рекомендации («Организация оказания медицинской помощи беременным, роженицам, родильницам и новорожденным при новой коронавирусной инфекции COVID‑19», версия 5 (29.12.2021)).



