Одной из распространенных причин гинекологических и эндокринных нарушений в подростковом возрасте является синдром поликистозных яичников (СПКЯ) [1–3]. К клиническим проявлениям СПКЯ относят не только гинекологические, но и множественные метаболические нарушения: инсулинорезистентность (ИР) и дислипидемию, ожирение, в особенности висцеральное, жировой гепатоз, сахарный диабет второго типа [4, 5]. Частота встречаемости метаболических нарушений у подростков с СПКЯ в 3–5 раз превышает таковую в группе здоровых девушек, сопоставимую по возрасту и индексу массы тела (ИМТ), достигая 33% [6]. При этом избыточный вес регистрируется у 38–88% пациенток с СПКЯ [7, 8].
Выявлено, что при СПКЯ ИР и ожирение являются самостоятельными факторами патогенеза заболевания [3, 4, 9]. С одной стороны, девушки с избыточной массой тела находятся в группе повышенного риска по развитию ИР, ГИ и ПКЯ в дальнейшем [9]. С другой стороны, пациентки с СПКЯ находятся в группе риска по развитию ожирения.
Вместе с тем растет число доказательств значимости системного воспаления в патогенезе СПКЯ, одним из механизмов которого является стимуляция провоспалительными факторами продукции андрогенов в яичниках. Так, в эксперименте in vitro показано, что ФНО-α стимулирует пролиферацию клеток теки, продуцирующих андрогены, а также потенциирует атрезию фолликулов [10]. Выявлено, что концентрация С-реактивного белка и провоспалительных цитокинов при СПКЯ тесно коррелирует с уровнем циркулирующих андрогенов [11–14]. Авторы полагают, что хроническое системное воспаление на фоне физиологической гиперинсулинемии, инсулинорезистентности и гиперандрогении при начале полового созревания, может у пациенток в группе риска по развитию СПКЯ стать пусковым механизмом дисрегуляции клеточных взаимодействий в теке яичников, потенциирующим гиперандргению, ановуляцию и метаболические осложнения СПКЯ в дальнейшем [15].
Цель исследования: изучить особенности СПКЯ у девочек в возрасте 15–17 лет, имеющих и не имеющих избыток массы тела и метаболические нарушения, в сравнении с группой «здоровых» сверстниц.
Материалы и методы исследования
В исследование были включены 95 девочек в возрасте от 15 до 17 лет включительно, имеющих как минимум два из трех компонентов Роттердамских критериев СПКЯ – олиго-/аменорею и/или гиперандрогенные проявления, и/или эхографические признаки поликистозных яичников. Кроме того, критериями включения явились: указание на менархе не менее 2 лет назад; отсутствие иных эндокринных болезней; отсутствие приема лекарств в течение 3 месяцев и более до начала исследования; информированное согласие пациентки и ее законного представителя на включение в исследование. Критериями исключения служили: опухоли органов малого таза; обострение хронических и острых соматических и/или инфекционных заболеваний; психические заболевания; генетические синдромы и пороки развития. Группу контроля составили 30 сверстниц, отнесенных к первой группе здоровья, с регулярными менструациями без гинекологической и эндокринной патологии.
Всем участницам исследования было проведено общеклиническое обследование, включавшее подробный сбор анамнеза, изучение жалоб, измерение антропометрических показателей (рост, ИМТ, соотношение объема талии (ОТ) к объему бедер (ОБ)), оценку выраженности избыточного оволосения.
Всем участницам исследования определяли концентрацию в венозной крови общего белка, мочевой кислоты, креатинина, прямого и общего билирубина, глюкозы, Ca2+, Fe2+/3+, высокочувствительного С-реактивного белка (СРБ) и лептина. Оценку липидного состава крови проводили по показателям общего холестерина, триглицеридов (ТГ), липопротеинов низкой (ЛПНП) и высокой (ЛПВП) плотности, коэффициент атерогенности (КА). Исследования проводили фотометрическим и турбидиметрическим методом на автоматических анализаторах BA-400 и A-25 с использованием реагентов Biosystems (Испания). Пероральный глюкозотолерантный тест (ПГТТ) проводили спустя 12–16 часов после последнего приема пищи. Уровень глюкозы и иммунореактивного инсулина (ИРИ) определяли в цельной венозной крови натощак, и спустя 120 минут после приема 75 г глюкозы. Рассчитывали гомеостатический индекс НОМА-ИР. Для косвенной оценки объема абдоминальной жировой ткани использовали индекс висцерального ожирения (Visceral Adiposity Index) [16] по формуле:
VAI = (ОТ÷(36.58+(1.89 × ИМТ))×(ТГ÷0.81)×(1.52 ÷ЛПВП), где ОТ измеряется см, ИМТ – кг/м2, ТГ и ЛПВП – ммоль/л.
Всем девочкам было проведено ультразвуковое исследование органов малого таза на 3–5 день спонтанного или индуцированного гестагенами менструального цикла и изучен расширенный гормональный профиль крови (ЛГ, ФСГ, ТТГ, АТ-ТПО, АТ-ТГ, Т4св, ДГА-С, Андростендион, Прл, Е2, Кортизола, Т). Определение уровня гормонов проводилось электрохемилюминесцентным и иммунохемилюминисцентным методом на автоматических анализаторах Cobas е 411 («Ф. Хоффманн-Ла Рош», Швейцария), Immulite 2000, Immulite 1000 (Siemens, США) с использованием реагентов тех же фирм. Определение ДГТ, АМГ, 17-ОН-прогестерона проводилось методом иммуноферментного анализа (ИФА) на автоматических анализаторах DYNEX DSX System по методу ELISA. Концентрация ГСПГ определяли методом ИФА с использованием системы «DPC» (США) на приборе «Immulite».
Статистическую обработку данных проводили в программах MS Excel и Statistica 8. Сравнение переменных, имеющих нормальное распределение, проводили методами дисперсионного анализа ANOVA. Сравнение множества групп попарно проводили пост-хок методом апостериорных множественных сравнений с подсчетом наименьшей значимой разницы Фишера (Least Significant Difference test, LSD). Показатели, для которых распределение значений в исследуемой выборке не соответствовало нормальному, сравнивали с использованием критерия Краскела-Уоллиса (Kruskal-Wallis rank tests). В последующем оценивали межгрупповые различия пост-хок тестом по критерию Данна или Сьегля-Кастеллана. Корреляции оценивали с использованием коэффициента ранговой корреляции Спирмена.
Результаты исследования и обсуждение
Девушки с СПКЯ по результатам анализа ПГТТ и индексу НОМА-ИР были распределены на подгруппы на фоне наличия метаболических нарушений (МН+) и без таковых (МН-). При рассмотрении внутри групп пациенток с СПКЯ показателей ИМТ выявлено, что большинство девочек в группе без МН имели ИМТ в пределах референсных значений, а большинство в группе с МН имели повышенный ИМТ. Для независимого анализа влияния нарушений углеводного обмена и избыточной массы тела пациенток с СПКЯ и здоровых девочек анализировали в рамках исследования «случай-контроль» в 5 подгруппах: пациентки с СПКЯ без метаболических нарушений (МН) (1) с нормальным весом (ИМТ<25 кг/м2, n=48; СПКЯ-МН/НВ) и (2) – с избыточным весом (ИМТ≥25кг/м2, n=10; СПКЯ-МН/ИВ); пациентки с СПКЯ с МН (3) и нормальным весом (ИМТ<25кг/м2, n=13; СПКЯ+МН/НВ) и (4) – с избыточным весом (ИМТ≥25 кг/м2, n=24; СПКЯ+МН/ИВ); «здоровые» (5) девочки с ИМТ<25 кг/м2 без МН (контрольная группа, n=30).
Анализ антропометрических показателей пациенток изучаемых групп СПКЯ в сравнении с группой контроля представлен в таблице 1. Закономерно, что две группы пациенток с СПКЯ с ИМТ≥25 кг/м2 значимо отличались от групп с нормальными показателями ИМТ и «здоровых» девочек по показателям массы тела, ИМТ, ОТ, ОБ, ОТ/ОБ в большую сторону. Кроме того, для группы пациенток СПКЯ+МН/ИВ были характерны значимо более высокие показатели массы тела, ИМТ, ОТ и соотношения ОТ/ОБ (р=0,0135, р=0,0031, р=0,0015 и р=0,0207, здесь и далее критерий множественных сравнений Данна) в сравнении с группой пациенток с СПКЯ-МН/ИВ. Так же показано, что пациентки с СПКЯ+МН/НВ в сравнении с девочками аналогичного веса без МН характеризовались большими значениями ОТ и ОБ (р=0,0435, р=0,0230), а также отличались от «здоровых» девочек большей ОТ (р=0,0233), что говорит о риске атеросклероза в данной группе, несмотря на нормативные значения ИМТ.
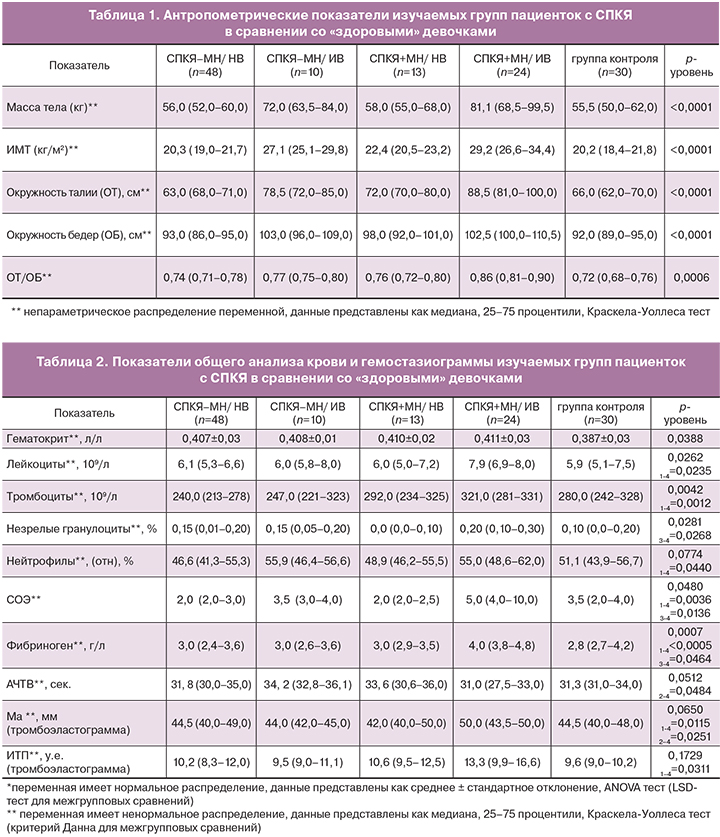
Наиболее отличающиеся параметры общего анализа крови и гемостазиограммы пациенток выделенных групп суммированы в таблице 2. При этом, пациентки с СПКЯ+МН/ИВ отличались от пациенток СПКЯ-МН/НВ значимо более высоким содержанием в периферической крови лейкоцитов (р=0,0235, здесь и далее критерий Данна), тромбоцитов (р=0,0012), нейтрофилов (р=0,00440), а так же СОЭ (р=0,0036). Несмотря на то, что данные показатели во всех группах находились в пределах референсных интервалов, их увеличение в группе СПКЯ+МН/ИВ может свидетельствовать о провоспалительной активации.
На ряду с этим у пациенток с СПКЯ+МН/ИВ в сравнении с подростками с СПКЯ-МН/НВ показана одновременная активация свертывающей системы крови согласно данным тромбоэластограммы и повышению концентрации фибриногена (табл. 2). Несмотря на то, что изучаемые параметры находились в пределах нормативных интервалов, у пациенток с СПКЯ+МН/ИВ прокоагулянтная активация выявлена вне лечения и может на ряду с дислипидемией и атеросклерозом может являться фактором риска сердечно-сосудистых осложнений.
Пациентки группы СПКЯ-МН/НВ отличались от контрольной группы следующими биохимическими показателями крови – повышенным содержанием общего белка (73,2±5,3 против 70,6±4,6, p=0,0431) и прямого билирубина (4,5±2,0 против 3,1±1,0, p=0,0251). Группа СПКЯ+МН/НВ значимо отличалась от группы СПКЯ-МН/НВ только повышенным содержанием железа (23,8±8,0 против 16,6±6,8, p=0,0423), а от контрольной группы – повышенным содержанием общего и прямого билирубина (19,0±5,5 против 11,1±4,2, p=0,0076 и 5,1±3,6 против 3,1±1,0, p=0,0155 соответственно) и железа (23,8±8,0 против 16,6±6,8, p=0,0343) (табл. 3). Поскольку известно, что при метаболизме билирубина образуется биливердин, являющийся сильным антиоксидантом, повышенное содержание билирубина у пациенток с СПКЯ с нормальным весом может рассматриваться как защитный адаптивный механизм против активации окислительного стресса и провоспалительного статуса, наблюдаемого при СПКЯ.
На ряду с этим выявлено, что у пациенток с СПКЯ на фоне избытка веса содержанием мочевины в крови было значимо ниже, чем у пациенток с СПКЯ с нормальным весом как на фоне (р=0,0215), так и без МН (р=0,0261) (табл. 3). Снижение образования конечного продукта деградации азотистых оснований для выведения из организма, мочевины, может являться предрасполагающим фактором повышения продуктов азотистого обмена и их повреждающего действия.
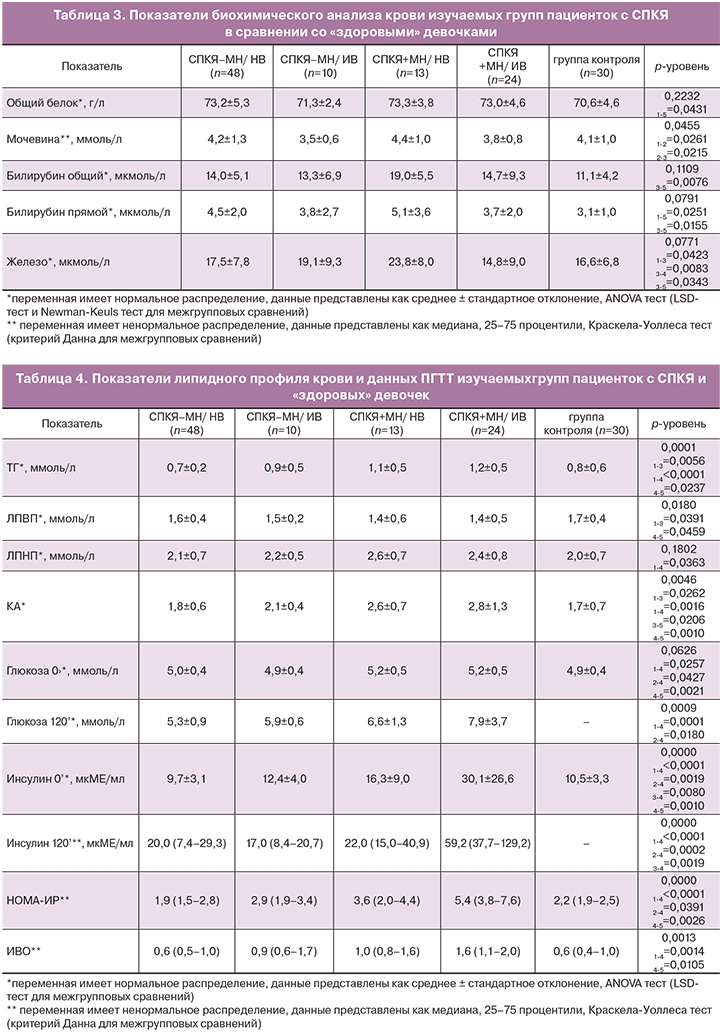
Анализ липидного профиля крови пациенток группы СПКЯ-МН/НВ не выявил отличий от контрольной группы по изученным показателям (табл. 4). Группа СПКЯ+МН/НВ отличалась от группы СПКЯ-МН/НВ повышенным содержанием ТГ и уровнем КА (p=0,0056 и p=0,0262) и снижением уровня ЛПВП (p=0,0391). При этом значимое отличие от контрольной группы наблюдали только для показателя КА, который был повышен в группе СПКЯ+МН/НВ (p=0,0206).
Липидный профиль крови пациенток с СПКЯ+МН/ИВ в сравнении со «здоровыми» девочками характеризовался, что было ожидаемо, дислипидемией согласно повышенному уровню ТГ (р=0,0237) и КА (р=0,0010), сниженным содержанием ЛПВП р=0,0459), более высокими значениями НОМА-ИР (р=0,0026) и глюкозы натощак (р=0,0021), а также повышенным сердечно-сосудистым риском согласно индексу ИВО (р=0,0105). Кроме того, пациентки с СПКЯ+МН/ИВ отличались от группы неосложненного нарушениями углеводного обмена СПКЯ-МН/НВ по тем же показателям, что и от группы контроля: более высокой концентрацией ТГ (р<0,0001), ЛПНП (р=0,0363) и КА (р=0,0016), повышенным содержанием глюкозы и инсулина на фоне ПГТТ, высоким значением НОМА-ИР (р<0,0001 для каждого показателя), а также высоким сердечно-сосудистым риском согласно индексу ИВО (р=0,0105), что суммировано в таблице 4.
Таким образом, избыточный вес на фоне СПКЯ в отсутствие метаболических нарушений не вызывал значимых отличий от групп контроля и СПКЯ-МН/НВ по показателям липидного спектра крови. В то время как в группе СПКЯ+МН/ИВ было отмечено повышение ряда параметров по сравнению с группой контроля и другими подгруппами СПКЯ (табл. 3 и 4). Таким образом, можно заключить, что СПКЯ у пациенток в подростковом возрасте, то есть с недавним дебютом заболевания, не сопровождается значимой дислипидемией. Из литературных данных известно, что у пациенток с СПКЯ во взрослом возрасте наблюдают нарушения липидного состава крови и более высокие значения НОМА-ИР не только при избытке веса, но и при нормальном весе и без метаболических нарушений [3, 4]. У пациенток в подростковом возрасте в исследуемой выборке, к отклонениям изученных показателей липидного профиля в сторону повышения атерогенности и увеличения сердечно-сосудистого риска приводило отягощение течения СПКЯ избыточным весом и метаболическими нарушениями.
При анализе маркера воспаления, СРБ, в группах СПКЯ с избыточной массой тела наблюдали повышение его уровня по сравнению с группами с нормативными показателями ИМТ как на фоне МН, так и без (р=0,0127 и р=0,0226, соответственно) (табл. 5). Кроме того, в группе СПКЯ+МН/ИВ уровень СРБ был значимо выше по сравнению с группой СПКЯ-МН/НВ (р=0,0011) и «здоровыми» девочками (р=0,0239). Данные о влиянии избыточной массы тела на уровень СРБ для объединенной группы СПКЯ подтверждались результатами корреляционного анализа – была выявлена положительная зависимость между повышением веса и нарастанием системного воспаления согласно уровню СРБ (r=0,29; р<0,05). Так же подтверждено положительное влияние избыточного веса на уровень СРБ согласно результатам двухфакторного анализа (р=0,0028). Вместе с тем по литературным данным у взрослых пациенток, в том числе по результатам метаанализов, показано, что повышенный уровень СРБ при СПКЯ обусловлен не фактом ожирения, а наличием самого заболевания [13, 14]. В нашем исследовании у девочек подросткового возраста не было выраженного влияния фактора СПКЯ и наличия метаболических нарушений на уровень СРБ. По результатам факторного анализа значимое влияние было подтверждено только для избыточного веса.
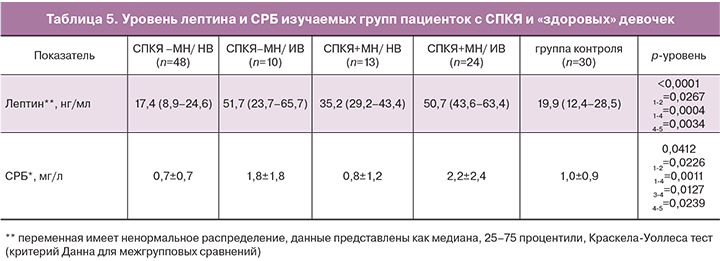
Вместе с тем у пациенток с СПКЯ при повышении ИМТ и нарушениях метаболизма выявлена гиперлептинемия, что является логичным следствием того, что данный адипокин секретируется преимущественно подкожной жировой тканью (табл. 5). При этом, уровень лептина был значимо выше у пациенток с избыточным весом как на фоне МН так и без в сравнении с группой СПКЯ-МН/НВ (р=0,0267 и р=0,0004, соответственно). В группе СПКЯ+МН/ИВ данный показатель был также повышен относительно контрольной группы (р=0,0034). Применение двухфакторного дисперсионного анализа выявило независимое влияние факторов избыточного веса (р=0,0007) и наличия метаболических нарушений (р=0,0083) на уровень лептина в крови. Оба фактора независимо вызывали повышение уровня лептина, что так же может рассматриваться как фактор активации системного воспалительного ответа при отягощении течения СПКЯ избыточным весом и нарушениями метаболизма.
Таким образом, полученные данные свидетельствуют о том, что у девочек-подростков СПКЯ сам по себе не был ассоциирован с провоспалительной активацией. Повышенное содержание маркеров воспаления (уровень лейкоцитов, СРБ, лептин) наблюдали только в подгруппах с избыточной массой тела и/или наличием метаболических нарушений. Наряду с активацией свертывающей системы, провоспалительный статус предрасполагает и является фактором эндотелиальной дисфункции при СПКЯ на фоне МН у пациенток уже в подростковом возрасте.
Сравнительный анализ гормонального профиля крови выявил у пациенток с СПКЯ в выделенных группах в сравнении со «здоровыми» девочками значимо более высокие концентрации ЛГ, соотношения ЛГ/ФСГ, Т, ИСА, 17-ОНП, кортизола и андростендиона. Группы пациенток с СПКЯ в зависимости от наличия избытка веса и ИР отличались в гормональным профиле крови только по концентрации ТЭСГ, и обусловленной этим индексом свободных андрогенов. В группе девочек с СПКЯ+МН/ИВ в сравнении с пациентками с СПКЯ-МН/НВ выявлено значимое снижение ТЭСГ (25,1 (20,3–32,0) против 47,5 (36,4–68,4); р=0,0003, критерий Данна), и соответственно, значимое повышение ИСА (5,9 (4,8–9,2) против 3,6 (1,6–6,0), р=0,0143).
Таким образом, для всех пациенток с СПКЯ в сравнении со «здоровыми» девочками были характерны не только более высокие показатели яичниковой гиперандрогении, но активация гипоталамо-гипофизарно-яичниковой и –надпочечниковой оси, что подтверждалось более высокими уровнями ЛГ, ЛГ/ФСГ, кортизола, 17-ОНР, ДГА-С и андростендиона. Пациентки с СПКЯ, кроме того, отличались более высокими концентрациями АМГ, в сравнении с группой «здоровых» подростков. Вместе с тем пациентки с СПКЯ на фоне МН и избытка веса характеризовались наиболее высоким значением индекса свободных андрогенов, что говорит о наиболее высокой концентрации свободного тестостерона в крови в этой группе.
Таким образом, анализируя пациенток с СПКЯ с учетом наличия метаболических нарушений и избыточного ИМТ, выявлены не только ожидаемые отличия пациенток с СПКЯ на фоне метаболических нарушений и с избыточным весом (СПКЯ+МН/ИВ) в сравнении с группой СПКЯ неотягощенного течения (СПКЯ–МН/НВ) в виде наиболее неблагоприятного профиля липидов крови и более выраженной биохимической гиперандрогении, но и более выраженной провоспалительной активацией согласно более высокому уровню СРБ (р=0,0011), лептина (р=0,0004) и содержанию лейкоцитов (р=0,0235), тромбоцитов (р=0,0012), нейтрофилов (р=0,0440) и СОЭ (р=0,0036).
Пациентки с СПКЯ+МН/ИВ в сравнении с девочками контрольной группы характеризовались так же не только значимо более высокими значениями НОМА-IR (р=0,0026) и глюкозы натощак (р=0,0021), более высоким уровнем ТГ (р=0,0237) и КА (р=0,0010) при более низком содержании ЛПВП (р=0,0459), повышенным риском сердечно-сосудистой патологии по индексу VAI (р=0,0105), а также более высоким значением СРБ (р=0,0239) и лептина (р=0,0034).
Девочки с СПКЯ+МН/НВ значимо отличалась от пациенток СПКЯ и МН−/НВ более высоким содержанием железа (р=0,0423), более высоким содержанием ТГ (р=0,0056), значением КА (p=0,0262) и более низким уровнем ЛПВП (p=0,0391), что свидетельствовало о дислипидемии в данной группе, несмотря на нормативные показатели ИМТ.
Девочки с СПКЯ+МН/НВ значимо отличалась от девочек контрольной группы более высоким содержанием общего и прямого билирубина (p=0,0076 и p=0,0155 соответственно) и железа (23,8±8,0 против 16,6±6,8, p=0,0343), более высоким показателем КА (p=0,0206).
Пациентки из группы с СПКЯ–МН/ИВ отличались от девочек СПКЯ и МН–/НВ более высоким уровнем СРБ (р=0,0226) и лептина (р=0,0267), что свидетельствует о провоспалительной активации при СПКЯ у пациенток с избыточным весом, несмотря на отсутствие МН.
Пациентки из группы с СПКЯ–МН/НВ отличались от сверстниц контрольной группы более высоким содержанием общего белка (p=0,0431) и прямого билирубина (p=0,0251).
Заключение
Полученные данные исследуемой выборки у подростков, в отличие от взрослых пациенток, свидетельствуют об отсутствии значимого влияния только избыточного веса на изученные показатели липидного спектра крови у девушек с СПКЯ, если развитие заболевания не ассоциировано с отклонениями углеводного обмена и инсулинорезистентностью. Напротив, сочетание избыточного веса и метаболических нарушений уже в подростковом периоде обусловливает появление достаточно выраженной дислипидемии и повышение атерогенности, а также увеличение сердечно-сосудистого риска. В представленной нами выборке девочек подросткового возраста обнаружено выраженное влияния фактора избыточного веса на уровень СРБ (р=0,0028), а также независимое влияние факторов избыточного веса (р=0,0007) и наличия метаболических нарушений (р=0,0083) на уровень лептина в крови. Таким образом, полученные данные свидетельствуют о том, что в подростковом возрасте само заболевание СПКЯ не ассоциировано с провоспалительной активацией, в отличие от результатов, характерных для взрослых женщин. При этом, наличие избыточного веса и/или метаболических нарушений, в особенности их сочетание у пациентки, может рассматриваться как фактор активации системного воспалительного ответа и сердечно-сосудистого риска при СПКЯ уже в подростковом возрасте. В связи с социальной значимостью метаболических осложнений и развития сердечно-сосудистых заболеваний при СПКЯ параметры липидного профиля крови и углеводного метаболизма, а также соотнесение результатов с показателем ИМТ, должны учитываться при оценке фенотипов СПКЯ уже с подросткового возраста.



