Проблема выпадения женских половых органов (ВЖПО) является одной из ведущих причин госпитализаций женщин в гинекологические стационары. Частота пролапса тазовых органов варьирует в зависимости от региона от 3 до 50%, но только 10-20% женщин обращаются за медицинской помощью [1]. Риск проведения хотя бы одной операции по коррекции генитального пролапса у женщин в возрасте до 80 лет составляет от 6,3 до 19% [2]. При этом количество вновь выявляемых случаев ВЖПО не имеет тенденции к снижению. Ведущая роль в развитии ВЖПО традиционно отдается акушерскому травматизму; однако в настоящее время немаловажной причиной заболевания считается структурный дефект связочного аппарата матки [3-5]. Поиски оптимальных способов хирургического лечения продолжаются до настоящего времени [6]. Несмотря на наличие большого числа вариантов оперативного лечения, сохраняется проблема рецидивирования пролапса тазовых органов (ПТО). Рецидив апикального пролапса возникнет у 23% женщин, перенесших сакрокольпопексию, и у 41%, прооперированных влагалищным доступом [7]. По данным кохрейновского обзора 2016 г., повторные оперативные вмешательства по поводу вновь возникших расстройств мочеиспускания требуются 4% пациенток, перенесших сакрокольпопексию, а для операций влагалищным доступом - от 5 до 18% [8-10]. Mesh-ассоциированные осложнения также остаются значимым фактором неэффективного оперативного лечения ПТО [11-14]. Решение этих проблем проводится в двух главных направлениях: разработка новых вариантов оперативного лечения и поиск новых синтетических материалов для протезирования связочного аппарата [15-17]. Закономерным следствием хирургического лечения больных с тяжелыми формами ПТО является снижение качества жизни пациенток в связи с упорной приверженностью врачей гинекологических стационаров к консервативному ведению послеопера-ционного периода. Продолжительный постельный режим до 5-7-х суток, назначение ограничивающей диеты, длительное стояние мочевых катетеров вызывают, с одной стороны, неудобства для пациенток, а с другой - снижают эффект оперативного лечения из-за неудовлетворительных условий заживления послеоперационной раны. Неоправданная полипрагмазия (антибиотикотерапия без обоснованных показаний, длительное применение анальгетиков, средств для стимуляции мочеиспускания), отсутствие широкой практики применения мультимодальной анальгезии приводят к большим финансовым затратам и значительно повышают стоимость законченного случая [18, 19]. Альтернативой такому консервативному подходу является активно развивающееся направление в хирургии - «быстрый путь» (Fast-track), который по сути представляет собой концепцию «ускоренного выздоровления» (Enhanced Recovery After Surgery, ERAS), которое все еще не нашло широкого применения в гинекологической практике [20-22]. Известны лишь единичные публикации по применению принципов ERAS в акушерстве и гинекологии [23-26], причем в гинекологической практике в большей степени эта технология используется онкогинекологами [27].
В связи с этим целью исследования является снижение частоты рецидивов у пациенток с тяжелыми формами ВЖПО путем внедрения протокола ускоренного выздоровления.
Материалы и методы
В исследование были включены 98 пациенток с тяжелыми формами ВЖПО: POP-Q II-III степени по международной классификации выпадений женских половых органов [28, 29]. Основанием для включения в исследование являлось наличие тяжелых форм ПТО, возраст постменопаузы (60— 80 лет). Критериями исключения стали: репродуктивный и пременопаузальный возраст, наличие тяжелой экстрагенитальной патологии, сочетание апикального пролапса с энтероцеле и/или гиперактивным мочевым пузырем. Операции проводились в 2 этапа. Первый этап заключался в выполнении передней кольпоррафии с наложением кисетного шва на мышечную стенку мочевого пузыря, перемещение его за урогенитальную диафрагму и подвешивание его за счет наложения швов нерассасывающимися нитями на лобково-шеечную фасцию. Далее выполнялась задняя кольпоперинеоррафия с леваторопластикой путем наложения на перера- стянутые мышцы отдельных стягивающих узловых швов рассасывающимися нитями на 2—3 уровнях. На втором этапе осуществлялась вентрофиксация матки нерассасывающимся шовным материалом (через брюшную полость) или сетчатым имплантом (забрюшинно) к апоневрозу открытым или эндо-скопическим доступом.
В группу сравнения (ретроспективная) вошло 26 прооперированных пациенток с общепринятым ведением послеоперационного периода. На предоперационном этапе прием твердой пищи ограничивался не менее чем за 24 ч до операции, назначались антимикробные препараты широкого спектра действия (комбинация фторхинолона или цефалоспоринов III поколения в сочетании с метронидазолом) с продолжением их введения парентерально до 5-7-х суток послеоперационного периода. Премедикация на предоперационном этапе не применялась. Всем пациенткам проводилась профилактика тромбоэмболических осложнений: компрессионный трикотаж и назначение низкомолекулярных гепаринов (НМГ) за 12 чдо операции с продолжением введения в послеоперационном периоде до 7-10-х суток.
Во время оперативного вмешательства использовалась мультимодальная аналгезия, в том числе применение регионарных методов обезболивания с назначением в послеоперационном периоде несте-роидных противовоспалительных средств (НПВС) или опиоидных анальгетиков.
В послеоперационном периоде прием твердой пищи возобновлялся не ранее 3 суток. В первые 2 суток после оперативного вмешательства питание ограничивалось только употреблением воды. После активизации пациентки на 3-и сутки мочевой катетер удалялся. На 3-й и 4-й день дважды с целью стимуляции функции кишечника и мочеиспускания назначался раствор прозерина 1,0 мл внутримышечно. На 5-е сутки всем пациенткам назначалась очистительная клизма. Выписка из стационара производилась после снятия швов с промежности и передней брюшной стенки на 9— 10-е сутки после операции.
В основную (проспективную) группу были включены 72 пациентки, которым применялся разработанный с учетом рекомендаций хирургического общества по улучшению восстановления после операции протокол ускоренного выздоровления [30]. Предоперационный этап включал: консультирование анестезиологом, последний прием пищи за 12 ч до операции, рекомендации по применению компрессионного трикотажа II класса компрессии, профилактику венозных тромбоэмболических осложнений по высокой степени риска (НМГ за 12 ч до операции), антибиотикопрофилактику за 60 минут до оперативного вмешательства (цефа- золин 2,0 внутривенно капельно или ципрофлоксацин 100,0 в сочетании с метронидазолом 100,0 внутривенно капельно).
Интраоперационно проводилось согревание пациентки, вводились анестетики короткого действия или транквилизаторы с целью премедикации, перфалган 100 мл внутривенно капельно, применялась комбинированная анестезия. По окончании влагалищного этапа операции с целью уменьшения травматического отека тканей влагалища в мочевой пузырь вводился катетер Фолея. Затем приступали к выполнению второго этапа — вентрофиксации матки.
В раннем послеоперационном периоде (1-е сутки) через 3 ч после операции разрешался пероральный прием жидкости, а через 6 ч — возобновление энте-рального питания. К окончанию 1-х суток начиналась активизация пациенток, проводилась профилактика тромбоэмболических осложнений назначением НМГ 1 раз в сутки подкожно. С целью обезболивания назначались НПВС, ингибиторы циклооксигеназы-1, -2, -3 или опиоидные аналгетики.
В позднем послеоперационном периоде (2—5-е сутки) через 24 ч после операции удалялись вну-тривенный катетер и катетер Фолея, проводился контроль функции мочевого пузыря путем ведения дневника мочеиспускания. Проводилась обработка швов промежности и влагалища растворами антисептиков. Продолжалось использование ком-прессионного трикотажа II класса компрессии. Со 2-х суток разрешался пероральный прием твердой пищи. Применение НПВС продолжалось не более 3 суток, НМГ вводились до выписки из стационара с рекомендацией перехода на прием таблетированных форм антикоагулянтов в домашних условиях. При необходимости в единичных случаях для опорожнения кишечника использовался раствор магнезии 25% — 20 мл перорально. Швы с раны промежности снимались на 5-е сутки после оперативного вмешательства.
В качестве сравниваемых показателей учитывались: продолжительность этапа фиксации матки (второй этап операции), объем кровопотери, вид обезболивания, медикаментозная нагрузка (дли-тельность применения антимикробных препаратов, обезболивающих и стимулирующих лекарственных средств), время восстановления функции мочеиспу-скания, необходимость выполнения очистительных клизм в послеоперационном периоде, послеопе-рационный койко-день, стоимость законченного случая по нозологии «N81» (МКБ-10). В основной группе продолжительность наблюдения составила 12 месяцев с проведением контрольных осмотров через 3, 6 и 12 месяцев после операции с определением количества и вида рецидивов ВЖПО. Качество жизни пациенток оценивалось до и после проведенного хирургического лечения на основании подсчета количества баллов по результатам заполнения опросника «Пролапс тазовых органов - качество жизни» (ПТО-КЖ) и опросника для выявления нарушений мочеиспускания (UDI-6) [31].
Статистический анализ
Количественные показатели оценивались на предмет соответствия нормальному распределению. Для описания массивов с нормальным распределением проводился расчет средних арифметических величин (M) и стандартного отклонения (SD), данные пред-ставлены в формате М (SD), для сравнения показателей рассчитывался t-критерий Стьюдента. Данные, распределение которых отличалось от нормального, описывались при помощи значений медианы (Me), нижнего и верхнего квартилей (Q1-Q3) в формате Ме [Q1;Q3]. Для сравнения значений использовался U-критерий Манна-Уитни. Для номинальных данных рассчитаны абсолютные значения и процентные доли, при сравнении использован критерия х2 Пирсона, в качестве количественной меры различий рассчитывался показатель относительного риска (ОР) с расчетом границ 95% доверительного интервала (95% ДИ). Различия рассчитываемых показателей считались статистически значимыми при уровне значимости p<0,05. Статистическая обработка материалов исследования проведена с использованием стандартного пакета STATISTICA 13.3 программы Ехсе1 2010.
Результаты и обсуждение
Пациентки обеих групп были сопоставимы по возрасту, степени тяжести и клиническим формам ПТО. Средний возраст составил 62,6 (8,2) года. Распределение по степени тяжести выпадения половых органов в группах не отличалось. Вторая степень тяжести ПТО встречалась в 52/98 (53,1%) случаях, а 3-я степень - в 46/98 (46,9%). В обеих группах у большинства пациенток имело место сочетание неполного выпадения матки с формированием цистоцеле и несостоятельности мышц тазового дна (табл. 1).
На втором месте по распространенности выявлено сочетание апикального пролапса и цистоцеле. Изолированный апикальный пролапс наблюдался лишь в единичных случаях. Согласно результатам анкетирования, в обеих группах около половины пациенток предъявляли жалобы на затрудненное мочеиспускание, почти 25% женщин (24/98) - на учащенное мочеиспускание, стрессовое недержание мочи, «вялую» струю мочи. Реже возникали нарушения со стороны прямой кишки. Отсутствие нарушений функции соседних органов было только у 18% (17/98) пациенток.
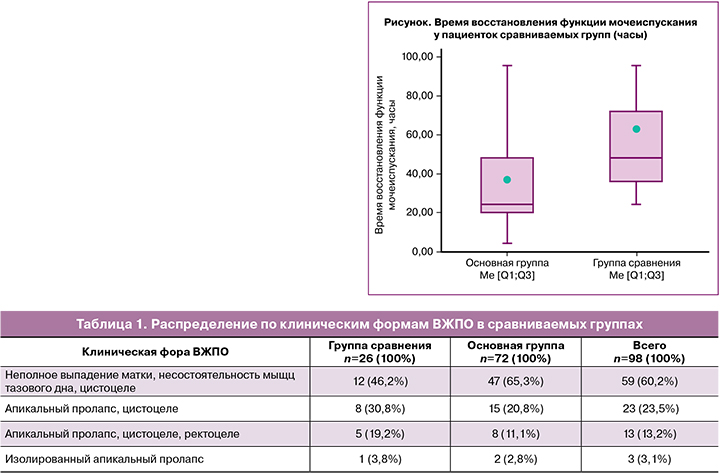
Длительность двух этапов операции составила 110 (13) минут. Дополнительным фактором увеличения продолжительности вмешательства стало проведение у трети пациенток субтотальной гистерэктомии (по показаниям). Средний объем кровопотери на первом этапе составил 88 (34) мл, что в 1,5 раза меньше, чем в группе сравнения - 131 (55) мл (p<0,001). На втором этапе объем кровопотери составил 106 (44) мл, что оказалось выше, чем в группе сравнения (p=0,02) в среднем на 38 мл. Однако это не сказалось на состоянии больных и не вызвало развитие осложнений в послеоперационном периоде. В основной группе необходимость назначения лекарственных средств с целью восстановления функции мочеиспускания потребовалась 3/72 (4%) пациенткам в отличие от группы сравнения, в которой стимуляция работы кишечника проводилась всем пациенткам (х2=75; р<0,001; ОР=17; 95% ДИ 6,6-45,0). Время восстановления функции мочеиспускания составило 24 [20;48] ч в основной группе против 48 [36;72] ч в группе сравнения (р<0,001) (рисунок).
В основной группе энтеральное питание в виде готового перорального стерильного гиперкалорического раствора с высоким содержанием белка и пищевых волокон вводилось с 1-х суток послео-перационного периода; при этом в группе сравнения прием пищи, преимущественно жидкой, разрешался на 3-и сутки после операции. Назначение очистительной клизмы в послеоперационном периоде в группе сравнения потребовалось более половине пациенток 15/26 (57,7%) и абсолютно не требовалось в основной группе (х2=49; р<0,001). Потребность в назначении НПВС в обеих группах была одинаковой. Аналгетические препараты назначались 3 раза в сутки, продолжительность терапии аналгетиками в послеоперационном периоде в основной и в группе сравнения не отличалась (р=0,94). Проведение антибиотикотерапии потребовалось лишь 14/72 (19,4%) прооперированным женщинам основной группы, в то время как в группе сравнения антибиотикотерапия была назначена 18/26 (69,2%) пациенткам (х2=21,5; р<0,001; ОР=3,5; 95% ДИ 2,0-6,0).
Интраоперационные осложнения в обеих группах отсутствовали. Из ранних послеоперационных осложнений в основной группе отмечено 2/72 (2,8%) случая формирования гематомы культи шейки матки, у 3/72 (4,2%) прооперированных — нарушение функции мочеиспускания в виде задержки мочи в 1-е сутки после операции с последующим восстановлением на 2—3-и сутки. В группе сравнения нарушения функции мочеиспускания были выявлены у 10/26 (38,5%) пациенток (х2=14,6; р <0,001; ОР=5,5; 95% ДИ 2,0-14,6). Длительность послеоперационного койко-дня в основной группе была достоверно короче, чем в группе сравнения - 7,7 (1,7) против 8,8 (2,0) (р=0,02).
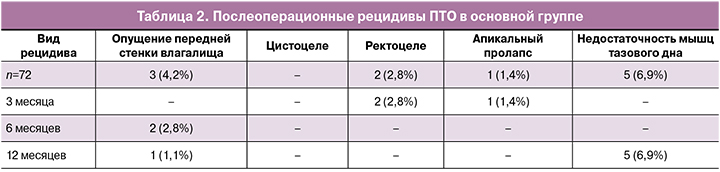
Согласно опроснику ПТО-КЖ, через 3 месяца после операции 69/72 (96%) пациенток основной группы были удовлетворены качеством жизни, причем эффект удовлетворенности проведенным лечением сохранялся у 67/72 (93%) прооперированных женщин и через 12 месяцев. Лишь в 3/72 случаях (4,1%) было отмечено опущение передней стенки влагалища до уровня нижней трети (POP-Q 0-I) с сохранением фиксации мочевого пузыря и шейки матки (табл. 2). Недостаточная состоятельность мышц тазового дна (зияние половой щели) без формирования ректоцеле была выявлена у 5/98 (7%) пациенток. В основной группе произошло 3/54 (5,5%) случая рецидива пролапса: в 2 случаях рецидив заднего пролапса с формированием рек- тоцеле (POP-Q I) и в 1 случае - рецидив апикального пролапса (POP-Q I) в результате отрыва сетки от шейки матки во время чрезмерной физической нагрузки через 2 месяца после операции. В последнем случае проведено повторное хирургическое лечение с фиксацией сетчатого импланта к шейке матки.
Случаев диспареунии de novo не выявлено.
Внедрение протокола ускоренного выздоровления оказало положительное влияние на течение послеоперационного периода в виде быстрого вос-становления функции мочевого пузыря, кишечника и снижения количества ранних послеоперационных осложнений в 3,3 раза. Активное состояние женщин на госпитальном этапе в послеоперационном периоде обусловило быстрое восстановление жизненно важных функций: дыхания, кровообращения, мочеиспускания. Это способствовало активизации репаративных процессов, что вдвое уменьшило время пребывания пациенток в стационаре и сократило финансовые затраты на проведение лечения в среднем на 10 593 руб. Более того, у пациенток основной группы выявлено уменьшение количества рецидивов ВЖПО в 1,7 раза, по сравнению с данными других исследователей [2, 7].
Разработка и внедрение протоколов ускоренного выздоровления в гинекологии актуальны не только для малоинвазивной гинекологической хирургии, но и для операций, выполняемых лапаротомным и влагалищным доступом, так как его применение позволяет улучшить результаты лечения пациентов, оптимизировать пребывание в больнице и снизить системные затраты [23, 26, 29].
Заключение
Таким образом, программа ускоренного выздо-ровления вполне допустима и даже целесообразна у пациенток с тяжелыми формами генитального пролапса. Внедрение в клиническую практику данного протокола позволяет снизить количество послеоперационных осложнений, уменьшить время пребывания пациентки в стационаре и объем затра-чиваемых материальных ресурсов, снизить финан-совые затраты на проведение лечения, а также уменьшить число рецидивов ВЖПО. Преимущества предложенной технологии заключаются в снижении частоты осложнений, повышении качества жизни пациенток, экономии материальных затрат и не зависят от техники выполнения операции.



