В последние годы в Российской Федерации отмечается неуклонное снижение показателя младенческой смертности. Врожденные пороки развития (ВПР) занимают второе место среди причин младенческой смертности. Благодаря улучшению качества пренатальной диагностики ВПР и совершенствованию методов неонатальной хирургии частота смерти детей от пороков развития на первом году жизни сократилась с 1,9 на 1000 живорожденных в 2012 году до 1,3 на 1000 в 2016 году. Вместе с тем, коэффициент младенческой смертности и показатель смертности от ВПР в нашей стране пока остается в 1,5–2 раза выше, чем в большинстве стран Западной Европы и Японии [1]. До 35% летальных случаев в раннем детском возрасте обусловлены ВПР, в том числе хирургического профиля [1, 2].
Одним из основных направлений современной хирургии новорожденных является широкое использование адаптированных к раннему возрасту методов визуализации и внедрение в клиническую практику эндоскопических способов коррекции ВПР. Миниинвазивная хирургическая техника операций у новорожденных детей реализуется с использованием специального оборудования, включающего телевидение высокой четкости, оптические системы малого диаметра, миниатюрные инструменты и средства их доставки в организм пациента [3]. Несмотря на то, что эндоскопические операции прочно вошли в практику детских хирургов, анатомические особенности новорожденного ребенка определяют некоторые ограничения и трудности: объемы полостей крайне малы, а установка инструментальных портов требует особой тщательности выбора положения для обеспечения наилучшего доступа к зоне интереса без ограничения движений. Кровотечения в зоне хирургического вмешательства значительно уменьшают степень освещенности, ограничивают обзор и затрудняют манипуляции, в работе необходим тщательный гемостаз и четкое представление о локализации питающих орган сосудов. Эти факторы обусловливают потребность неонатальных хирургов в разработке инновационных подходов к интраоперационной навигации для уменьшения риска осложнений путем определения зоны безопасного хирургического вмешательства.
Современные методы обработки визуальной информации, возможности компьютерной графики и 3D-моделирования являются основанием для решения технической задачи автоматизированного сопровождения работы хирурга в естественной среде и условиях дополненной реальности. Одним из направлений технического решения задачи подготовки хирурга к оперативному вмешательству является создание трехмерных визуальных и материальных образов на основании полученной в ходе предоперационного обследования информации [4]. Система хирургической навигации (CAS технология – Computer Assisted Surgery) – это оперативное вмешательство, при проведении которого компьютер используется в качестве направляющего и контролирующего инструмента. Эти подходы позволяют снизить операционную травму за счет более точных действий хирурга в процессе операции, что в целом повышает уровень безопасности пациента, снижает риск интраоперационных осложнений и сокращает период реабилитации [5, 6].
Современные технологии предлагают ряд возможностей в помощи клиницисту для точного выполнения хирургических манипуляций. Некоторые решения представлены на рынке в виде готовых и апробированных в клинической практике аппаратно-программных комплексов, другие являются частными разработками групп специалистов и применяются ими в экспериментальных и клинических исследованиях.
Наибольшее распространение на рынке технического обеспечения интраоперационной навигации получили системы стереотаксического слежения за инструментом. В основе метода лежит безрамное создание электромагнитного поля, в которое помещается часть тела пациента с регистрацией в системе анатомических ориентиров путем установки специальных реперных датчиков или сканирования поверхности кожи для распознавания компьютером. Предоперационные изображения патологического очага в тканях и органах «совмещаются» на экране с изображением пациента. Активный инструмент, снабженный системой слежения, позиционируется на теле в заданной системе координат, тем самым возможна коррекция его перемещения в соответствии с хирургической задачей [6, 7].
Нейрохирургия стала пионером по внедрению и успешному применению навигации в повседневной клинической практике. С ее помощью проводят биопсии и резекции интракраниальных опухолей, деструкцию патологических очагов, эвакуацию гематом при нейротравме, установку внутрижелудочковых шунтов, электродов, электростимуляции и другие манипуляции [6, 8, 9].
В ортопедии и травматологии среди взрослых пациентов в сферах реконструктивной хирургии позвоночника, пластики суставов, костной онкологии и при репозиции сложных многооскольчатых переломов костей применение стереотаксических систем навигации с предварительной программной оценкой наилучшей траектории введения металлических элементов и последующей реализацией хирургом под контролем интраоперационных методик визуализации значительно снижает количество хирургических осложнений [10–21].
 Анализ диагностической визуальной информации с предоперационным 3D-моделированием и вариабельной интраоперационной навигацией разработаны для ряда областей абдоминальной эндоскопической хирургии. По результатам обследования и формирования трехмерного изображения надпочечника с опухолью проводили математический расчет оптимального положения троакаров с последующим наложением трехмерной модели на нативную картину у взрослых пациентов [22]. Анализ строения сосудистого русла и интраоперационное совмещение объемной модели с нативной картиной позволяет определить питающие опухоль сосуды и выполнить точную ее резекцию в пределах здоровых тканей [23], выполнить удаление ряда мягкотканных опухолей и провести спленэктомии эндоскопическим доступом у детей [24, 25].
Анализ диагностической визуальной информации с предоперационным 3D-моделированием и вариабельной интраоперационной навигацией разработаны для ряда областей абдоминальной эндоскопической хирургии. По результатам обследования и формирования трехмерного изображения надпочечника с опухолью проводили математический расчет оптимального положения троакаров с последующим наложением трехмерной модели на нативную картину у взрослых пациентов [22]. Анализ строения сосудистого русла и интраоперационное совмещение объемной модели с нативной картиной позволяет определить питающие опухоль сосуды и выполнить точную ее резекцию в пределах здоровых тканей [23], выполнить удаление ряда мягкотканных опухолей и провести спленэктомии эндоскопическим доступом у детей [24, 25].
В торакальной хирургии симуляционное предоперационное планирование хода эндоскопической сегментэктомии легких у взрослых выполняли на трехмерной визуальной модели области объемного образования (опухоли) с целью верификации сосудистых и бронхиальных структур, с последующим совмещением реконструкции с операционным полем на экране [26].
По результатам анализа стереотаксических навигационных систем мы пришли к выводу, что представленные комплексы разработаны и применяются в строго ограниченных сферах современной хирургии, имеют узкую специфичность, их функции полностью отвечают требованиям целевой области, обеспечивая оптимизацию лечебного процесса и улучшение результатов. Способы предоперационной компьютерной обработки изображений с формированием виртуальной объемной модели с последующей отработкой хирургической техники на этапе планирования операции не апробированы в детской хирургии, но представляются перспективными для применения среди пациентов неонатального периода с ВПР внутренних органов. Эта группа методов выглядит наиболее привлекательной в силу того, что они учитывают индивидуальные особенности пациента, выделяют зоны повышенной опасности, позволяют оценить особенности кровоснабжения органов и учесть их во время операции.
Цель исследования: провести анализ собственного опыта наблюдения и хирургического лечения новорожденных с пороками развития, выявить группы заболеваний, в коррекции которых необходимо применение интраоперационной навигации.
Материал и методы исследования
На базе ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России (далее – Центр) с января 2010 по декабрь 2016 года наблюдали 1354 новорожденных пациента с пороками развития, выполнен ретроспективный анализ медицинской документации.
Предварительный диагноз ВПР был установлен на различных сроках гестации во всех случаях и подтвержден на пренатальном консилиуме профильных специалистов Центра. После рождения дети были госпитализированы в отделение хирургии новорожденных, им проводили общеклинические и лабораторные исследования в течение периода ранней адаптации. Выбор инструментальных методов диагностики был обусловлен характером порока и тяжестью состояния пациента и включал: ультразвуковые исследования (УЗИ), рентгенографию органов грудной клетки и брюшной полости, в том числе с контрастированием желудочно-кишечного тракта, магнитно-резонансную (МРТ) и мультиспиральную компьютерную томографию (МСКТ), в том числе с внутривенным болюсным контрастированием разрешенными у новорожденных препаратами гадотеровой кислоты и йопромида соответственно. УЗИ выполняли на аппарате SIEMENS ACUSON S2000 (Германия – США) с использованием линейных датчиков 7–14 МГц и 18–20 МГц, МРТ проводили на томографе GE Signa 1.5T (США) с использованием Т1ВИ и Т2ВИ режимов, МСКТ – на аппарате Toshiba Aquilion Prime (Япония) с программой низкодозового объемного сканирования. Показания к хирургическому лечению и его объем были определены по результатам обследования и с учетом тяжести состояния ребенка.
Результаты исследования и обсуждение
На базе ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России с января 2010 по декабрь 2016 года провели обследование и лечение 1354 пациентов с ВПР. Распределение пациентов по группам пороков и динамика ежегодных поступлений представлены в таблице. Дети с ВПР мочевых путей лидируют в структуре заболеваний (31%), с ними конкурируют мышечные дефекты (26%) и пороки желудочно-кишечного тракта (21%), а объемные образования и пороки легких встречаются реже (13 и 9% соответственно). В целом следует отметить рост количества пациентов с ВПР, требующими хирургической помощи.
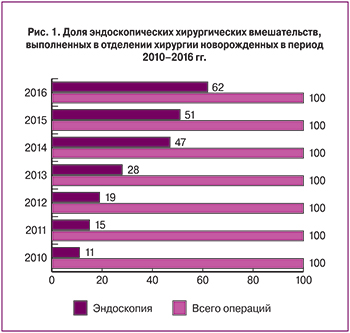
Ранние эффективные хирургические вмешательства у новорожденных стали возможны недавно и опыт по их выполнению имеют единичные клиники, как в России, так и за рубежом [1, 2]. За исследуемый период количество производимых ежегодно операций по коррекции ВПР неуклонно растет (в 2010 году выполнено 118 операций, а в 2016 – 210), а применение эндоскопических доступов в хирургии новорожденных является одним из приоритетных направлений нашей работы (рис. 1).
Пороки развития мочевой системы в популяции встречаются по данным литературы у 40–50 детей на каждую 1000 новорожденных. Обструктивные уропатии относятся к наиболее часто диагностируемым порокам мочевой системы, они составляют более 50% всех пренатально выявленных аномалий почек [1, 27]. Основными стратегическими задачами наблюдения и обследования пациентов с обструкцией мочевыводящих путей являются определение уровня и характера препятствия, степени развития нефросклеротических процессов и почечной недостаточности, а также профилактика реализации мочевой инфекции. Стандартные рентгенологические методы обследования патологии почек и урогенитального тракта имеют ряд ограничений для применения в раннем неонатальном периоде вследствие лучевой нагрузки, необходимости внутривенного использования йодсодержащих контрастных препаратов и низкой информативности. Информативность МСКТ выше, возможна объемная реконструкция полученных результатов, однако исследование сопряжено с повышенной лучевой нагрузкой. Поэтому применение МРТ в сочетании с УЗИ являются предпочтительными для топической и функциональной диагностики порока в периоде новорожденности, так как эти методы исследования не связаны с лучевой нагрузкой и введения контрастного препарата не требуется.
Стойкая обструкция пиело-уретерального сегмента мочеточника при гидронефрозе приводит к расширению чашечно-лоханочной системы с атрофией паренхимы и постепенной потерей функции почки. Ранняя хирургическая коррекция приводит к восстановлению пассажа мочи и предотвращению явлений нефросклероза и хронической почечной недостаточности. За исследованный период выполнено 50 операций пластики пиело-уретерального сегмента при гидронефрозе, 11 из них – эндоскопическим доступом. По нашему опыту, главным преимуществом миниинвазивного вмешательства является исключение обязательного для традиционной операции этапа выделения почки и лоханки из паранефральной клетчатки с целью выведения в рану пиело-уретерального сегмента. В то же время, поиск суженного участка, расположенного в забрюшинном пространстве и «скрытого» за петлями кишечника, при лапароскопии нередко вызывает затруднение.
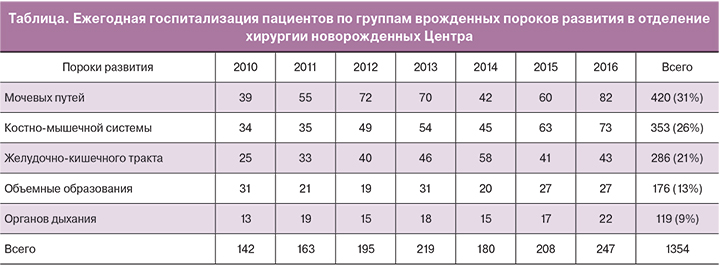
Удвоение почки с аномальным впадением одного из мочеточников в мочевой пузырь в ряде случаев сопровождается дистальной обструкцией с расширением коллекторной системы и мочеточника соответствующего сегмента почки. Паренхима сегмента почки страдает вплоть до полной потери ее функции. В случае доказанной органической обструкции единственным методом лечения является хирургическая коррекция: при сохраненной функции сегмента выполняли изолированную неоимплантацию пораженного мочеточника – 3 операции, при потере функции сегмента – геминефруретерэктомию – 15 операций, в том числе 3 – лапароскопическим доступом. Анализ интраоперационной картины показал, что при первичном эндоскопическом осмотре забрюшинного пространства удвоение мочеточников представлено конгломератом извитых структур, а нефункционирующий сегмент почки «прячется» глубоко в поддиафрагмальной зоне забрюшинного пространства и недоступен осмотру (рис. 2). При этом этап разделения тесно прилежащих друг к другу удвоенных мочеточников чрезвычайно важен для исключения травмы здорового, а выявление границы нефункционирующего сегмента и исключительно его питающих сосудов является залогом сохранения кровоснабжения паренхимы функционирующей части почки.
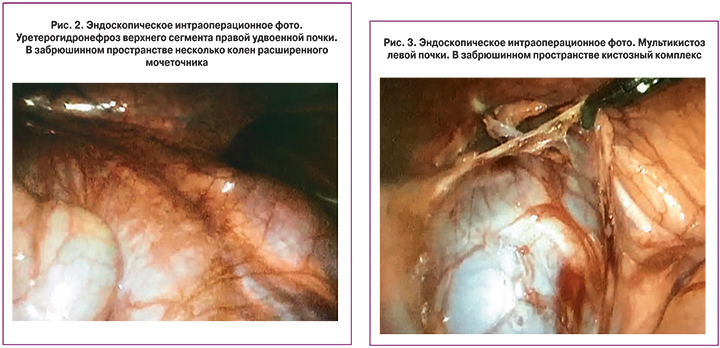
Мультикистозная почка представлена конгломератом кистозных полостей различного диаметра, заполненных первичной мочой, с участками склерозированной паренхимы или без них вследствие критического нарушения оттока мочи в периоде раннего органогенеза с потерей функции органа еще на этапе внутриутробного развития. Показанием к нефрэктомии в периоде новорожденности являются ее размеры (превышающие размеры здоровой почки), наличие кист более 30 мм диаметром и клинические признаки нарушения функции соседних органов – выполнено 58 операций, более половины из них (n=38) – эндоскопическим способом. Пораженная почка при первичном лапароскопическом осмотре представлена конгломератом кист, нередко смещающим прилежащие органы (рис. 3).
Анализ характера выполненных нами эндоскопических операций при ВПР мочевых путей показал, что применение навигационной системы при работе на органах забрюшинного пространства у новорожденных возможно благодаря относительной фиксации их под листком брюшины и сохранению анатомических пропорций даже в условиях наложения пневмоперитонеума. Система навигации ускорит поиск суженного пиело-уретерального сегмента при гидронефрозе и укажет кратчайший путь к нему, поможет определиться с принадлежностью мочеточников больному либо здоровому сегментам почки, количеством и расположением питающих сосудов, что в целом позволит сократить продолжительность операции и риск осложнений.
Врожденные объемные образования нередко встречаются в практике неонатальной хирургии. В крестцово-копчиковой области почти преимущественно наблюдаются тератомы; в забрюшинном пространстве – нейробластома и кисты надпочечника, которые зачастую трудно дифференцировать между собой; лимфангиомы и гемангиомы, а также фиброзные их варианты, кисты различного происхождения могут располагаться в любой анатомической области. Оптимальными методами обследования новорожденных являются УЗИ и МРТ, в связи с хорошей визуализацией мягкотканных и жидкостных структур в нативном режиме и особенностей кровоснабжения образований в режимах УЗ-допплера и МР-ангиографии. Технические сложности сопровождают оперативные вмешательства при локализации образований в сложных анатомических областях – в забрюшинном пространстве, ретроректально, под куполом диафрагмы. Наш хирургический опыт удаления образований у новорожденных включает: 42 тератомы крестцово-копчиковой области, среди них в 3 наблюдениях – с эндоскопической мобилизацией внутрибрюшного компонента; 9 операций удаления нейробластомы надпочечника, из них 2 лапароскопии; 11 лимфангиом; 6 фиброзных гемангиом; в двух случаях крупных образований грудной полости (кистозная лимфангиома и тератома средостения) операцию удалось выполнить при помощи эндовидеотехники. Полученный опыт позволил установить, что наибольшие технические сложности сопровождают этапы выделения образования из окружающих тканей и обработки сосудистой «ножки» при как традиционных, так и эндоскопических операциях. Как правило, прямой доступ к коротким питающим сосудам отсутствует, что особенно актуально при выделении образования из забрюшинного пространства. Наиболее удобным и безопасным доступом к забрюшинным поддиафрагмальным образованиям является торакоскопическое вмешательство с рассечением купола диафрагмы. Однако размер разреза диафрагмы ограничен в силу необходимости сохранения ее иннервации для предотвращения послеоперационной травматической релаксации купола; работа в поддиафрагмальном пространстве производится через небольшое «окно» и сопровождается повышенным риском повреждения сосудов и прилежащих органов.
Выделение крестцово-копчиковой тератомы из малого таза опасно развитием кровотечений вследствие богатого кровоснабжения, выделение опухоли из окружающих здоровых тканей должно быть очень бережным в связи со сложной иннервацией этой зоны, повреждение которой чревато серьезными функциональными расстройствами – развитием различных форм нейрогенного мочевого пузыря, хронических запоров или недержания кала.
Интраоперационная навигация абсолютно необходима при работе в области малого таза, центральных и поддиафрагмальных отделах забрюшинного пространства, именно она позволит с большей безопасностью выполнять манипуляции в этих сложных анатомических областях. Поиск и обработка сосудистых элементов могут быть выполнены со сниженным риском кровотечения, а работа в «безопасных» бессосудистых зонах потребует меньших затрат времени.
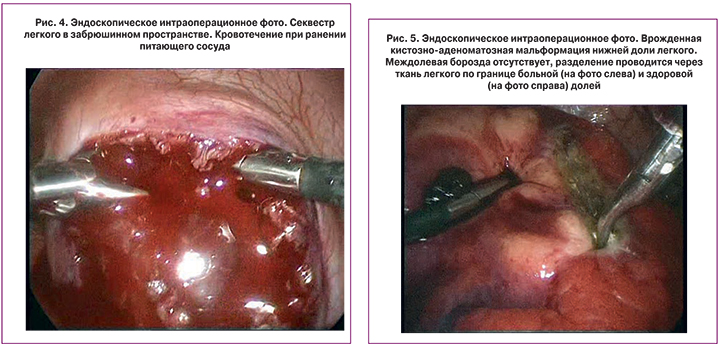
Бронхолегочная секвестрация и кистозно-аденоматозная мальформация легкого относятся к редким ВПР, для которых характерно аномальное кистозное строение части легкого, что сопровождается высоким риском инфекционных осложнений. При обследовании пациентов в качестве скринингового метода исследования в Центре применяется обзорная рентгенография и УЗИ плевральных полостей, для дальнейшей диагностики в большинстве случаев предпочтение отдаем МСКТ для лучшей оценки структуры ткани легкого с внутривенным контрастированием для реконструкции сосудистой сети и обнаружения аномального питающего сосуда из бассейна аорты, который является отличительным признаком секвестрации легкого. Нами выполнено 47 операций лобэктомии по поводу врожденной кистозно-аденоматозной мальформации и 49 операций при секвестрации легкого, торакоскопическим путем – 32 и 40 соответственно. Хирургические интраоперационные наблюдения показали, что удаление секвестров легкого сопряжено с ответственным этапом поиска и обработки одного или нескольких аномальных сосудов, по диаметру не уступающих артериям почек и селезенки. Неосторожная мобилизация и неправильная перевязка чреваты массивными кровотечениями из магистрального сосуда организма, которое сложно купировать при традиционном оперативном вмешательстве, а при эндоскопическом – практически невозможно. Аналогичные технические трудности при забрюшинном расположении секвестра легкого усугубляются суженным обзором за счет чрездиафрагмальной работы в ограниченном ретроперитонеальном пространстве, а кровотечения значительно усложняют ход оперативного вмешательства (рис. 4). В лечении врожденной кистозно-аденоматозной мальформации рекомендованным и признанным объемом хирургической помощи является лобэктомия пораженной доли [1, 3, 28]. Как правило, доступ к сосудистым и бронхиальным элементам корня доли легкого осуществляется по междолевой борозде, однако в части случаев эта борозда не выражена, либо отсутствует совсем (рис. 5), что в комбинации с аномальным рассыпным типом кровоснабжения порочной части легкого составляет трудности хирургической коррекции порока.
Интраоперационная навигация на этапе поиска аномального сосуда секвестра легкого позволит упростить и ускорить процесс его обработки и значительно снизить риск осложнений, а при выполнении лобэктомии она существенно сократит время разделения здоровых и патологических участков ткани легкого и облегчит поиск и обработку элементов корня пораженной доли легкого, особенно в нетипичных анатомических случаях.
Заключение
Таким образом, среди множества ВПР, подлежащих хирургической коррекции в неонатальном периоде, предоперационное объемное моделирование зоны патологического очага и интраоперационный навигационный комплекс для эффективных и безопасных хирургических манипуляций наиболее востребованы в области хирургии врожденных пороков развития легкого, при удалении объемных образований различной локализации и в реконструктивных операциях различных вариантов аномалий почек. Применение предоперационной обработки изображений с учетом особенностей кровоснабжения здоровых и патологических зон и созданием объемных моделей улучшит пространственное ориентирование хирурга в полостях, позволит уточнить зоны тесного контакта патологического образования со здоровыми тканями и локусы расположения крупных сосудистых элементов.
Благодарность
Авторы статьи благодарны Министерству науки и образования РФ за финансовую поддержку по Соглашению о предоставлении субсидии от 03.10.2016 г. №14.607.21.0162, заключенным в рамках федеральной целевой программы «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014 – 2020 годы» по теме: «Разработка прототипа аппаратно-программного комплекса хирургической навигации для поддержки планирования, выполнения и контроля результатов оперативных вмешательств в неонатальном периоде».



