Одним из наиболее важных факторов, необходимых для успешного наступления беременности, является наличие функционально активного эндометрия адекватной толщины и рецептивности в период «окна имплантации». Согласно данным литературы, толщина эндометрия 7 мм и менее во вторую фазу менструального цикла ассоциирована со снижением частоты наступления беременности и развитием ее неблагоприятных исходов в циклах овариальной стимуляции и в программах экстракорпорального оплодотворения (ЭКО) [1–3]. Кроме того, у пациенток с «тонким» эндометрием в анамнезе часто наблюдается отмена переноса эмбрионов (ПЭ) в полость матки в криоциклах в связи с отсутствием роста эндометрия на фоне проводимой гормональной терапии. Необходимо отметить, что стандартная терапия эстрогенами и препаратами, улучшающими кровообращение, неэффективна у части пациенток, и единственной возможностью для них реализовать свою репродуктивную функцию становится суррогатное материнство. Однако, данный метод требует значительных финансовых затрат и не представляется приемлемым для большинства женщин в связи морально-этическими аспектами. Таким образом, исследования, посвященные поиску и разработке новых методов лечения пациенток с бесплодием на фоне «тонкого» эндометрия, рефрактерного к стандартной терапии, представляют собой особый интерес для специалистов в области репродуктивной медицины.
На сегодняшний день одним из перспективных методов лечения пациенток с маточным фактором бесплодия является инфузия в полость матки аутологичной плазмы, обогащенной тромбоцитами (Platelet Rich Plasma (PRP)) [4–6]. Аутологичную PRP получают из цельной крови пациентки путем двойного центрифугирования, отделения эритроцитов и лейкоцитов и получения повышенной концентрации тромбоцитов в плазме [7]. Терапевтический эффект применения аутологичной PRP основан на высвобождении значительного количества факторов роста (тромбоцитарный фактор роста (PDGF), фактор роста эндотелия сосудов (VEGF), эпидермальный фактор роста (EGF), фактор роста фибробластов (FGF), трансформирующий фактор роста (TGF-β), инсулиноподобный фактор роста (IGF-1), фактор роста гепатоцитов (HGF) и др.), цито- и хемокинов из гранул тромбоцитов при их разрушении, что запускает механизмы биологического синтеза в тканях [8]. Было показано, что использование аутологичной PRP стимулирует процессы клеточной пролиферации и регенерации, а также способствует ангиогенезу [9]. Согласно данным Chang Y. et al. (2019 г.), внутриматочные инфузии аутологичной PRP пациенткам с «тонким» эндометрием перед ПЭ в полость матки привели к статистически значимому увеличению толщины эндометрия, частоты имплантации и наступления клинической беременности по сравнению с пациентками, получавшими только гормональную терапию [10].
Мы предположили, что инъекционное введение аутологичной PRP в эндометрий пациенток сможет существенно повысить эффективность данного способа лечения. В современной литературе мы не встретили публикаций, авторы которых применяли бы инъекционное введение аутологичной PRP в эндометрий женщины. С целью усовершенствования метода и обеспечения возможности таргетного воздействия факторов роста в ткани на кафедре акушерства, гинекологии, перинатологии и репродуктологии ИПО ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России нами был разработан способ лечения женщин с бесплодием на фоне «тонкого» эндометрия путем введения аутологичной PRP при помощи эндоскопической иглы непосредственно в эндометрий под контролем гистероскопии.
Целью данного пилотного исследования является оценка эффективности и безопасности применения инъекционного введения аутологичной PRP пациенткам с «тонким» эндометрием, рефрактерным к другим методам лечения.
Материалы и методы
В проспективное исследование были включены 42 пациентки, обратившиеся для лечения бесплодия на фоне «тонкого» эндометрия (толщина эндометрия 7 мм и менее в период «окна имплантации») в период с октября 2018 г. по декабрь 2019 г. и подписавшие информированное согласие на участие в исследовании. Дизайн исследования был рассмотрен и одобрен комиссией по этике ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России и ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России.
Критерии включения: возраст от 18 до 38 лет, нормальный кариотип пациентки и ее партнера, регулярный овуляторный менструальный цикл, толщина эндометрия 7 мм и менее в период предполагаемого «окна имплантации». Критерии невключения в исследование: выраженная патоспермия у партнера, использование донорских гамет, преждевременная недостаточность яичников, аномалии развития внутренних половых органов, системные заболевания крови и коагулопатии, уровень гемоглобина менее 100 г/л, уровень тромбоцитов менее 100×109/л, аномалии и дисфункции тромбоцитов, антиагрегантная и антикоагулянтная терапия на момент включения в исследование.
Пациенткам, включенным в исследование, было проведено полное клинико-лабораторное обследование. В период предполагаемого «окна имплантации» было выполнено ультразвуковое исследование (УЗИ) органов малого таза трансвагинальным датчиком для оценки толщины и структуры эндометрия, допплерометрическое исследование гемодинамики в маточных сосудах, а также аспирационная пайпель-биопсия эндометрия для дальнейшей оценки его рецептивности. Овуляция в данном цикле подтверждалась при помощи тестов, чувствительных к пику лютеинизирующего гормона (ЛГ) в моче и во время проведения УЗИ.
На 5–7-й день менструального цикла пациенткам, включенным в исследование, проводился забор цельной крови объемом 400 (50) мл в отделении трансфузионной иммунологии и заготовки компонентов крови ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России для заготовки аутологичной PRP.
Перед сдачей крови пациентки с результатами анализов крови на RW, ВИЧ, гепатиты В и С, группу крови и резус-фактор, клинического и биохимического анализа крови, гемостазиограммы были проконсультированы трансфузиологом. При отсутствии противопоказаний пациентки допускались к сдаче крови. Приготовление аутологичной PRP включало следующие этапы: 1) забор крови в объеме 400 (50) мл в строенный полимерный контейнер «Гемакон 500/300» с антикоагулянтом СPDA-63 ml; 2) центрифугирование контейнера с кровью в рефрижераторной центрифуге Becman в течение 8 минут в режиме 1971g при температуре +22˚С; 3) после центрифугирования с помощью плазмоэкстрактора плазма и тромбоциты (верхний и средний слой) перемещались во второй контейнер. Контейнер с аутоэритроцитами отсоединялся, и они реинфузировались пациентке; 4) повторное центрифугирование второго контейнера с плазмой и тромбоцитами в течение 10 минут с центробежным ускорением 5130g при температуре +22˚С; 5) с помощью плазмоэкстрактора в третий контейнер удалялся верхний слой – это нативная плазма, а нижний слой – концентрированные тромбоциты, взвешенные в плазме, перемещались в специальный контейнер для хранения тромбоцитов LmB Technologie GmbH (производство Германия), где она может храниться в течение 5 суток при температуре +22–24˚С.
При соблюдении описанной методики из 400 (50) мл цельной крови в результате двухэтапного центрифугирования получали 40 (5) мл аутологичной PRP (тромбоконцентрат) с содержанием 0,6–0,7×1011 тромбоцитов в ней. Контейнер маркировался и выдавался по требованию в день проведения процедуры.
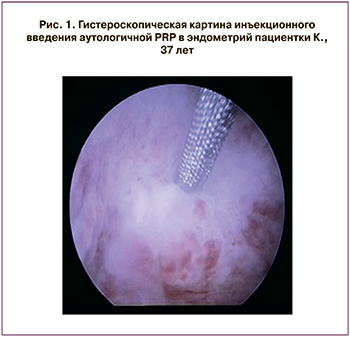 На следующий день после сдачи крови и получения PRP (6–8 день менструального цикла) пациенток госпитализировали в дневной стационар. После подписания информированного согласия на медицинское вмешательство и добровольное участие в исследовании пациенткам в условиях малой операционной под внутривенной анестезией проводилось инъекционное введение 40 (5) мл аутологичной PRP в наиболее атрофичные участки эндометрия с помощью эндоскопической иглы «МИТ» (производство Россия) диаметром 0,6/1,16 мм на глубину 2–3 мм под контролем гистероскопа (рисунок). Длительность вмешательства составляла в среднем 15–20 минут. За одну процедуру производилось в среднем 6–8 вколов иглы с введением аутологичной PRP в наиболее измененные участки эндометриальной ткани. Помимо инъекционного введения в эндометрий проводилось орошение полости матки 2–3 мл аутологичной PRP. После операции наблюдение за пациенткой проводилось в течение 4 часов в палате дневного стационара. При удовлетворительном состоянии пациентка выписывалась домой в тот же день с рекомендациями об использовании барьерной контрацепции в течение данного менструального цикла. Нами не было зафиксировано ни одного случая развития аллергических реакций или инфекционных осложнений после проведенного вмешательства. ПЭ в полость матки в данном менструальном цикле не проводился.
На следующий день после сдачи крови и получения PRP (6–8 день менструального цикла) пациенток госпитализировали в дневной стационар. После подписания информированного согласия на медицинское вмешательство и добровольное участие в исследовании пациенткам в условиях малой операционной под внутривенной анестезией проводилось инъекционное введение 40 (5) мл аутологичной PRP в наиболее атрофичные участки эндометрия с помощью эндоскопической иглы «МИТ» (производство Россия) диаметром 0,6/1,16 мм на глубину 2–3 мм под контролем гистероскопа (рисунок). Длительность вмешательства составляла в среднем 15–20 минут. За одну процедуру производилось в среднем 6–8 вколов иглы с введением аутологичной PRP в наиболее измененные участки эндометриальной ткани. Помимо инъекционного введения в эндометрий проводилось орошение полости матки 2–3 мл аутологичной PRP. После операции наблюдение за пациенткой проводилось в течение 4 часов в палате дневного стационара. При удовлетворительном состоянии пациентка выписывалась домой в тот же день с рекомендациями об использовании барьерной контрацепции в течение данного менструального цикла. Нами не было зафиксировано ни одного случая развития аллергических реакций или инфекционных осложнений после проведенного вмешательства. ПЭ в полость матки в данном менструальном цикле не проводился.
В новом менструальном цикле пациентка получала гормональную терапию эстрогенами, начиная с 3–4 дня. Препараты эстрогенов пациенткам назначались в виде таблеток эстрадиола валерата для перорального применения и геля 0,1% 17-β эстрадиола для трансдермального применения. Стартовая доза составила 4 мг эстрадиола валерата в сутки с дальнейшей корректировкой в соответствии с динамикой роста эндометрия. Максимальная суточная дозировка препаратов эстрогенов составила 12 мг. В середину лютеиновой фазы цикла пациенткам проводилось контрольное УЗИ органов малого таза и допплерометрическое исследование маточных сосудов для оценки толщины и структуры эндометрия, показателей маточной гемодинамики после проведенного вмешательства. С целью повышения качества полученных данных УЗИ всем пациенткам выполнялось одним врачом-экспертом до и после проведения вмешательства.
При достижении оптимальных значений толщины эндометрия производился перенос одного размороженного эмбриона хорошего качества на стадии бластоцисты в полость матки и назначалась посттрансферная поддержка в виде 600 мг в сутки микронизированного прогестерона интравагинально до получения результатов уровня β-хорионического гонадотропина в сыворотке крови. Качество эмбрионов оценивалось в соответствии с морфологическими критериями согласно классификации D. Gardner [11]. Перед включением в программу вспомогательных репродуктивных технологий (ВРТ) все пациентки были обследованы согласно Приказу Минздрава России №107н от 30.08.2012 «О порядке использования ВРТ, противопоказаниях и показаниях к их применению» [12].
Наступление биохимической беременности подтверждалось при повышении значения уровня β-хорионического гонадотропина в сыворотке крови через 14 дней, а клинической – при визуализации плодного яйца в полости матки при УЗИ через 3 недели после ПЭ в полость матки.
Подана заявка на получение патента «Способ лечения «тонкого» эндометрия у женщин репродуктивного возраста при помощи аутологичной плазмы, обогащенной тромбоцитами» № 2020104583 от 01.02.2020 г.
Cтатистический анализ проводили с применением пакета программ Statistica 10 (США). Все полученные количественные параметры были проверены на соответствие нормальному распределению с помощью критерия Колмогорова–Смирнова. В соответствии с полученными выводами сравнение количественных показателей осуществлялось с помощью t-критерия Стьюдента для 2 независимых выборок или непараметрического критерия Манна–Уитни. Для определения различий в числовых показателях, изменявшихся в ходе лечения, применяли парный критерий Стьюдента для 2 зависимых выборок, при отсутствии нормального распределения использовали непараметрический метод – Т-критерий Вилкоксона.
Числовые параметры, имеющие нормальное распределение, представлены в формате М (SD), где М – среднее значение, SD – стандартное отклонение среднего значения. Параметры, имеющие распределение, отличное от нормального, представлены в формате Мe (Q1; Q3), где Мe – медиана, а Q1; и Q3 – верхний и нижний квартили. Статистически значимыми считали различия между величинами при р<0,05.
Результаты
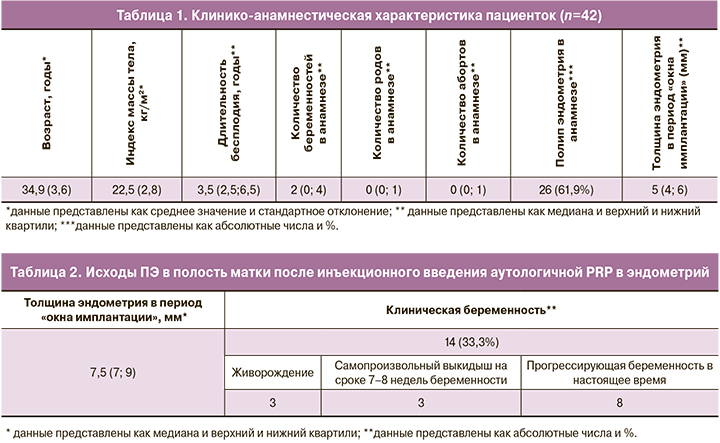
Возраст пациенток, включенных в исследование, варьировал от 18 до 38 лет и в среднем составил 34,9 (3,6) года. Продолжительность бесплодия у пациенток колебалась от 1 года до 15 лет и в среднем составила 3,5 (2,5–6,5) года. При этом первичное бесплодие было установлено у 26,1% (n=11) пациенток, а вторичное – у 73,9% (n=31). Исследуемая популяция пациенток была однородна по значениям индекса массы тела, уровню ЛГ, фолликулостимулирующего гормона (ФСГ), эстрадиола в крови и частоты общей соматической заболеваемости. Более половины женщин (71,4% (n=30)) в анамнезе имели отмену ПЭ в полость матки в криоциклах в связи с неадекватным ростом эндометрия на фоне проводимой терапии эстрогенами и препаратами, улучшающими кровообращение. Толщина эндометрия в период «окна имплантации» у пациенток, включенных в исследование, при проведении УЗИ в среднем составила 5,4 (4; 6) мм. Клинико-анамнестические данные пациенток, включенных в исследование, представлены в таблице 1.
При сборе анамнеза пациентки с «тонким» эндометрием часто указывали на скудный характер менструации, 69% (n=29) из них связывали изменение характера менструальных выделений с проведением конкретного внутриматочного вмешательства в анамнезе, сопровождающегося выскабливанием стенок полости матки. После инъекционного введения аутологичной PRP в эндометрий под контролем гистероскопии 88,1% пациенток (n=37) отметили субъективное улучшение качества менструаций, увеличение объема теряемой менструальной крови в новом менструальном цикле.
В анамнезе исследуемой популяции пациенток были отмечены состояния, повлекшие внутриматочные вмешательства с проведением выскабливания стенок полости матки, а именно: полип эндометрия – 61,9% (n=26), выскабливание стенок полости матки по поводу неразвивающейся беременности – 52,3% (n=22), диагностические выскабливания стенок полости матки – 76,1% (n=32), аборты – 28,5% (n=12).
Все пациентки, включенные в исследование, помимо гормональной, ранее получали дополнительную терапию, направленную на улучшение структуры и достижение оптимальных показателей толщины эндометрия. В том числе, проходили курс физиотерапевтического лечения 95,2% (n=40), гирудотерапии – 90,5% (n=38), силденафила цитрата – 85,7% (n=36), гранулоцитарного колониестимулирующего фактора роста – 28,5% (n=12), препаратов гидролизата плаценты человека – 16,6% (n=7).
Первичной конечной точкой выступила толщина эндометрия после проведения внутриэндометриального инъекционного введения аутологичной PRP, вторичной - наступление клинической беременности (таблица 2).
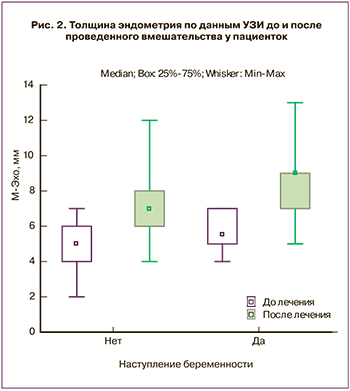 После проведенного вмешательства толщина эндометрия в период «окна имплантации» на фоне гормональной терапии статистически значимо увеличилась по сравнению с исходными значениями (Ме=7,5 (7; 9) (р<0,001)) (рис. 2). После ПЭ в полость матки беременность наступила у 33,3% пациенток (n=14). На сегодняшний день 3 беременности у женщин завершились рождением живых доношенных детей, 3 – самопроизвольным прерыванием на сроке 7–8 недель и 8 беременностей развиваются нормально в соответствии сроку.
После проведенного вмешательства толщина эндометрия в период «окна имплантации» на фоне гормональной терапии статистически значимо увеличилась по сравнению с исходными значениями (Ме=7,5 (7; 9) (р<0,001)) (рис. 2). После ПЭ в полость матки беременность наступила у 33,3% пациенток (n=14). На сегодняшний день 3 беременности у женщин завершились рождением живых доношенных детей, 3 – самопроизвольным прерыванием на сроке 7–8 недель и 8 беременностей развиваются нормально в соответствии сроку.
В зависимости от наступления беременности пациентки были разделены на 2 группы: пациентки с наступившей беременностью (n=14) и пациентки, у которых беременность не наступила (n=28). Несмотря на то, что при сравнении прироста толщины эндометрия после проведенного лечения у пациенток мы не получили статистически значимого различия между группами (р=0,12 (критерий Манна–Уитни)), что, возможно, связано с небольшими выборками, прослеживалась тенденция к большему увеличению толщины эндометрия у женщин, у которых беременность наступила (табл. 3).

Обсуждение
В данной статье мы впервые описали разработанную нами методику инъекционного введения аутологичной PRP пациенткам с «тонким» эндометрием, рефрактерным к проводимой терапии. В настоящее время пациентки с маточным фактором бесплодия относятся к особой категории, так как нет единого эффективного подхода к их лечению. В литературе представлены данные о влиянии толщины и структуры эндометрия на вероятность наступления беременности и живорождения в программах ЭКО. Liu K.E. et al. (2018) при анализе более 40 000 циклов ПЭ показали, что частота наступления беременности и живорождения снижается с каждым миллиметром при толщине эндометрия менее 8 мм при ПЭ в свежих циклах ЭКО и менее 7 мм при ПЭ в криоциклах соответственно [13].
Среди основных причин, приводящих к истончению эндометрия, особо выделяют повторные его механические повреждения при проведении внутриматочных вмешательств. Полученные нами данные согласуются с представленными в литературе [14]. Отсутствие эффекта от традиционной терапии препаратами эстрогенов приводило к отмене ПЭ в криоциклах у пациенток с «тонким» эндометрием в связи с неадекватной реакцией на проводимую терапию. Кроме того, отсутствие эффекта от проводимого лечения приводило к назначению доз эстрогенов, превышающих рекомендованные для обеспечения роста эндометрия.
Применение аутологичной PRP перед гормональной терапией эстрогенами привело к значительному увеличению толщины эндометрия, что позволило произвести ПЭ в полость матки исследуемой группе пациенток.
На сегодняшний день в литературе представлены результаты нескольких исследований по оценке эффективности применения внутриматочных инфузий аутологичной PRP в терапии женщин с бесплодием на фоне «тонкого» эндометрия [4–6, 15, 16]. Результаты первого исследования применения PRP в терапии маточного фактора бесплодия были представлены в 2015 году [17].
Molina A. et al. (2017) в своем исследовании (n=19) проводили внутриматочные инфузии аутологичной PRP на 10-й и 12-й день цикла на фоне заместительной гормональной терапии пациенткам с «тонким» эндометрием перед ПЭ в полость матки. Согласно представленным данным, частота наступления беременности составила 73,7% (n=15), частота живорождения – 26,3% (n=5) [6]. Другие авторы представили результаты своего исследования (n=10), в котором проводили внутриматочные инфузии 0,5 мл аутологичной PRP на 11-12-й и 13–14-й дни цикла на фоне заместительной гормональной терапии перед ПЭ в полость матки пациенткам с толщиной эндометрия <7 мм в период «окна имплантации» в предыдущих циклах. Беременность наступила у 50% (n=5) пациенток [5]. Kim H. et al. (2019) в своем исследовании проводили 2–3 процедуры внутриматочного введения 0,7–1,0 мл аутологичной PRP на фоне заместительной гормональной терапии пациенткам с «тонким» эндометрием перед ПЭ в полость матки. Согласно представленным данным, ПЭ был произведен 22 пациенткам, 2 из которых выбыли из исследования, частота наступления беременности составила 30% (n=6), частота живорождения – 20% (n=4). Толщина эндометрия в среднем увеличилась на 0,6 мм по сравнению с предыдущими циклами, что не было статистически значимо. Необходимо отметить, что в данном исследовании пациенткам производился перенос 2–3 эмбрионов в полость матки [15].
К недостаткам опубликованных работ по оценке эффективности применения аутологичной PRP при маточном факторе бесплодия можно отнести малые выборки пациенток, отсутствие единого алгоритма приготовления и применения PRP, а также отсутствие информации о концентрации тромбоцитов и наличии или отсутствии лейкоцитов в полученной плазме, что существенно затрудняет сравнительный анализ представленных результатов.
Инъекционное введение аутологичной PRP в эндометрий пациенток обеспечивает действие факторов роста непосредственно в наиболее гипотрофичных участках ткани. Кроме того, инъекционное введение позволяет вводить объем, в несколько раз превышающий таковой при инфузионном введении и не требует проведения повторных процедур для достижения терапевтического эффекта. Тот факт, что PRP получают из собственной крови пациентки, позволяет свести к минимуму развитие нежелательных реакций и инфекционных осложнений.
В век активного развития регенеративной медицины исследования о возможностях применения PRP-терапии в репродуктивной сфере стали особенно актуальны. В литературе представлены данные о том, что применение аутологичной PRP стимулирует рост, миграцию и адгезию эндометриальных мезенхимальных стволовых клеток в экспериментах in vitro [18].
На сегодняшний день применение PRP широко распространено во многих областях медицины как дополнительный метод в программах ВРТ [19], однако нет единого стандарта приготовления PRP. Было показано, что для получения терапевтического эффекта необходимо получение PRP с концентрацией тромбоцитов не менее 1 000 000 на микролитр [20].
Важно особо подчеркнуть, что инъекционное введение аутологичной PRP в эндометрий согласно описанной методике было проведено нами 8 пациенткам старше 38 лет, средний возраст которых составил 44,6 (4,8) года, однако они не были включены в статистический анализ. У 3 пациенток после ПЭ в полость матки наступила беременность, 2 из них завершились рождением живых доношенных детей, 1 беременность прервалась на сроке 18–19 недель.
Заключение
Несмотря на развитие современной науки, на сегодняшний день не существует единой эффективной терапии маточного фактора бесплодия, в связи с чем для женщин с рефрактерным «тонким» эндометрием единственной возможностью реализовать свой репродуктивный потенциал становится суррогатное материнство. В данной статье были представлены полученные нами предварительные данные. В настоящий момент исследование продолжается и проводится оценка динамики показателей маточной гемодинамики и рецептивности у пациенток с «тонким» эндометрием после проведенной терапии. Разработанный нами метод позволяет таргетно воздействовать на наиболее измененные участки эндометрия, позволяя добиться улучшения показателей его роста и структуры, что, вероятно, обусловлено развитием ангиогенеза и пролиферации клеток под воздействием высвобождаемых факторов роста непосредственно в эндометриальной ткани.



