Вирус папилломы человека (ВПЧ) является наиболее распространенной инфекцией, передающейся половым путем. Инфицирование ВПЧ характерно, преимущественно, молодым женщинам и наибольшая распространенность ВПЧ наблюдается в возрасте до 25 лет. Длительная персистенция одного и того же типа ВПЧ высокого онкогенного риска (ВПЧ ВР) является этиологическим фактором развития цервикальных эпителиальных неоплазий (CIN). Американское общество по кольпоскопии и цервикальной патологии (ASCCP) предложило использовать термин «малые» формы поражения эпителия шейки матки для обозначения пациенток с наличием ВПЧ 16 или 18 типов и персистенцией ВПЧ ВР при наличии нормальных результатов цитологического заключения [1].
В настоящее время известно о 201 типах ВПЧ, 25 из которых обладают онкогенным потенциалом [2]. ВПЧ вызывают широкий спектр заболеваний от доброкачественных до инвазивных опухолей. Международное агентство по изучению рака (IARC) выделило 12 ВПЧ ВР (ВПЧ 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 и 59) (группа 1), ассоциированных с раком шейки матки (РШМ). Эти 12 типов ВПЧ относятся к одной эволюционной ветви, которая включает Alphapapillomavirus групп: А5, А6, А7, А9. Тринадцать дополнительных типов ВПЧ были классифицированы как вирусы возможно канцерогенного риска – группа 2B (ВПЧ 26, 69, 82, 30, 53, 66, 70, 85, 97, 67) на основе их филогенетического родства с группой 1, а также ВПЧ 34, 73 (А11), за исключением ВПЧ 68 типа, который был внесен в группу вероятно канцерогенного риска – 2А. Вирусы группы 1 и 2А обуславливают 96 % РШМ, группы 2B – 2,6% РШМ [3].
Этиологическим фактором возникновения РШМ является инфицирование ВПЧ ВР базальных клеток эпителия шейки матки. Различают две стадии течения папилломавирусной инфекции: 1) транзиторная (стадия репродуктивной или эписомальной инфекции), когда вирус находится в «свободном состоянии»; 2) интегративная стадия, при которой геном ДНК вируса встраивается в геном инфицированных клеток. Элиминация вируса происходит в 70% случаев в течение первого года инфицирования и в 91% случаев – в течение 24 мес. [4]. По данным исследований, транзиторное течение инфекции подразделяют на: вариант со стойким отрицательным ответом – это отрицательный ВПЧ-тест с промежутком в 12 мес.; вариант с нестойким отрицательным ответом – обнаружение ВПЧ через 12 мес. и его элиминация через 24 мес. [5]. По данным ряда исследований, после инфицирования ВПЧ не определяется через 6 мес. у 50% женщин и у 75% – к концу первого года заражения.
Онкогенный потенциал ВПЧ реализуется при высокой вирусной нагрузке, а также интеграции ВПЧ в геном клетки хозяина и вызван гиперэкспрессией онкобелков Е6/Е7, которые изменяют клеточный цикл. Взаимодействие Е6/Е7 с опухоль-супрессорным белком p53 и белком ретинобластомы (pRb) приводит к снижению клеточного апоптоза, активации патологической пролиферации, неоангиогенеза и опухолевой трансформации. Показано, что при всех типах ВПЧ групп 1, 2А и 2В маркеры ВПЧ-ассоциированного канцерогенеза, такие как мРНК E6/Е7, CDKN2А/p16 (повышение экспрессии), ССND1, p53 и Rb (понижение экспрессии) претерпевают аналогичные изменения [6]. Нахождение в организме женщины одного и того же типа ВПЧ в течение 2-х лет и более называется персистенцией. В период инфекционного процесса происходит накопление соматических мутаций и формирование CIN. Средняя продолжительность инфекционного периода у пациенток с CIN I составила 586 дней, у пациенток с койлоцитоатипией (по данным цитологического мазка) – 392,3 дня [7]. По данным Национального института по изучению рака (NCI), в течение 24 месяцев у 10% женщин с CIN I происходит прогрессирование заболевания до CIN III.
Цель исследования: В ходе динамического наблюдения в течение 2-х лет у женщин с папилломавирусной инфекцией проанализировать значимость персистенции ВПЧ ВР, вирусной нагрузки и экспрессии мРНК генов MKI67, CDKN2A, PGR и BCL2 в прогнозе развития плоскоклеточного интраэпителиального поражения (SIL)
Материал и методы исследования
В проспективном исследовании приняло участие 85 женщин в возрасте 18-45 лет (средний возраст 30±11 лет), обратившихся на прием в научно-поликлиническое отделение ФГБУ «НМИЦ АГИ им. В.И. Кулакова» Минздрава России. Критерии включения: репродуктивный возраст, наличие ВПЧ ВР, цитологическая картина соответствующая NILM (интраэпителиальные изменения и злокачественные процессы отсутствуют). Пациенткам проводился клинический осмотр, ВПЧ-типирование, жидкостная цитология, расширенная кольпоскопия каждые 12 мес., в течение 2-х лет наблюдения. Пациенткам с персистенцией одного и того же типа ВПЧ ВР и/или при ухудшении выраженности процесса по данным кольпоскопии была проведена прицельная биопсия шейки матки с выскабливанием цервикального канала (по показаниям).
Определение ВПЧ 21 типов (6, 11, 16, 18, 26, 31, 33, 35, 39, 44(55), 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) с установлением вирусной нагрузки проводили методом мультиплексной полимеразной цепной реакции (ПЦР) с детекцией результатов в режиме реального времени (ООО «НПО ДНК-Технология», Россия, РУ Росздравнадзора № ФСР 2010/08811). Взятие материала осуществлялось с помощью специального зонда из зоны переходного эпителия цервикального канала. Исследуемый материал помещался в пробирку объемом 1,5 мл с 0,9% раствором натрия хлорида. При оценке вирусной нагрузки в качестве меры центральной тенденции определялась медиана, в качестве интегральной оценки – межквартильный размах. Достоверность межгрупповых различий определялась с помощью критерия Манна-Уитни.
Для определения риска развития CIN использовался критерий интегральной оценки уровня экспрессии мРНК генов MKI67, CDKN2A (р16), PGR и BCL2 c помощью метода ПЦР с обратной транскрипцией в режиме реального времени [8, 9].
Индекс риска (ИР) определялся по формуле:
*100 (формула 1), где
z – регрессионная функция, имеющая вид:
Z = 0,8*ln [МKI67]/[PGR] + 1,6*ln [CDKN2A]/[BCL2] – 4 (формула 2), где [МKI67]/[PGR] – соотношение уровней экспрессии мРНК генов МKI67 и PGR, [CDKN2A]/[BCL2] – соотношение уровней экспрессии мРНК CDKN2A и BCL2.
При значении ИР > 57 баллов риск развития CIN считался высоким [9].
Цитологический мазок оценивался по классификации Бетесда (TDS– Terminology Bethesda System). Гистологическое исследование биопсийного материала оценивалось по классификации ВОЗ: легкая дисплазия (CIN I, LSIL (плоскоклеточное интраэпителиальное повреждение легкой степени)), тяжелая дисплазия (CIN II–III, HSIL (плоскоклеточное интраэпителиальное повреждение тяжелой степени)).
Расширенная кольпоскопия и оценка ее картины проводилась в соответствии с единой Международной кольпоскопической классификацией, одобренной на 14-м Всемирном конгрессе IFCPC в Рио-де-Жанейро (2011 г.)
Результаты исследования и обсуждение
Было обследовано 85 женщин в возрасте 18–45 лет (средний возраст 34±11 лет). Наиболее часто встречаемыми были ВПЧ 16, 31, 51, 52, 39, 18 типов. ВПЧ 16 типа выявлен у 25 женщин (29%), 31 – у 17 (20%), 51 и 52 – у 12 (14%), 39 – у 11 (13%), 18 – у 7 (9%) (см. рисунок). Согласно классификации (IARC), все указанные типы относятся к группе высокого канцерогенного риска. ВПЧ 33, 35, 45, 56, 58 и 68 типы встречались менее чем в 9% случаев. ВПЧ 6 типа встречался у 7 женщин (9%).
По результатам динамического наблюдения в зависимости от течения папилломавирусной инфекции были сформированы 2 группы женщин: Iа – группа с транзиторным течением инфекции со стойким отрицательным ответом, при котором элиминация вируса произошла через 12 месяцев – 52 (61%), Iб – группа с транзиторным течением инфекции с нестойким отрицательным ответом, где элиминация ВПЧ произошла через 24 месяца от момента инфицирования – 12 (14%); II группа – 21 (25%) с персистенцией ВПЧ ВР – определение одного и того же типа ВПЧ на протяжении 24 месяцев.
Полная элиминация от ВПЧ ВР через 24 месяца наблюдалась у 64(75%) пациенток, из них у 52 в первые 12 месяцев, у 12 – через 24 месяца (табл. 1).
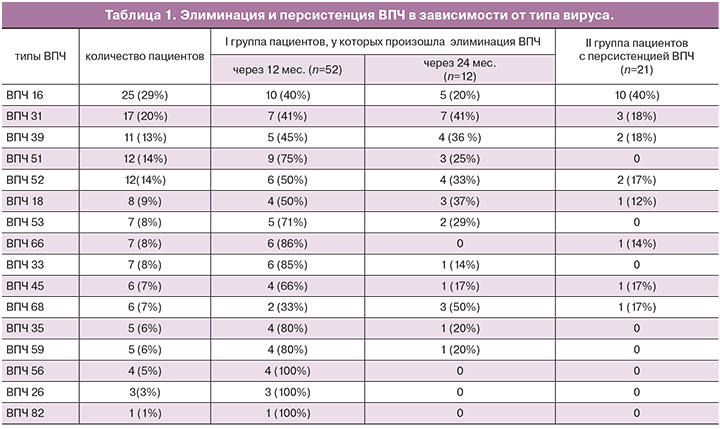
Проведен анализ элиминации типов ВПЧ ВР через 12 и 24 месяца. Анализ результатов исследования показал, что элиминация в первые 12 месяцев произошла у 10 (40%) женщин с ВПЧ 16 типа; у 9 (75%) – с ВПЧ 51; у 7(41%) – с ВПЧ 31; у 5 (45%) – с ВПЧ 39, у 2 (33%) – с ВПЧ 68; у 6 (50%) – с ВПЧ 52, у 6 (86%) – ВПЧ 66 и ВПЧ 33; у 5 (71%) – с ВПЧ 53, у 4 (66%) – с ВПЧ 45; у 4 (50%) – с ВПЧ 18.
Во II группе женщин наблюдалась персистенция ВПЧ 16 – у 10 (40%), ВПЧ 31 – у 3 (18%), ВПЧ 39 – у 2 (18%), ВПЧ 52 – у 2 (17%), ВПЧ 45 – у 1 (17%), ВПЧ 68 – у 1 (17%), ВПЧ 66 – у 1 (14,3%) и ВПЧ 18 – у 1 (12%). Средняя вирусная нагрузка в Iа группе со стойким отрицательным ответом и в Iб группе с нестойким отрицательным ответом на момент взятия в исследование составила 4,8 log копий вируса в образце (межквартильный размах 3,8 – 6,3). Вирусная нагрузка исследуемых типов ВПЧ во II группе составила 4,5 log копий вируса в образце (межквартильный размах 3,5–5,7). Таким образом, величина вирусной нагрузки не была критерием прогноза персистенции.
Результаты цитологического исследования в I группе соответствовали NILM (через 12 и 24 месяцев). В группе пациентов с персистенцией ВПЧ ВР результаты цитологического исследования изменились в 3-х случаях на более неблагоприятные: у 2 пациенток (9%) с ВПЧ 16 и ВПЧ 31 типов – на ASCUS (атипичные клетки плоского эпителия неопределенного значения); у 1 (5%) пациентки с ВПЧ 16 типа – на LSIL.
С целью оценки состояния эпителия шейки матки всем женщинам дважды с промежутком 12 месяцев проводилась расширенная кольпоскопия. При первом визите удовлетворительная кольпоскопическая картина (зона трансформации 1 тип) наблюдалась в Iа группе со стойким отрицательным ответом – у 40 (77%) пациенток, в группе с нестойким отрицательным ответом – у 5 (42%); во II группе с персистенцией ВПЧ ВР – у 12 (57%) пациенток. Варианты неудовлетворительной кольпоскопической картины в I группе выявлены у 19 женщин (30%); во II группе – у 9 (43%). Кольпоскопические изменения преобладали во II группе с персистенцией ВПЧ ВР. На момент включения в исследование во II группе, слабовыраженные изменения при кольпоскопии определялись у 8 (38%) пациенток; выраженные изменения не наблюдались; через 24 месяца слабовыраженные изменения выявлены у 11 (52%), выраженные изменения – у 1 (5%) (табл. 2). Через 12 месяцев 3 (25%) пациенткам группы Iб с кольпоскопическими изменениями была проведена прицельная биопсия шейки матки. Во всех случаях гистологически верифицированы доброкачественные изменения: хронический цервицит – у 2, лейкоплакия шейки матки – у 1.
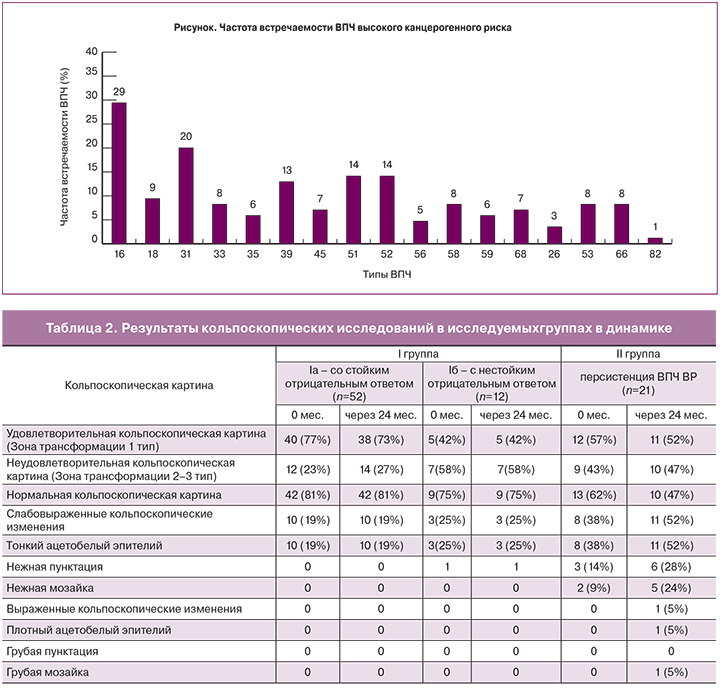
Пациенткам II группы с персистенцией ВПЧ ВР, со слабовыраженными изменениями при кольпоскопии – наличием ацетобелого эпителия с нежной мозайкой у 5 (24%) и пунктации у 6 (28%) и выраженными изменениями – плотный ацетобелый эпителий и грубая мозайка у 1 (5%), была проведена прицельная биопсия шейки матки. По результатам гистологического исследования у 10 (47%) был диагностирован LSIL, у 1 (5%) – HSIL, у 6 (28%) – лейкоплакия шейки матки, у 4 (19%) – хронический цервицит. Учитывая результаты нашего исследования, проведение расширенной кольпоскопии у пациенток с персистенцией ВПЧ ВР при нормальных результатах цитологического исследования, является чрезвычайно важным и помогает выявлять группу женщин, требующих проведения прицельной биопсии шейки матки для верификации SIL.
Результаты собственных исследования показали, что персистенция ВПЧ ВР является риском развития SIL у 52% женщин. Так, у пациенток с гистологически верифицированным LSIL и HSIL лидирующие позиции занимал ВПЧ 16 типа, 4 (19%) и 1 (5%) соответственно; при LSIL также определялись ВПЧ 31 – 3(14%), ВПЧ 52 – 2 (9%), ВПЧ 68 – 5 %; ВПЧ 39 –5% (табл. 3). Представленные типы ВПЧ, согласно классификации IARC являются основными в развитии тяжелого предрака и РШМ.
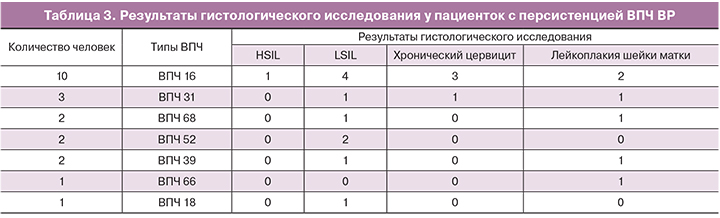
Аналогичные данные были получены в мета-анализе Dillner в 2015 г., по результатам которого ВПЧ 16, 31, 39, 45 типов имели наивысший коэффициент заболеваемости РШМ среди ВПЧ инфицированных женщин [10]. Следует отметить, что ряд авторов рассматривают ВПЧ 51, 56, 59 и 66 типов, как имеющие минимальный коэффициент заболеваемости в развитии РШМ. По данным нашего исследования, элиминация ВПЧ 56 и ВПЧ 59 типов произошла у пациентов в 100% случаях в течение 24 месяцев. Однако, наблюдалась персистенция ВПЧ 66 типа, при наличии слабовыраженных изменений при кольпоскопии, что послужило основанием для проведения прицельной биопсии шейки матки. Гистологический диагноз соответствовал доброкачественным изменениям эпителия шейки матки.
Некоторые исследователи полагают, что персистенция зависит от типовой принадлежности вируса. В исследовании Soto-De Leon [2] и соавт. проведен анализ элиминации и персистенции наиболее часто встречаемых типов ВПЧ ВР у женщин с помощью формулы Каплана-Мейра. По результатам исследования, персистенция наблюдалась у пациенток с ВПЧ 31 и 18 типов, элиминация – с ВПЧ 33 типа [5, 11]. По результатам нашего исследования в 85,3% случаях произошла элиминация ВПЧ 33 типа в первые 12 месяцев, в 100% случаях – в течение 24 месяцев наблюдения, что сопоставимо с данными мета-анализа.
Анализ результатов нашего исследования показал, что у 21 женщины с персистенцией ВПЧ ВР LSIL развился – у 10 и HSIL – у 1. Риск развития CIN в соответствии с критерием интегральной оценки уровня экспрессии мРНК генов MKI67, CDKN2A (р16), PGR и BCL2 был определен как высокий при первом визите у 1 пациентки с развившемся в дальнейшем HSIL и у 2 женщин с развившемся в дальнейшем LSIL. Высокий риск развития CIN при визитах через 12 и 24 месяца дополнительно был выявлен у 3 женщин с развившейся дисплазией легкой степени и рассматривается нами, как группа риска по прогрессии CIN. При высоком риске развития и прогрессии CIN повышается уровень экспрессии мРНК генов MKI67, CDKN2A и снижается уровень экспрессии мРНК генов PGR и BCL2, что учитывается критерием суммарной оценки, изложенном в материалах и методах. Ни в одном случае ИР не был определен, как высокий в группе со стойкой и нестойкой элиминацией вируса. Наряду с кольпоскопической картиной критерий интегральной оценки уровня экспрессии мРНК 4 маркеров может быть использован для выявления группы риска развития и дальнейшей прогрессии CIN у женщин с персистенцией ВПЧ ВР.
Таким образом, не только наличие, но и персистенция одного и того же типа ВПЧ ВР в течение 2 лет и более, при нормальных результатах цитологического исследования, должна настораживать клинициста с позиции развития CIN. В когорте обследованных нами пациенток, персистенция ВПЧ 16, 31, 39, 18, 68 и 52 типов вызвала развитие неопластических процессов шейки матки. При этом вирусная нагрузка достоверно не отличалась в группе исследуемых пациентов, в связи с чем, она не рассматривается как основной критерий в развитие SIL. Однако, изменение уровня экспрессии мРНК генов MKI67, CDKN2A, PGR и BCL2 у пациенток с персистенцией ВПЧ ВР позволило своевременно выявить группу женщин с дисплазиями легкой и тяжелой степеней поражения, способствуя профилактике РШМ.
Заключение
Персистенция ВПЧ ВР у женщин с изменениями уровня экспрессии мРНК генов (MKI67, CDKN2A, PGR и BCL2) и результатами расширенной кольпоскопии, могут рассматриваться как маркеры прогрессии SIL. Величина вирусной нагрузки не является критерием прогноза персистенции ВПЧ и развития CIN.



