Эндометрий выполняет множество функций, в числе которых защита от проникающих в полость матки патогенных микроорганизмов и прямое участие в имплантации эмбриона [1]. Успешная адгезия трофэктодермы эмбриона к мембране эпителиоцитов во многом предопределяет дальнейший ход имплантации. Эндометрий является специализированной гормонально регулируемой популяцией клеток, которая характеризуется рядом циклических морфологических и биохимических изменений, необходимых для создания оптимальных условий для развития эмбриона. Нормальная анатомия полости матки и состояние эндометрия обеспечивают необходимые условия для имплантации эмбриона и поддержания беременности. Любые отклонения в структуре эндометрия способны повлечь за собой нарушения репродуктивной функции, проявляющейся бесплодием и невынашиванием беременности [2]. Именно поэтому, по мнению многих клиницистов, оценка состояния полости матки и эндометрия является необходимым этапом прегравидарной подготовки.
Хронический эндометрит (ХЭ) занимает первое место в структуре патологических изменений эндометрия, его распространенность у женщин с бесплодием составляет 12–68%, достигая своего максимума при наличии трубно-перитонеального фактора бесплодия. Наибольшие показатели распространенности ХЭ отмечены у больных с привычным невынашиванием беременности и составляют около 70% [3, 4].
Отличительной патогенетической особенностью ХЭ у женщин с бесплодием и невынашиванием в анамнезе является несоответствие строения эндометрия стадии менструального цикла. Формирование данного феномена обусловлено нарастанием цитогенности. Нарушение рецептивности эндометрия приводит к формированию дисхроноза эпителия желез и ухудшает адгезивные способности ткани. Происходит фиброзирование стромы эндометрия, запускается ложная цепочка патологического ангиогенеза, что вызывает ишемию ткани и усугубляет процессы активации фибробластов и нарушения рецептивности эндометрия [5].
Изменение процессов ангиогенеза может привести к нарушению циклической трансформации эндометрия, нарушению имплантации, самопроизвольному выкидышу [6]. Макрофаги влияют на увеличение жизнеспособности эндотелиальных клеток эндометрия через секрецию сосудистого эндотелиального фактора роста (VEGF) – основного регулятора ангиогенеза в эндометрии, который в свою очередь повышает пролиферативную активность клеток эндотелия и проницаемость сосудов [7].
 Основные функции VEGF – участие в создании новых кровеносных сосудов [8].
Основные функции VEGF – участие в создании новых кровеносных сосудов [8].
Один из белков семейства VEGF, плацентарный фактор роста (PIGF), также обладает выраженным ангиогенным потенциалом, усиливает VEGF-индуцированный ангиогенез и проницаемость сосудов [9]. Стимулирует клетки к началу деления тромбоцитарный фактор роста (PDGF). Он является мощным митогеном для клеток мезенхимального происхождения, играет важную роль в эмбриональном развитии, пролиферации, миграции клеток и ангиогенезе.
Цель исследования: обосновать диагностическое значение содержания PIGF, РDGF-BB и VEGF-A в сыворотке крови у женщин с бесплодием и/или невынашиванием беременности, обусловленных ХЭ.
Задачи исследования:
Изучить клинико-анамнестические особенности женщин с ХЭ, страдающих бесплодием и невынашиванием беременности.
Охарактеризовать параметры эндометрия по данным ультразвукового, морфологического и иммуногистохимического (ИГХ) методов исследования.
Провести анализ уровня VEGF-А, PIGF, PDGF-ВВ в сыворотке крови у женщин с ХЭ, страдающих бесплодием и невынашиванием беременности.
Определить диагностическую ценность факторов роста при ХЭ.
Материал и методы исследования
Для реализации поставленных задач нами проведено комплексное обследование 88 женщин, обратившихся за помощью на специализированный прием по проблемам репродуктивного здоровья в ГУЗ Ульяновская областная клиническая больница, ООО МЦ «Allegris» и ООО МК «Мой доктор».
Все пациентки были разделены на три группы. 1-ю группу составили 28 женщин с привычной потерей беременности с морфологически и иммуногистохимически подтвержденным ХЭ; 2-ю группу – 36 бесплодных пациенток с ХЭ; 3-я группа (контрольная) – 24 женщины с мужским фактором бесплодия, структура эндометрия у которых не была изменена.
Всем проведено общеклиническое исследование: сбор анамнеза, общий и гинекологический осмотр.

Ультразвуковое исследование (УЗИ) органов малого таза выполнялось на аппаратах Voluson E6 и Voluson E8 (General Electric, США) с использованием мультичастотного трансвагинального датчика с частотой 8 МГц. Проводили динамическое ультразвуковое исследование во II фазу менструального цикла, на 15–22-й день. УЗИ начинали с проведения трансабдоминального сканирования (с наполненным мочевым пузырем) с целью исключения объемной патологии полости малого таза, оценивали ее форму, структуру миометрия, исключали наличие миоматозных узлов и аденомиоза.
Особое внимание уделяли оценке срединного М-эха: его толщине, структуре и наличию включений. Нормальными параметрами М-эха считались: однородная структура, отсутствие гипо- или гиперэхогенных включений, соответствие его структуры дню менструального цикла, толщина М-эха во II фазу не менее 8 мм.
При ультразвуковой диагностике ХЭ использовали критерии, разработанные В.Н. Демидовым в 1993 году: повышение эхогенности эндометрия в пролиферативную фазу, неравномерное расширение полости матки за счет нарушения проницаемости сосудов, неровный контур эндометрия, неоднородная эхо-структура эндометрия, неровность линии смыкания эндометрия передней и задней стенок матки, газообразные пузырьки в полости матки, гиперэхогенные включения в проекции базального слоя, диффузно-очаговые и кистозные изменения в субэндометриальной зоне миометрия, расширение вен миометрия более 3 мм и параметрия – более 5 мм [10].
 Исследование качества эндометрия и содержимого полости матки проводилось путем пайпель- и аспирационной биопсии эндометрия мануальным вакуумным аспиратором Ipas MVA Plus с последующим гистологическим, ИГХ, бактериологическим исследованием. Биопсия проводилась по стандартной методике на 7–11-й день менструального цикла. Материал, полученный двумя вышеперечисленными способами из полости матки, фиксировался в 10% растворе забуференного нейтрального формалина в двух пробирках и направлялся в лабораторию патоморфологической диагностики для проведения гистологического и ИГХ-исследований. После стандартной гистологической проводки на полуавтоматическом микротоме получали срезы толщиной 5–7 мкн. Полученные срезы окрашивались гематоксилин-эозином. Микроскопические препараты исследовали методом обзорной микроскопии, которая осуществлялась на световых микроскопах Carl Zeiss (Германия).
Исследование качества эндометрия и содержимого полости матки проводилось путем пайпель- и аспирационной биопсии эндометрия мануальным вакуумным аспиратором Ipas MVA Plus с последующим гистологическим, ИГХ, бактериологическим исследованием. Биопсия проводилась по стандартной методике на 7–11-й день менструального цикла. Материал, полученный двумя вышеперечисленными способами из полости матки, фиксировался в 10% растворе забуференного нейтрального формалина в двух пробирках и направлялся в лабораторию патоморфологической диагностики для проведения гистологического и ИГХ-исследований. После стандартной гистологической проводки на полуавтоматическом микротоме получали срезы толщиной 5–7 мкн. Полученные срезы окрашивались гематоксилин-эозином. Микроскопические препараты исследовали методом обзорной микроскопии, которая осуществлялась на световых микроскопах Carl Zeiss (Германия).
Также проводилось ИГХ-исследование ткани эндометрия с помощью метода пероксидазной техники на парафиновых срезах толщиной 3–4 мкн. Срезы депарафинировали и проводили по спиртам нисходящей концентрации. Десмакировку осуществляли в растворе цитратного буфера 0,01 М рН 6,0 для белка Ki-67 и белка c-erb-B2/HER2/neu и в растворе ЭДТА 0,001 М рН 9,0 для рецепторов эстрогенов и прогестерона на водяной бане в течение 20 минут.
Были использованы система детекции UltraVision Quanto (DAKO, Дания) и моноклональные мышиные антитела фирмы «DAKO»: к рецепторам эстрогена (клон 1D5), прогестерона (клон PgR 636), белку Ki-67 (клон MIB-1); поликлональные кроличьи антитела Her2 в разведении 1:700; к рецепторам лимфоцитов – CD 3 (клон SP 7); CD 4 (клон 4B12); CD 8 (клон), CD 138 (клон); к эпидермальному фактору роста EGFR (клон) и к андрогеновым рецепторам (клон).
Для определения уровня экспрессии эстрогеновых и прогестероновых рецепторов использовалась полуколичественная система «Allred Scoring Guidline» оценки процента окрашенных клеток (proportion score, PS) и интенсивности окраски клеток (intensity score, IS), которые затем суммировались: TS (total score)=PS+IS. Процент окрашенных клеток оценивался в баллах: 0 – 0% клеток, 1 – 0,1–1% клеток, 2 – 2–10% клеток, 3 – 11–33% клеток, 4 – 34–66% клеток, 5 – 67–100% клеток. Интенсивность окрашивания оценивалась в баллах: 0 – отсутствие окрашивания, 1 – слабое окрашивание, 2 – умеренное, 3 – выраженное окрашивание. Таким образом, результат Allred Score колебался от 0 до 8 баллов. На основании полученных результатов окрашивания хроническое воспаление эндометрия мы расценивали как слабо выраженное, умеренно и выраженное.
Просмотр и фотографирование микропрепаратов осуществляли на микроскопе AxioLab («Carl Zeiss Jena», Germany) с использованием цифровой фотокамеры («Carl Zeiss Jena», Germany). Количественный анализ результатов ИГХ реакций проводился под увеличением объектива 20×, 40×.

Образцы крови для определения уровня VEGF-А, PIGF, PDGF-ВВ в сыворотке были обработаны на базе научно-исследовательского медико-биологического центра (НИМБЦ) ИМЭиФК ФГБОУ ВПО Ульяновский государственный университет (г. Ульяновск). Забор крови был проведен в утренние часы натощак с соблюдением установленных требований с использованием вакуумного метода. Сыворотку получали стандартным путем. До исследования ее хранили в морозильной камере при температуре -80°С. Для определения уровня факторов роста методом иммуноферментного анализа были использованы следующие коммерческие тест-системы: Bender MedSystem (Австрия), Affymetrix eBioscience (США) для VEGF-А, IBL (Германия) для PIGF, Bender MedSystem (Австрия) для PDGF-ВВ и автоматический иммуноферментный анализатор «PLATE SCREEN» (Hospiteх Diagnostics, Италия). Статистическая обработка результатов проводилась в среде Statistica 6.1 с применением непараметрического критерия Манна–Уитни.
Результаты и обсуждение
У всех 88 женщин, включенных в исследование, выявлен женский тип телосложения с правильным развитием вторичных половых признаков. Средний возраст женщин варьировал от 23 до 39 лет, составляя в среднем 31,4±3,3 года.
Согласно полученным данным женщины всех групп имели регулярный менструальный цикл, продолжительность которого составила в среднем 29±2,2 дня в 1-й группе, 28±2,8 дня во 2-й группе и 29±3,1 дня в 3-й группе.
Длительность бесплодия во 2-й группе обследуемых колебалась от 2 до 14 лет и составила в среднем 10±2,2 года. Частота первичного бесплодия составила 77,8%, вторичного – 22,2%.
Предшествующие беременности закончились абортами у 8 (22,2±7,0%) пациенток во второй группе и у 8 (28,6±8,7%) в первой группе (р>0,05). У 4 (11,1±5,3%) обследуемых с невынашиванием беременности выявлены неразвивающиеся беременности, в группе с бесплодием таких женщин было 20 (71,4±8,7%) (р<0,001).
Обращает на себя внимание репродуктивный анамнез пациенток 3-й группы: аборты были у 2 (8,3±5,8%) женщин. Такой же удельный вес имели неразвивающиеся беременности. На выкидыши указывали 4 (16,7±7,8%) пациентки.
Отметим, что все женщины выделенных групп были полностью обследованы. Данные о сопутствующей соматической патологии представлены в табл. 1.
В структуре экстрагенитальной патологии заболевания щитовидной железы чаще встречались у пациенток с невынашиванием беременности – у 16 (57,1±9,5%) по сравнению с пациентками из группы с бесплодием – у 12 (33,3±8,0%) (р>0,05). В группе контроля заболевания щитовидной железы были выявлены у 4 (16,7±7,8%) женщин. Метаболический синдром был у 4 (14,3±6,7%) пациенток 1-й группы, у 4 (11,1±5,3%) женщин 2-й группы (р>0,05) и не выявлялся в группе контроля.
 Проведенное УЗИ органов малого таза указывало на то, что статистически значимых различий в размерах тела матки и объемах яичников у всех женщин выделенных групп выявлено не было. Отметим, что у женщин 1-й и 2-й группы было выявлено изменение эхо-структуры эндометрия в 69% случаев, в то время как в контрольной группе изменений эндометрия установлено не было. В структуре ультразвуковых признаков ХЭ у пациенток 1-й и 2-й группы преобладали: неоднородная эхо-структура эндометрия, его неоднородный контур и повышение эхогенности. Реже наблюдали гиперэхогенные включения в базальном слое эндометрия, газообразные пузырьки в полости матки и ее расширение (рис. 1).
Проведенное УЗИ органов малого таза указывало на то, что статистически значимых различий в размерах тела матки и объемах яичников у всех женщин выделенных групп выявлено не было. Отметим, что у женщин 1-й и 2-й группы было выявлено изменение эхо-структуры эндометрия в 69% случаев, в то время как в контрольной группе изменений эндометрия установлено не было. В структуре ультразвуковых признаков ХЭ у пациенток 1-й и 2-й группы преобладали: неоднородная эхо-структура эндометрия, его неоднородный контур и повышение эхогенности. Реже наблюдали гиперэхогенные включения в базальном слое эндометрия, газообразные пузырьки в полости матки и ее расширение (рис. 1).
Проведенное бактериологическое исследование аспиратов из полости матки показывало отсутствие роста микрофлоры у 20 (83,3±7,8%) пациенток контрольной группы, 24 (66,6±8,0%) бесплодных женщин и у 14 (50±9,6%) с привычной потерей беременности. Инфекций, передаваемых половым путем, выявлено не было. Из выделенных микроорганизмов во всех группах преобладали Enterococcus faecalis. Все пациентки получили соответствующую антибактериальную и антимикотическую терапию, после чего было проведено повторное бактериологическое исследование, при котором во всех группах роста флоры обнаружено не было.
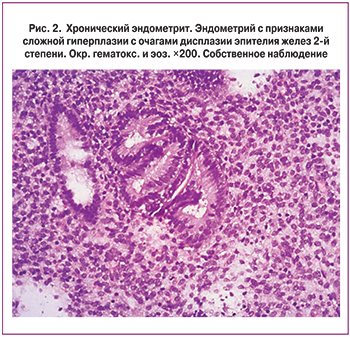
В результате гистологического и ИГХ-исследований мы получили следующие данные: выраженная хроническая воспалительная реакция эндометрия выявлялась чаще у женщин с невынашиванием беременности – 4 (14,3±6,7%) в сравнении с бесплодными пациентками – 4 (11,1±5,3%) (р>0,05). Умеренно выраженные проявления ХЭ встречались также чаще в 1-й группе – 16 (57,1±9,5%) в сравнении с пациентками 2-й группы – 20 (55,6±8,4%) (р>0,05). Железистые полипы эндометрия выявлялись чаще у женщин с невынашиванием беременности – 16 (57,1±9,5%), чем у пациенток с бесплодием – 8 (22,2±7,0%) (р>0,05). Сложная гиперплазия эндометрия без атипии желез встречалась чаще во 2-й группе – у 20 (55,6±8,4%) в сравнении с 1-й группой женщин – 8 (28,6±8,7%) (р<0,05). Гипопластический эндометрий встречался только у бесплодных женщин – у 8 (22,2±7,0%) (р<0,01). Сложная гиперплазия эндометрия с дисплазией эпителия желез – только у пациенток с привычной потерей беременности – у 4 (14,3±6,7%) (р>0,05) (рис. 2).
В зависимости от особенностей общей и тканевой реактивности, продолжительности заболевания, наличия обострений и степени их выраженности, морфологическими критериями постановки диагноза «ХЭ» были:
- воспалительные инфильтраты, состоящие преимущественно из лимфоцитов, нейтрофильных лейкоцитов, расположенных чаще вокруг желез и кровеносных сосудов, реже диффузно;
- наличие плазматических клеток;
- альтерация стромы эндометрия, в том числе фиброз;
- склеротические изменения спиральных артерий;
- деформация желез;
- очаговая гиперплазия базального слоя [11, 12].
Нарушение рецепторного аппарата эндометрия выявлялось в 100% у всех бесплодных женщин и у 23 (82,1±7,4%) пациенток с невынашиванием беременности (р<0,05). Нарушение экспрессии андрогеновых рецепторов в эндометрии наблюдалось только у обследуемых во 2-й группе – у 8 (22,2±7,0%). Отмечено наличие яркой экспрессии эпидермального фактора роста только у женщин с невынашиванием беременности – у 4 (14,3±6,7%). Выраженная и умеренная экспрессия лимфоцитов встречалась у 20 (71,4±8,7%) женщин 1-й группы и у 24 (66,7±8,0%) 2-й группы (р>0,05).
При исследовании маркера пролиферативной активности Ki-67 нами выявлено усиление его экспрессии только у 4 (14,3±6,7%) пациенток с невынашиванием беременности.
В нашем исследовании были проведены попытки выявления связи тяжести ХЭ с учетом изменения уровней VEGF-A, PlGF и PDGF в сыворотке крови у женщин с бесплодием и невынашиванием беременности.
При анализе уровня человеческого PlGF в сыворотке крови женщин 1-й и 2-й групп выявлено его увеличение по сравнению с его нормативными показателями. Самый высокий результат наблюдался в 1-й группе и составил 1750,7064±29,43 пг/мл.
Самые низкие его значения выявлялись в группе контроля – 716,816±18,1 пг/мл. Это доказывает его роль в образовании новых сосудов, в процессах пролиферации и регенерации эндометрия (табл. 2).
Согласно полученным нами данным, уровень PDGF-BB в сыворотке крови тоже изменялся, но не выходил за пределы референсных значений. Максимальные его показатели наблюдались в контрольной группе и составили 2021,324±21,76 пг/мл, минимальные – в группе с привычной потерей беременности – 1234,482±32,12пг/мл. Это свидетельствует о его опосредованном участии в процессах хронического воспаления эндометрия.
Согласно данным литературы, при ХЭ имеет место увеличение VEGF [13]. Его показатели возрастают во время патологического ангиогенеза [14]. В нашей работе показатели VEGF-A также были увеличены, особенно в группе женщин с невынашиванием беременности, и составили 2412,973±31,81 пг/мл. У бесплодных пациенток данный показатель тоже увеличен – 2076,473±22,64 пг/мл. В группе контроля он высоко достоверно ниже – 1824,654±27,11 пг/мл, но превышает референсные значения. Это вероятно связано с неблагоприятным репродуктивным анамнезом в 3-й группе, описанным нами ранее: в данной группе присутствовали аборты, выкидыши, неразвивающиеся и внематочные беременности. Таким образом, изменение содержания факторов роста в сыворотке крови может служить дополнительным диагностическим критерием ХЭ.
На рис. 3 отражены изменения уровня факторов роста у женщин с ХЭ и нормальным эндометрием.
Самые существенные изменения морфологии эндометрия, выявлялись у пациенток с невынашиванием беременности. У этих же женщин регистрировались наиболее высокие показатели активности PIGF и VEGF-A. На наш взгляд это свидетельствует о том, что PIGF увеличивает VEGF-ассоциированный ангиогенез. Таким образом, согласно полученным нами данным, у женщин с бесплодием и невынашиванием беременности, ассоциированных с ХЭ, уровни PIGF и VEGF-A достоверно выше, чем у женщин с неизмененным эндометрием.
Выводы
- Наиболее значимые отклонения морфологической структуры эндометрия отмечались в группе женщин с невынашиванием беременности.
- При УЗИ изменение эхо-структуры эндометрия наблюдалось у 69% пациенток с бесплодием и привычной потерей беременности. Эхо-структура эндометрия у всех женщин контрольной группы не была изменена.
- Самый высокий уровень PIGF выявлен в 1-й группе – 1750,7064±29,43 пг/мл. Самые низкие его значения выявлялись в группе контроля – 716,816±18,1 пг/мл. Максимальные показатели уровня PDGF-BB в сыворотке крови наблюдались в 3-й группе – 2021,324±21,76 пг/мл, минимальные – в группе с привычной потерей беременности – 1234,482±32,12 пг/мл, но общие значения не выходили за пределы референсных значений. Показатели VEGF-A увеличены в 1-й группе женщин – 2412,973±31,81 пг/мл, минимальны в группе контроля – 1824,654±27,11 пг/мл.
- Имеет место увеличение PIGF и VEGF-A и снижение уровня PDGF-BB у женщин с ХЭ при бесплодии и невынашивании беременности.
- Заключая результаты исследования, необходимо отметить, что полученные нами данные, основанные на комплексной морфологической и иммуноферментной диагностике состояния имплантационного эндометрия, могут использоваться в клинической практике. Определение уровня PIGF и VEGF-A является одним из дополнительных методов оценки состояния эндометрия.



