По определению ВОЗ (1984), мастопатия представлена как фиброзно-кистозная болезнь (ФКБ), характеризующаяся нарушением соотношения эпителиального и соединительнотканного компонентов, широким спектром пролиферативных и регрессивных изменений тканей молочной железы [1].
Статистический учет ФКБ не ведется, но, по оценкам ряда авторов, ее частота в женской популяции составляет 50%, что позволяет обоснованно считать – именно эта группа заболеваний является самой распространенной патологией молочных желез [2–4].
В целом ФКБ не рассматривается как предраковое заболевание, однако многие ее формы существенно повышают риск развития рака молочной железы (РМЖ). У женщин с доброкачественными опухолями и высокой маммографической плотностью молочной железы риск развития РМЖ в 3 раза выше по сравнению с женщинами с умеренной маммографической плотностью и без доброкачественных опухолей молочной железы [5]. По-разному оцениваются риски развития РМЖ в зависимости от выявленных при биопсии молочной железы морфологических изменений. По различным оценкам, риск РМЖ незначительно повышен или равен популяционному при непролиферативной форме заболевания и повышен в 1,5–3,5 или в 2–10 раз по сравнению с популяционным при пролиферативных формах заболевания без атипии и с атипией соответственно [6, 7].
В связи с актуальностью оценки рисков РМЖ при ФКБ целесообразно было определить особенности экспрессионных профилей генов, которые принимают или могут принимать участие в неопластической трансформации. Более подробно функции этих генов и их роль в патогенезе заболеваний молочной железы будут рассмотрены при описании и обсуждении полученных результатов.
Цель настоящего исследования состояла в определении транскрипционных профилей генов и выявлении дифференциальных различий в экспрессии генов в зависимости от формы ФКБ.
Материалы и методы
Для реализации поставленной цели исследовано 128 образцов фиксированных в формалине парафинизированных (FFPE) тканей молочной железы, полученных в результате хирургического вмешательства в отделении патологии молочной железы ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России. Из них: 21 образец непролиферативной формы ФКБ, 40 образцов протоковой гиперплазии без атипии (typical ductal hyperplasia, TDH), 20 образцов атипичной протоковой гиперплазии (atypical ductal hyperplasia, ADH), 22 образца протоковой карциномы in situ (ductal carcinoma in situ, DCIS), а также 25 образцов нормальной ткани (табл. 1).
Образцы нормальных тканей у пациенток без рака были получены после редукционной (уменьшающей) маммопластики, когда по данным патоморфологического исследования операционного материала не были описаны какие-либо патологические изменения со стороны ткани молочной железы. Образцы тканей с типичной и атипичной пролиферацией у пациенток без рака были получены после выполнения инцизионной или core-биопсии при ФКБ. Образцы нормальной ткани, TDH, ADH, DCIS у больных РМЖ были получены из операционного материала на расстоянии от опухолевого узла.
Методом обратной транскрипции и полимеразной цепной реакции исследован широкий спектр генов, представленный в таблице 2. Реакцию ставили в двух повторах для каждого маркера, рассчитывали среднее значение Сt. Исследования проведены в соответствии с методикой, опубликованной нами ранее [8].
В соответствии с традиционным методом определения уровня экспрессии гена [9] по завершении амплификации уровень представленности транскриптов рассчитывали методом сравнения индикаторных циклов (метод ∆∆Ct) с нормировкой относительно нормировочного фактора, рассчитанного по референсным генам B2M, GUSB, и относительно значения медианы (Ме) уровня экспрессии маркера в группе образцов нормальной ткани в качестве референсного уровня. При такой нормировке медиана значения уровня экспрессии в нормальной ткани соответствует единице, относительно этого значения рассчитываются показатели экспрессии в образцах.
Статистический анализ
Статистический анализ данных осуществляли с помощью пакета программ IBM SPSS Statistics 17.0. В связи с несоответствием исследованных показателей нормальному распределению для оценки значимости межгрупповых различий применялся непараметрический U-критерий Манна–Уитни. Статистически значимыми считали различия при уровне р<0,05. В качестве меры центральной тенденции в группах исследования рассчитывали медиану (Me), учитывали также интерквартильный размах (Q1–Q5). Данные по группам исследования представлены в виде Me [Q1; Q3].
Результаты и обсуждение
По результатам исследования мРНК исследуемых генов при сравнении с нормальной тканью определены два принципиально разных транскрипционных профиля: с низкой (непролиферативная форма ФКБ) и высокой пролиферативной активностью (DCIS, ADH, TDH).
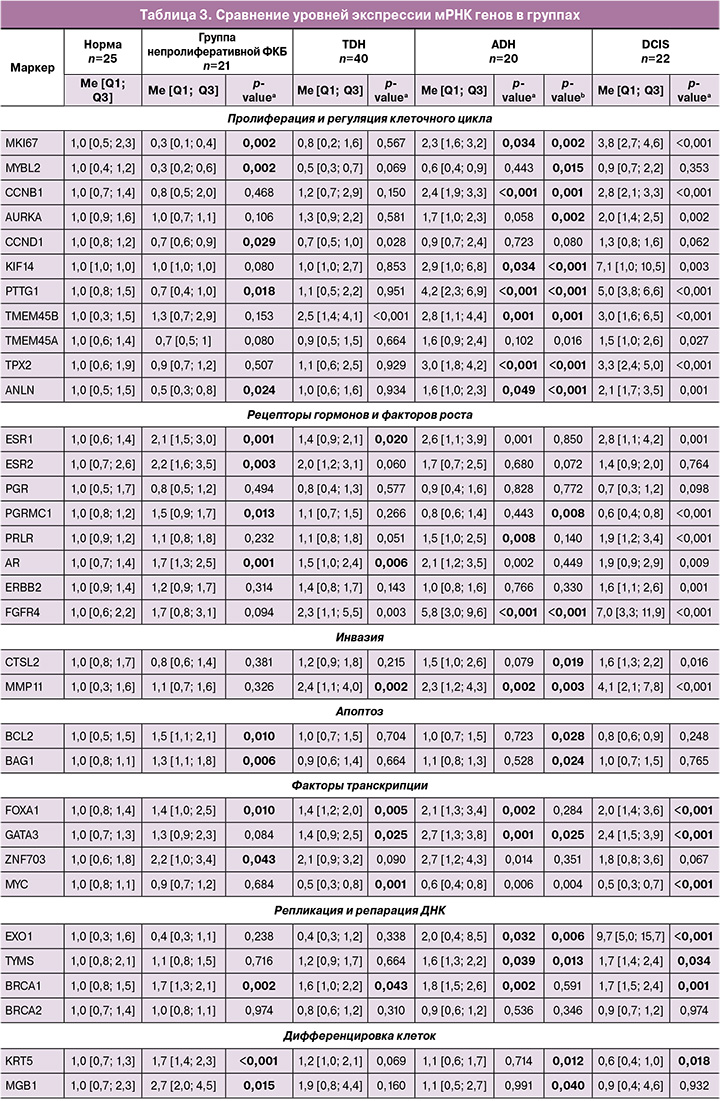
При непролиферативной форме ФКБ выявлены следующие статистически значимые изменения в экспрессии генов: повышение уровня экспрессии мРНК сульфатазы STS, гормональных рецепторов ESR1, ESR2, AR, прогестерон-ассоциированного мембранного компонента PGRMC1, факторов транскрипции ZNF703, FOXA1, генов апоптоза BCL2, BAG1, маркеров дифференцировки клетки MGB1, KRT5, а также гена гомологичной рекомбинации BRCA1, NAT1, PD-L1, OPG, CD68; снижение маркеров пролиферации (MKI67, MYBL2, CCND1, PTTG1, ANLN) и RANKL (рис. 1, табл. 3). Помимо этого, отмечена активация провоспалительного ответа (повышение IL1B).
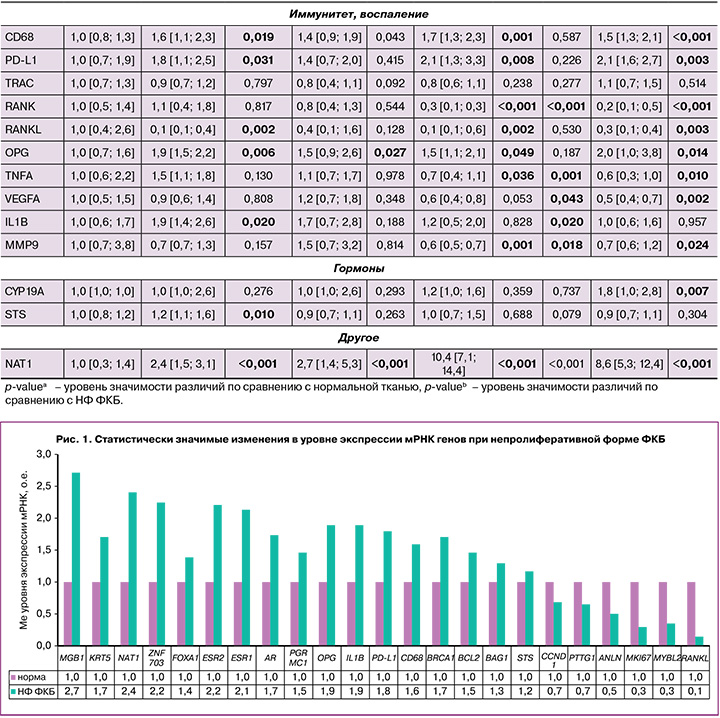
Экспрессия мРНК генов в группах TDH и ADH имела схожие с DCIS тенденции, более выраженные при атипии. В отличие от непролиферативной формы заболевания изменения транскрипционного профиля генов в группе ADH характеризовались статистически значимым повышением уровня экспрессии маркеров пролиферации (MKI67, KIF14, PTTG1, TPX2, TMEM45B, CCNB1, ANLN), репликации и репарации ДНК (EXO1, BRCA1, TYMS), факторов транскрипции GATA3, FOXA1, рецептора 4 фактора роста фибробластов FGFR4, матриксной металлопротеиназы MMP11, рецепторов гормонов (ESR1, AR, PRLR), а также PD-L1, OPG, CD68 и NAT1; статистически значимым понижением экспрессии мРНК генов иммунитета и воспаления MMP9, TNFA, RANK, RANKL, транскрипционного фактора MYС по сравнению с нормальной тканью (табл. 3, рис. 2).
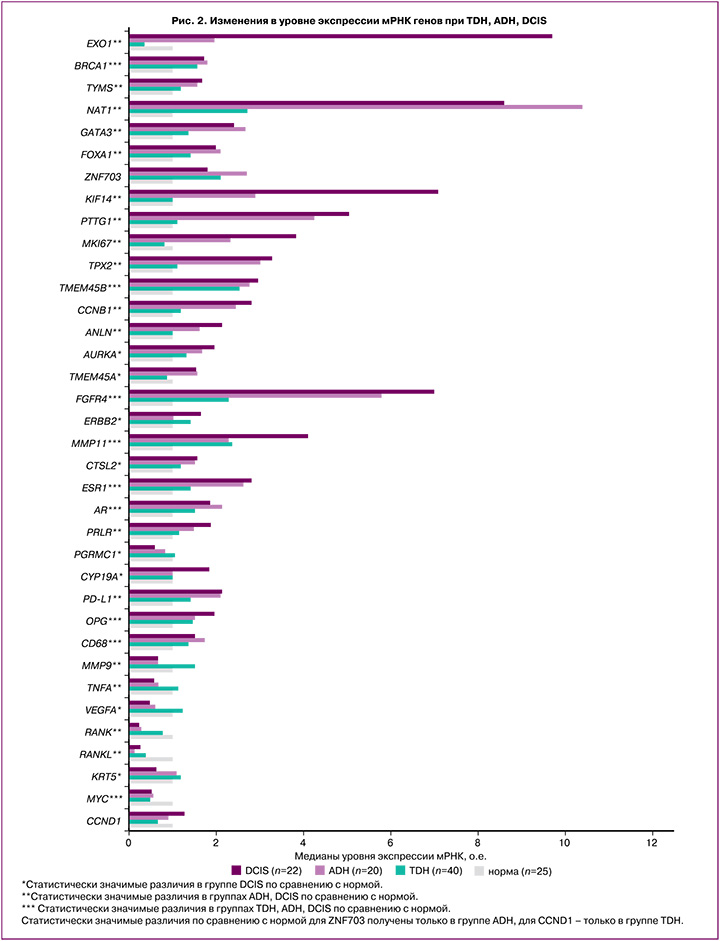
Экспрессия мРНК генов в группе TDH имела схожие с ADH тенденции, однако статистически значимые различия были получены для меньшего числа генов. Отмечено повышение уровня экспрессии мРНК маркера репарации ДНК BRCA1, факторов транскрипции GATA3, FOXA1, маркеров пролиферации TMEM45B, CCND1, рецептора факторов роста FGFR4, матриксной металлопротеиназы MMP11, рецепторов гормонов (ESR1, AR), а также OPG, CD68; статистически значимое понижение экспрессии мРНК гена MYC по сравнению с нормальной тканью (табл. 3, рис. 2).
Высокая пролиферативная активность сопровождалась повышением матриксной металлопротеиназы MMP11 в 2,4 (р=0,002), в 2,3 (р=0,002), в 4,1 (р<0,001) раза в группах TDH, ADH, DCIS соответственно, а также маркеров репликации и репарации ДНК (EXO1 в 2,0 (р=0,032), в 9,7 (р<0,001) раза и TYMS в 1,6 (р=0,039), в 1,7 раза (р=0,034) в группах ADH, DCIS соответственно). Повышение экспрессии мРНК гена гомологичной рекомбинации BRCA1 наблюдалось во всех группах исследования: в 1,7 (р=0,002) раза при непролиферативной форме ФКБ, в 1,6 (р=0,043), 1,8 (р=0,002), 1,7 (р=0,001) раза в группах TDH, ADH, DCIS соответственно.
Факторы репликации и репарации ДНК обеспечивают точный синтез ДНК в контрольных точках клеточного цикла, исправляя ошибки в последовательности нуклеотидов. В норме они являются «стражами генома» и предотвращают геномную нестабильность. При высокой пролиферативной активности контроль точности репликации ДНК усиливается. В то же время BRCA1 является полифункциональным белком, участвует в регуляции транскрипции, ремоделировании хроматина и убиквитинировании, осуществляет контроль клеточного цикла. Повышение мРНК BRCA1 при непролиферативной ФКБ может быть связано с его участием в процессах, отличных от гомологичной рекомбинации. В этой связи заслуживает внимания публикация Chiang H.C. еt al., в которой подробно рассматриваются и доказываются механизмы влияния BRCA1 на экспрессию ESR1 и транскрипцию генов, ответственных за дифференцировку люминального эпителия [10]; возможно именно эту функцию поддерживает BRCA1 при непролиферативных формах заболевания.
Вследствие увеличения соотношения эпителиального и соединительнотканного компонента при непролиферативной форме ФКБ мы наблюдаем повышение уровней экспрессии и цитокератина KRT5 в 1,7 раза (<0,001) и маммоглобина MGB1 в 2,7 раза (р=0,015) как маркеров дифференцировки люминального эпителия. Напротив, при карциноме in situ происходит понижение KRT5 в 1,6 раза (р=0,018) уже из-за потери дифференцировки эпителия.
Учитывая гормонозависимость ФКБ, нами были исследованы уровни экспрессии гормонов (STS – сульфатазы, СYP19A1 – ароматазы) и гормональных рецепторов (ESR1 – α-эстрогенового, ESR2 – β-эстрогенового, PGR – прогестеронового, AR – андрогенового, PRLR – пролактинового и прогестерон-ассоциированного мембранного компонента PGRMC1).
Статистически значимое повышение определено для STS в группе непролиферативной формы ФКБ в 1,2 раза (р=0,010), в также для CYP19A1 в группе DCIS в 1,8 раза (р=0,007). Ген сульфатазы STS кодирует белок гидролиза 3-бета-гидроксистероидных сульфатов, которые служат метаболическими предшественниками эстрогенов, андрогенов и холестерина. Ген ароматазы CYP19A1 кодирует белок цитохрома Р450, который катализирует последние этапы биосинтеза эстрогена.
Эстрогены играют одну из ключевых ролей в патогенезе заболеваний молочной железы и РМЖ, опосредуя свое действие через рецепторы как транскрипционные факторы сами по себе, так и через другие факторы, контролирующие активность генов, в том числе участвующих в росте или дифференцировке клеток. В группе непролиферативной формы наблюдалось статистически значимое повышение экспрессии и α, и β рецепторов эстрогенов в 2,1 (р=0,001) и 2,2 раза (р=0,003) соответственно; а в группах TDH, ADH и DCIS – только α-эстрогенового рецептора в 1,4 (р=0,020), 2,6 (р=0,001) и 2,8 (р=0,001) раза соответственно. Очевидно, такие изменения при пролиферативных процессах (группы TDH, ADH и DCIS) приводят к увеличению соотношения ESR1/ESR2, которое мы можем рассматривать как фактор риска неопластической трансформации. Родионова М.В. и соавт. в своей обзорной публикации отмечают, что эффект эстрогенов зависит от соотношения в клетке разных типов рецепторов; при этом β-эстрогеновые рецепторы могут подавлять функцию α рецепторов [11].
Как было показано для культуры клеток РМЖ человека, коэкспрессирующих оба типа эстрогеновых рецепторов, пролиферативный ответ при воздействии эстрогенов наблюдается только при низком уровне экспрессии β-эстрогеновых рецепторов [12].
Ранее в своей работе мы уже отмечали высокие и средние положительные корреляционные связи уровня экспрессии ESR1 c транскрипционными факторами FOXA1, GATA3, ZNF703 при РМЖ [8]. Эти транскрипционные факторы участвуют в клеточном ответе на стимуляцию эстрадиолом, в пролиферации, росте и дифференцировке клеток молочной железы. Полагают, что FOXA1, GATA-связывающий белок 3 (GATA3) и ESR1 ответственны за поддержание люминального фенотипа опухоли, а в модельных экспериментах продемонстрирован синергетический эффект ESR1 и FOXA1 на гены-мишени [13].
Статистически значимое повышение уровня экспрессии FOXA1 по сравнению с нормальной тканью наблюдалось во всех группах: в 1,4 раза (р=0,010) при непролиферативной форме ФКБ, в 1,4 (р=0,005), 2,1 (р=0,032), 2 (р<0,001) раза при TDH, ADH и DCIS соответственно. При этом TDH, ADH и DCIS характеризовались статистически значимым повышением уровня экспрессии мРНК GATA3 в 1,4 (р=0,025), 2,7 (р=0,001), 2,4 (р<0,001) раза соответственно, а непролиферативная форма и ADH – повышением ZNF703 в 2,2 (р=0,043) и в 2,7 (р=0,014) раза соответственно. ZNF703 более известен как маркер люминального В подтипа РМЖ, гиперэкспрессию которого в опухоли связывают с амплификацией гена [14].
В то же время наши представления о данном маркере претерпевают изменения. Методом иммуногистохимии показано, что 34,2% трижды негативных опухолей экспрессируют данный маркер, а нокдаун этого гена приводит к остановке клеточного цикла в G1-фазе [15].
Наше исследование является первым, в котором ZNF703 идентифицирован как потенциально важный маркер ФКБ.
Помимо ESR1, активация пролиферации может осуществляться посредством и других гормональных рецепторов. Во всех группах мы наблюдали статистически значимое повышение экспрессии мРНК андрогенового рецептора AR в 1,7 (р=0,001), 1,5 (р=0,006), 2,1 (р=0,002), 1,9 (р=0,009) раза соответственно для групп непролиферативной формы ФКБ, TDH, ADH и DCIS. В то время как повышенный уровень экспрессии мРНК пролактинового рецептора в 1,5 (р=0,008) и 1,9 (р<0,001) раза отмечен только в группах ADH и DCIS соответственно. Полагают, что пролактин (PRL) способствует как дифференцировке молочных желез, так и онкогенезу [16].
Экспрессия мРНК прогестерон-ассоциированного мембранного компонента PGRMP1 была статистически значимо выше при непролиферативной форме в 1,5 раза (р=0,013) раза и снижена в 1,7 раза (p<0,001) в группе DCIS. PGRMC1 является медиатором воздействия стероидных гормонов, в том числе эстрогенов и прогестерона, играет важную роль в яичниках и матке в поддержании женской фертильности и беременности. Его функция в молочной железе не выяснена в полной мере. Экспериментальные данные, полученные на мышах, свидетельствуют о том, что PGRMC1 необходим для развития молочных желез во время полового созревания и беременности вне зависимости от экспрессии прогестеронового рецептора [17].
Известно, что PGRMC1 значительно увеличивает эстрогензависимую пролиферацию клеток молочной железы, а для пациентов с РМЖ его высокая экспрессия ассоциирована с худшим прогнозом [18].
В литературе отсутствуют данные об экспрессии PGRMC1 при ФКБ. Полученные нами данные о повышенной экспрессии при непролиферативной форме ФКБ и пониженной – при DCIS вступают в противоречие с известной опосредованной PGRMC1 функцией эстроген-зависимой пролиферации. Вероятно, мы не вполне оцениваем роль и участие PGRMC1 в разнообразных биологических процессах. Известно, что PGRMC1 участвует в модуляции синтеза жирных кислот, связан с функционированием митохондрий, регуляцией гликолиза/глюконеогенеза, регуляцией опосредованного веретеном деления мейотического/митотического разделения хромосом, индукцией процессов созревания клеток и тканей, эпигенетической регуляцией метилирования CpG и упаковки генома и других [19]. В случае непролиферативной формы ФКБ повышенная экспрессия PGRMC1 может быть связана с его участием в процессах созревания люминального эпителия.
Усиливают пролиферативную активность и взаимодействия ростовых факторов со своими рецепторами. При пролиферативных формах ФКБ выявлено повышение экспрессии мРНК рецептора фактора роста фибробластов FGFR4: в 2,3 раза (р=0,003) при TDH, в 5,8 раза (p<0,001) при ADH, в 7 раз (p<0,001) при DCIS. FGFR4 является тирозинкиназой. Полагают, что ее аберрантная активация вследствие генетических изменений вовлечена в развитие и прогрессирование нескольких типов рака, включая РМЖ [20].
В качестве одной из потенциальных систем, контролирующих разрастание эпителия, мы также рассматривали RANKL/RANK/OPG. Эти соединения играют ключевую роль в регуляции дифференцировки остеокластов и обмене кальция. Система RANKL/RANK/OPG состоит из трех основных сигнальных молекул: активатора RANK, связывающегося с RANKL (рецепторный активатор ядерного фактора (NF) – kB-лиганд), и остеопротегерина (OPG). Взаимодействуя с RANKL, RANK активирует остеокласты. OPG представляет собой растворимый рецептор и выполняет роль негативного регулятора данной системы, конкурируя с RANK за связывание с его лигандом (RANKL). Взаимодействуя с RANKL, остеопротегерин ингибирует активацию остеокластов, а также стимулирует апоптоз остеокластов in vitro. Каскад RANK является важным регулятором взаимодействия между дендритными и Т-клетками Т-клеточного иммунного ответа. Особую роль данная система имеет в физиологии молочных желез, в частности для гормонально-зависимого разрастания эпителия во время беременности. Некоторые данные свидетельствуют о том, что прогестерон индуцирует RANKL в молочной железе. В свою очередь, RANKL контролирует пролиферацию клеток эпителия молочной железы при физиологических условиях, связанных с более высоким уровнем прогестерона в сыворотке, таких как лютеиновая фаза менструального цикла и беременность [21].
Система RANKL/RANK рассматривалась нами как возможный нижестоящий медиатор прогестеронового воздействия, направленного на пролиферацию эпителиальных клеток молочной железы, потенциально способствующего инициации и прогрессированию патологических процессов в молочной железе.
Данный путь активации пролиферации эпителия, вероятно, не был задействован. Вопреки ожиданиям, получено статистически значимое снижение мРНК RANK в 3,6 (p<0,001), 3,3 (p<0,001) раза в группах ADH и DCIS соответственно и RANKL в 2,6 (p=0,002), 7,8 (p=0,002), 3,8 (p=0,003) раза в группах непролиферативной формы ФКБ, ADH, DCIS соответственно. Статистически значимое повышение уровня экспрессии мРНК остеопротегерина OPG в 1,9 (p=0,006), 1,5 (p=0,027), 1,5 (p=0,049), 2 (p=0,014) раза в группах непролиферативной формы заболевания, TDH, ADH, DCIS соответственно, что скорее указывает на участие данной системы в апоптозе. Повышены при непролиферативной форме ФКБ и другие маркеры апоптоза – BCL2 и BAG1 в 1,5 (р=0,010) и 1,3 (р=0,010) раза соответственно.
Одно из самых заметных изменений в уровне экспрессии мы наблюдали для гена ариламин-N-ацетилтрансферазы NAT1 во всех группах исследования по сравнению с нормальной тканью. Определено повышение экспрессии мРНК NAT в 2,4 (p<0,001), 2,7 (p<0,001), 10,4 (p<0,001), 8,6 (р<0,001) раза в группах непролиферативной формы ФКБ, TDH, ADH, DCIS соответственно. NAT1 является ферментом, метаболизирующим лекарственные средства. Можно было бы предположить влияние препаратов, используемых во время операции, но все ткани подвергались данному воздействию, включая контроль, а изменения неидентичны. Полагают, что NAT1 влияет на пролиферацию, выживаемость опухолевых клеток, способствует инвазии как in vitro, так и in vivo; однако точные механизмы данного влияния не установлены [22].
Интересно, что при исследовании 1904 образцов опухолей молочной железы Li P. et al. обнаружили отрицательную корреляционную связь между экспрессией NAT1 и MMP9 [23].
В нашей работе при ADH и DCIS отмечено снижение мРНК MMP9 в 1,5 раза на фоне существенного повышения экспрессии мРНК NAT1, что согласуется с данными Li P. et al. [23].
При планировании работы мы прогнозировали повышение MMP9. Как и другие матриксные металлопротеиназы, MMP9 может играть существенную роль в инвазии опухолей, поскольку она отвечает за деградацию внеклеточного матрикса вблизи от пролиферирующих опухолевых клеток. MMP9 обнаруживается более чем в 97% инвазивных карцином протоков; ее экспрессия увеличивается при нарастании гистологической степени злокачественности [24].
Помимо этого, MMP9 может рекрутировать воспалительные клетки, которые усиливают прогрессирование опухоли [25], и играет роль в ангиогенезе опухоли [26].
С учетом наших результатов, вероятно, при ФКБ и на ранних этапах канцерогенеза MMP9 не задействована в патологических процессах. Снижение активности MMP9 в группах ADH и DCIS, по нашим данным, сопровождается снижением уровней экспрессии мРНК фактора некроза опухолей TNFA в 1,5 (p=0,036), 1,7 (p=0,010) раза соответственно, а также фактора роста эндотелия сосудов VEGFA в 2,1 раза (p=0,002) при DCIS. Полученные результаты согласуются с работами Vandooren J. [25] и Vu T.H. [26].
Провоспалительный фон отмечен только при непролиферативной форме ФКБ, что ассоциируется с повышением экспрессии мРНК IL1B в 1,9 раза (р=0,020). Во всех группах, по-видимому, происходило рекрутирование макрофагов, что нашло отражение в повышении уровня экспрессии мРНК СD68 в 1,6 (р=0,019), 1,4 (р=0,043), 1,7 (р=0,001), 1,5 (р<0,001) раза в группах непролиферативной формы заболевания, TDH, ADH и DCIS соответственно. При этом выраженного рекрутирования Т-клеток, вероятно, не происходило, статистически значимых изменений уровня экспрессии α-цепи Т-клеточного рецептора (TRAC) не выявлено. Более того, при непролиферативной форме, ADH и DCIS наблюдалось статистически значимое повышение уровня экспрессии PD-L1 в 1,8 (p=0,031); 2,1 (p=0,008), 2,1 (p=0,003) раза соответственно. PD-L1 экспрессируется в основном на антиген-презентирующих клетках иммунной системы, участвуя в норме в механизмах формирования аутотолерантности. Его экспрессия также определена и на опухолевых клетках. PD-L1 блокирует избыточную активацию эффекторных Т-лимфоцитов путем взаимодействия с рецептором PD-1 – белком программируемой гибели клеток. Повышение экспрессии белка PD-L1 позволяет клеткам избежать иммунного ответа организма. В случае онкологии это способствует высокой агрессивности опухолей и увеличивает риск летального исхода. Взаимодействие PD-L1 с PD-1 приводит к уменьшению пролиферации клеток, несущих PD-1, снижению выработки ими цитокинов и цитолитической активности, индуцирует апоптоз Т-лимфоцитов, что приводит к функциональной инактивации или истощению Т-клеток, а вследствие этого – подавлению противоопухолевой иммунной реакции [27, 28].
При сравнении группы ADH и непролиферативной ФКБ как форм с максимальным и минимальным риском развития РМЖ статистически значимое повышение экспрессии мРНК при ADH отмечено для 17 генов, понижение – для 10 генов по сравнению с непролиферативной формой ФКБ (табл. 3).
Подводя итоги, в качестве маркеров, отличающих пролиферативную форму заболевания с атипией от непролиферативных форм ФКБ и нормы, отобраны 18 генов, маркирующих группу высокого риска неопластической трансформации: MKI67, CCNB1, KIF14, PTTG1, ANLN, TMEM45B, TPX2, PRLR, FGFR4, MMP11, GATA3, EXO1, TYMS, NAT1, MYC, RANK, TNFA, MMP9 (рис. 3).

Экспрессия мРНК 9 генов (AURKA, TMEM45A, PGR, ERBB2, CTSL2, BRCA2, TRAC, VEGFA, CYP19A) не имела статистически значимых различий в нормальной ткани, при непролиферативных формах ФКБ и ADH. Экспрессия мРНК 14 генов (ССNB1, KIF14, TMEM45B, TPX2, PRLR, FGFR4, MMP11, GATA3, MYC, EXO1, TYMS, RANK, TNFA, MMP9) не имела статистически значимых различий в нормальной ткани и при непролиферативных формах ФКБ. Экспрессия мРНК 10 генов (MYBL2, CCND1, ESR2, PGRMC1, BCL2, BAG1, KRT5, MGB1, IL1B, STS) не имела статистически значимых различий в нормальной ткани и при ADH. Экспрессия мРНК 9 генов (ESR1, AR, FOXA1, ZNF703, BRCA1, CD68, PD-L1, RANKL, OPG) не имела статистически значимых различий в группах НП ФКБ и ADH.
Заключение
При исследовании транскрипционных профилей генов в образцах тканей молочной железы при различных формах ФКБ наиболее выраженные изменения в экспрессии генов были отмечены для атипичной протоковой гиперплазии (ADH). При пролиферативной с атипией форме ФКБ, обладающей наибольшим риском развития РМЖ, определены 18 генов с дифференциальной экспрессией. Профиль транскрипции мРНК в группе TDH имел схожие с ADH тенденции, но менее выраженные, с изменением в уровне экспрессии значительно меньшего числа генов. Профиль экспрессии в образцах тканей с непролиферативной формой ФКБ был противоположным и характеризовался высоким уровнем транскрипционной активности, дифференцировки клеток, гормональной рецепции, апоптоза, провоспалительного иммунного ответа на фоне снижения пролиферативной активности.



