Работа частично поддержана Государственным контрактом Министерства образования и науки РФ №16.522.12.2009 от 29.09.2011.
Одним из приоритетных направлений в современной неонатологии является выхаживание недоношенных детей с очень низкой (ОНМТ) и экстремально низкой массой тела (ЭНМТ) при рождении. Данный контингент больных находится в зоне максимального риска по развитию нозокомиальных инфекций. C одной стороны, это связано с незавершенностью процессов формирования иммунного ответа у глубоко недоношенных детей, необходимостью длительного применения различных видов респираторной поддержки, постановки центральных сосудистых катетеров, осуществления большого числа заборов крови и других инвазивных процедур, с другой стороны, с особенностями госпитальной флоры, вносящей существенный вклад в реализацию нозокомиальных инфекций у новорожденных[1].
Возбудителями госпитальных инфекций являются условно-патогенные микроорганизмы (УПМ). Они широко распространены, устойчивы во внешней среде, а также обладают способностью к образованию биопленок [2]. В процессе антимикробной терапии условно-патогенные микроорганизмы приобретают резистентность к применяемым антибактериальным препаратам. Существенное значение в реализации инфекционных процессов среди пациентов реанимационных отделений придается группе так называемых ESKAPE-патогенов, к которым относятся Enterococcus faecium, Staphylococcus aureus, Klebsiella pneumoniae, Acinetobacter baumanii, Pseudomonas aeruginosa, Enterobacter spp. [3].
Не вызывает сомнений также тот факт, что идентификация инфекционного агента является ключевым фактором в определении тактики проведения целенаправленной антибактериальной терапии или, напротив, ее отмены в случае отсутствия возбудителя.
Таким образом, именно с целью слежения за циркулирующей госпитальной микрофлорой, а также для обеспечения своевременной и быстрой идентификации возможных возбудителей врожденных и нозокомиальных инфекций в отделении реанимации и интенсивной терапии новорожденных (ОРИТН) ФГБУ НЦАГиП им. В.И. Кулакова уже в течение 20 лет ведется регулярный микробиологический мониторинг, включающий выполнение дважды в неделю новорожденным посевов со слизистых оболочек (кал, зев), начиная с рождения. При наличии показаний дополнительно проводятся посевы отделяемого из трахеи, крови, мочи, ликвора, асцитической и плевральной жидкостей, отделяемого пупочной ранки, поврежденной кожи, конъюнктивы и других локусов.
 Знание особенностей ESKAPE-патогенов и других УПМ, циркулирующих в реанимационном отделении, позволяет своевременно реагировать на клинически выраженное ухудшение состояния пациентов и назначать адекватную антибактериальную терапию [4, 5].
Знание особенностей ESKAPE-патогенов и других УПМ, циркулирующих в реанимационном отделении, позволяет своевременно реагировать на клинически выраженное ухудшение состояния пациентов и назначать адекватную антибактериальную терапию [4, 5].
Основанием для исследования посевов материала из нестерильных локусов является широко известный феномен транслокации УПМ со слизистых оболочек в кровь и во внутренние органы [6–8] и наличие возможной причинно-следственной связи между патогенной флорой, контаминирующей ребенка, и инфекционным процессом.
В различных учреждениях в зависимости от уровня оснащенности микробиологических лабораторий результаты выполненных посевов могут быть получены в интервале от 3 до 10 дней. Позднее получение результатов микробиологических исследований приводит к запаздыванию старта этио-патогенетической антибактериальной терапии, к выбору неоптимальной схемы антибактериальной терапии, неоправданно широкому применению антибиотиков резерва, что, в свою очередь, в дальнейшем приводит к нарастанию мультирезистентности микроорганизмов [4, 7].
Наряду с традиционным выделением возбудителей микробиологическими методами в последние годы все большую актуальность приобретает использование молекулярно-генетических методов для более быстрой идентификации патогенов, способных вызывать течение инфекционного процесса у новорожденных, в том числе недоношенных детей с ЭНМТ и ОНМТ, находящихся в условиях отделения реанимации. Проведение полимеразной цепной реакции (ПЦР) в режиме реального времени позволяет идентифицировать возбудителя в биологическом материале в течение нескольких часов [9–12]. Вместе с тем, в силу относительной новизны методики, а также изменчивости микробного пейзажа стационаров, роль и клиническая значимость метода ПЦР в режиме реального времени в практике неонатальной реанимации до настоящего времени полностью не определена.
Таким образом, целью нашей работы было определение роли и клинической значимости метода ПЦР с детекцией результатов в режиме реального времени в диагностике врожденных и нозокомиальных инфекций у пациентов ОРИТН в периоде новорожденности.
Материал и методы исследования
В данное исследование были включены 68 детей различной массы и гестационного возраста, госпитализированных в ОРИТН ФГБУ НЦАГиП им. академика В.И. Кулакова за период с января по сентябрь 2012 года, которым наряду со стандартными микробиологическими посевами, осуществлявшимися в рамках микробиологического мониторинга в отделении, проводилась также ПЦР в режиме реального времени для идентификации возможных возбудителей.
Были проанализированы 272 параллельно выполненных исследования (клинический материал забирали в одни и те же дни) по выявлению бактериальных агентов молекулярно-генетическим (ПЦР в режиме реального времени) и микробиологическим методами.
 Материал для проведения плановых микробиологических исследований со слизистой зева и ануса новорожденных брали стерильными одноразовыми ватными тампонами и помещали в пробирку с транспортной средой Эймс с активированным углем. При наличии показаний получали отделяемое трахеи (в случае проведения искусственной вентиляции легких), кровь и другой биоматериал. Посевы крови и других в норме стерильных жидкостей проводили с использованием коммерческих флаконов с питательной средой для культивирования в автоматическом гематологическом анализаторе Bact/Alert (BioMerieux, США).
Материал для проведения плановых микробиологических исследований со слизистой зева и ануса новорожденных брали стерильными одноразовыми ватными тампонами и помещали в пробирку с транспортной средой Эймс с активированным углем. При наличии показаний получали отделяемое трахеи (в случае проведения искусственной вентиляции легких), кровь и другой биоматериал. Посевы крови и других в норме стерильных жидкостей проводили с использованием коммерческих флаконов с питательной средой для культивирования в автоматическом гематологическом анализаторе Bact/Alert (BioMerieux, США).
Показаниями для взятия крови на бактериологическое исследование были: дыхательные нарушения у детей при рождении, требующие проведения различных видов респираторной поддержки; клиническое ухудшение состояния новорожденных, связанное с развитием инфекционного процесса.
Для выполнения посевов использовались следующие питательные среды: 5% кровяной агар, среды Эндо и Сабуро, сахарный бульон. В течение 24–48 ч оценивалось наличие или отсутствие роста микроорганизмов. Идентификацию выделенных штаммов осуществляли параллельно двумя методами: по биохимическим показателям с использованием автоматического анализатора Vitec2Compact (BioMerieux, США) и протеомными методами с помощью масс-спектрометрии на масс-спектрометрометре AutoflexIII MALDI TOF MS (Bruker Daltonics, Германия) с программным обеспечением MALDI Biotyper.
Молекулярно-генетическое исследование крови и иных биологических жидкостей проводили методом ПЦР с детекцией результатов в режиме реального времени. Материал для проведения ПЦР-анализа собирали со слизистой зева, из ануса новорожденных и при наличии показаний из других локусов путем соскоба. Биоматериал помещали в пробирки с 500 мкл транспортной среды для биопроб (изотонический водно-солевой раствор с консервантом для соскобов, мазков) («ДНК-Технология», Россия). Кровь для проведения ПЦР-диагностики забирали в стандартную пробирку с ЭДТА в количестве 0,5 мл путем пункции интактной вены.
Нуклеиновые кислоты выделяли с помощью набора «Проба ГС» («ДНК-Технология», Россия) согласно инструкции. Амплификацию проводили на детектирующем амплификаторе ДТ-96 с использованием коммерческих реактивов («ДНК-Технология», Россия) согласно инструкции. Определяли следующие микробные агенты: Staphylococcus spp., Staphylococcus aureus, Streptococcus spp., Streptococcus agalactiae, Streptococcus pyogenes, Streptococcus pneumoniae, Enterococcus spp., Enterobacteriaceae, Escherichiae coli, Klebsiella pneumoniae/Klebsiella oxytoca, Enterobacter cloacae, Pseudomonas aeruginosa, Proteus spp., Acinetobacter spp., Stenotrophomonas maltophilia, Citrobacter frendii, Burkholderia spp., Haemophilus spp.
Под spp. подразумевается группа микроорганизмов, которые относятся к данному роду, но могут не соответствовать роду в его систематическом понимании.
Результаты исследования
Спектр основной патологии среди детей, включенных в исследование, представлен в табл. 1.
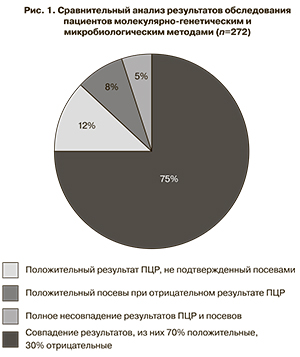 Совпадение результатов микробиологических посевов и проведенной ПЦР-диагностики было выявлено в 75% случаев (204 исследования), в 70% из которых (142 исследования) возбудитель был идентифицирован, а в 30% случаев (62 исследования) молекулярно-генетические и микробиологические методы дали отрицательный результат. Детекция возбудителя методом ПЦР, не подтвержденная последующими микробиологическими посевами, определялась в 34 исследованиях (12%). Положительные микробиологические посевы при отрицательной ПЦР-диагностике были получены в результате 23 исследований (8%).
Совпадение результатов микробиологических посевов и проведенной ПЦР-диагностики было выявлено в 75% случаев (204 исследования), в 70% из которых (142 исследования) возбудитель был идентифицирован, а в 30% случаев (62 исследования) молекулярно-генетические и микробиологические методы дали отрицательный результат. Детекция возбудителя методом ПЦР, не подтвержденная последующими микробиологическими посевами, определялась в 34 исследованиях (12%). Положительные микробиологические посевы при отрицательной ПЦР-диагностике были получены в результате 23 исследований (8%).
Полное несовпадение полученных результатов регистрировалось в 11 исследованиях (5%) (рис. 1).
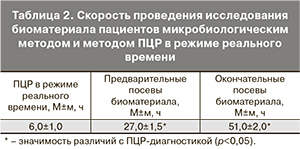
Нами была оценена скорость получения результатов традиционного микробиологического исследования и исследования биоматериала пациентов методом ПЦР в режиме реального времени. Данные о сроках получения результатов анализов представлены в табл. 2.
Из таблицы видно, что результаты идентификации микроорганизмов методом ПЦР в режиме реального времени были получены врачами в 4 раза быстрее, чем результаты идентификации чистой культуры при микробиологическом исследовании (предварительные посевы) и в 8 раз быстрее, чем окончательные результаты микробиологического исследования с получением антибиотикограммы выделенных микроорганизмов.
Мы оценили значимость ПЦР-диагностики в ситуациях стремительного клинико-лабораторного ухудшения состояния новорожденных за счет нарастания инфекционного процесса в том временном интервале, когда результаты ПЦР-диагностики уже были получены, а результаты микробиологической диагностики были неизвестны, так как находились еще в работе. Среди возбудителей методом ПЦР наиболее часто детектировались: Staphylococcus spp. с геном метициллинрезистентности, в единичных случаях встречались Klebsiella spp., Acinetobacter spp., Stenotrophomonas maltophilia, Burkholderia spp. Исходя из существующих в настоящее время подходов к лечению [4, 7], этим пациентам требовалась смена антибактериальной терапии.
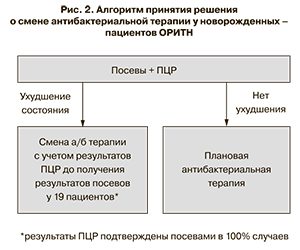
При ухудшении клинического состояния новорожденных и при получении положительных результатов ПЦР-диагностики меняли антибактериальную терапию. Число таких детей составило 19, и на протяжении их пребывания в ОРИТН им было осуществлено 25 смен антибактериальной терапии. Следует подчеркнуть, что принятие решения об изменении антибактериальной терапии врачами и клиническим фармакологом Центра основывалось не только на данных молекулярно-генетической и микробиологической диагностики, но, в первую очередь, на клиническом ухудшении и нарастании лабораторных маркеров инфекционного процесса. В случае отсутствия отрицательной динамики в клинико-лабораторном статусе детей антибактериальная терапия не менялась. Схема выбора терапевтической тактики представлена на рис. 2.
Полученные позднее результаты бактериальных посевов полностью подтвердили результаты ПЦР-диагностики, а также правильность выбранной антибактериальной терапии.
Обсуждение
Учитывая совпадение в 75% случаев результатов проведенной одновременно ПЦР-диагностики и микробиологической диагностики образцов биоматериала из идентичных локусов, метод ПЦР в режиме реального времени следует признать достаточно информативным в диагностике нозокомиальных инфекций среди детей, находящихся на лечении в ОРИТН. Несовпадение полученных результатов может быть объяснено рядом причин. Положительные результаты ПЦР-диагностики, не подтвержденные впоследствии результатами микробиологических посевов, могут являться как ложно, так и истинно положительными. Ложноположительные результаты могут быть обусловлены загрязнением используемых для работы реагентов (контаминацией), а истинно положительные результаты, вероятно, связаны с более высокой чувствительностью молекулярно-генетических методов исследования. Напротив, положительные результаты микробиологических посевов при отрицательных результатах ПЦР-диагностики могут быть связаны как с неточностью микробиологической идентификации микроорганизмов, так и с недостаточной чувствительностью отдельных молекулярно-генетических тест-систем.
B. Lucignano и соавт. показали, что метод ПЦР служит весьма ценным дополнением к микробиологическому исследованию крови у детей для диагностики инфекций кровотока, позволяя сократить время исследования до 6 ч и увеличить вероятность обнаружения возбудителя при низкой концентрации микроорганизмов в культуре крови [13]. Остается открытым вопрос, насколько колонизация пациента и наличие микроорганизмов в нестерильных локусах напрямую связаны с течением инфекционного процесса и необходимостью назначения антибактериальной терапии. По нашему мнению, лишь комплекс факторов, а именно: клинические признаки инфекционного токсикоза, повышение уровня маркеров течения воспалительного процесса (лейкоцитоз, нейтрофилез, увеличение значений С-реактивного белка и прокальцитониновый тест) наряду с идентификацией УПМ в нестерильных локусах может свидетельствовать о наличии прямой причинно-следственной связи между выявленным возбудителем и течением инфекционного процесса. Именно такая клиническая ситуация должна, по нашему мнению, являться предпосылкой для назначения или оптимизации проводимой антибактериальной терапии. При отсутствии необходимости быстрого принятия решения о смене антибактериальной терапии на результаты ПЦР-диагностики как самостоятельного метода без подтверждения его микробиологическим тестом ориентироваться не следует.
 Не следует забывать, что проведение ПЦР-диагностики предполагает количественное определение специфических фрагментов ДНК возбудителей, что не всегда предполагает наличие живой формы патогенов [13]. Микробиологический метод, напротив, выявляет только живые микроорганизмы. Преимущество микробиологического метода заключается в возможности выявления любых микроорганизмов, способных к росту на определенных стандартами питательных средах, тогда как при ПЦР-методе спектр идентифицируемых микроорганизмов определяется набором специфических праймеров, входящих в состав используемой диагностической панели. Определение чувствительности возбудителя к антимикробным препаратам также является преимуществом микробиологического метода, поскольку результаты антибиотикограммы являются основным опорным фактом при проведении антибактериальной терапии.
Не следует забывать, что проведение ПЦР-диагностики предполагает количественное определение специфических фрагментов ДНК возбудителей, что не всегда предполагает наличие живой формы патогенов [13]. Микробиологический метод, напротив, выявляет только живые микроорганизмы. Преимущество микробиологического метода заключается в возможности выявления любых микроорганизмов, способных к росту на определенных стандартами питательных средах, тогда как при ПЦР-методе спектр идентифицируемых микроорганизмов определяется набором специфических праймеров, входящих в состав используемой диагностической панели. Определение чувствительности возбудителя к антимикробным препаратам также является преимуществом микробиологического метода, поскольку результаты антибиотикограммы являются основным опорным фактом при проведении антибактериальной терапии.
Высокая скорость идентификации возбудителей с помощью ПЦР (в пределах 6 ч от момента забора биоматериала) позволяет «работать с опережением», усилить санитарно-эпидемиологический режим в отделении и сразу по получении результатов анализов в случае необходимости предпринять меры по «виртуальной» или же реальной изоляции пациента.
Таким образом, на основании полученных результатов можно сделать следующие выводы:
- Метод ПЦР в режиме реального времени может быть использован как метод экстренной диагностики возбудителей инфекционных заболеваний и УПМ в ситуациях стремительного клинико-лабораторного ухудшения состояния новорожденных, а также как уточняющий метод в случае затруднения микробиологической идентификации выделенной культуры.
- Микробиологический метод целесообразно использовать для изучения особенностей микробного пейзажа стационара, эпидемиологических наблюдений за динамикой антибиотикочувствительности с целью предотвратить формирование эпидемических вариантов возбудителей. Микробиологический мониторинг позволяет на основании знания наиболее вероятной чувствительности к антибиотикам выявленных микроорганизмов выбрать адекватную антибактериальную терапию в условиях дефицита времени при стремительном ухудшении состояния пациента до момента получения антибиотикограммы.
- Сочетание молекулярно-генетического и микробиологического методов диагностики в условиях стационара позволяет существенно повысить скорость и точность принятия клинических решений.
Заключение
Применение молекулярно-генетических методов является современным, мощным и клинически востребованным инструментом в диагностике внутриутробных и нозокомиальных инфекций у детей с ЭНМТ и ОНМТ. Метод ПЦР-диагностики в режиме реального времени является высокоточным, более быстрым в сравнении с применяемым традиционно микробиологическим методом и может быть рекомендован для рутинной практики при совместном его использовании с традиционным микробиологическим методом при осуществлении инфекционного контроля в отделениях неонатологического профиля.



