По данным отечественных и зарубежных авторов, частота фетальной макросомии (ФМ) составляет в среднем 9–10%, в отдельных этнических группах может достигать 36% [1–4]. Роды при ФМ характеризуются высокой частотой аномалий родовой деятельности, клинически узкого таза, разрывов промежности 3–4 степени [5], гипотонических кровотечений. ФМ способствует увеличению частоты индукции родов, кесарева сечения (КС) и инструментального родоразрешения [6]. Среди неонатальных осложнений следует отметить дистоцию плечиков [7], переломы трубчатых костей, повреждение плечевого сплетения, острую гипоксию плода, электролитные и метаболические нарушения [8, 9].
Большинство исследователей под термином «крупный плод», или «фетальная макросомия», понимают массу тела при рождении более 4000 г [10]. Новорожденных с массой тела при рождении более 90 перцентиля для данного гестационного срока называют крупновесными к сроку гестации [11, 12].
Ключевым фактором, определяющим развитие ФМ, является нарушение углеводного и жирового обмена в материнском организме. Принимая во внимание распространенность гестационного сахарного диабета (ГСД) среди всех диабетических беременностей (86%) и высокую частоту развития ФМ при ГСД (15–45%), данная проблема является предметом научного интереса среди исследователей [13, 14]. Тем не менее результаты проведенных исследований показали положительную корреляционную зависимость между уровнем триацилглицеридов (ТАГ), жирных кислот и массой плода у беременных при контролируемом ГСД [14, 15]. Это дает основание считать, что уровни липидов оказывают немаловажное влияние на развитие ФМ.
Особый интерес представляют исследования в области липидомики – науки, занимающейся количественным анализом всего разнообразия липидов (липидома) в биологической системе. К современным методам исследования липидома относится масс-спектрометрия, которая позволяет идентифицировать липиды и определять их относительный уровень в образце. В настоящее время изучение липидома крови рассматривается в качестве доступного и перспективного объекта исследования для ранней диагностики макросомии у беременных [16].
Таким образом, актуальным является поиск биомаркеров для раннего прогнозировании ФМ. Разработка алгоритма ведения данных пациенток позволит сформировать группы высокого риска развития ФМ для тщательного клинического и диагностического мониторинга, внедрить профилактические и терапевтические мероприятия, направленные на снижение частоты ФМ, тем самым улучшить материнские и перинатальные исходы.
Цель данного исследования — оценить отличия липидома сыворотки крови, взятой на различных сроках беременности, между пациентками, у которых развилась или не развилась макросомия плода.
Материалы и методы
В проспективное когортное исследование, проводившееся в 2017–2018 гг. в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, были включены 950 женщин в возрасте от 18 до 45 лет, проходивших пренатальный скрининг I триместра беременности. После подписания информированного согласия пациенткам выполняли забор крови из кубитальной вены в трех сроках: 11–14 недель, 24–28 недель, 30–32 недели беременности. Критерии включения в исследование: возраст пациенток 18–45 лет, европеоидная раса, одноплодная беременность, подписанное информированное согласие. Критерии невключения: многоплодная беременность, сахарный диабет (СД) 1 и 2 типа, преэклампсия (ПЭ), наличие любой соматической патологии в стадии декомпенсации, онкологические заболевания, аутоиммунные заболевания, преждевременные роды, новорожденные, маловесные к сроку гестации. Из исследования были исключены пациентки, с которыми была потеряна связь, не прошедшие пероральный глюкозотолерантный тест в сроки 24–28 недель, пропустившие хотя бы 1 сдачу крови в соответствии с установленными сроками. В результате 120 пациенток соответствовали установленным критериям и были отобраны для последующего масс-спектрометрического анализа. Они составили 2 группы в зависимости от массы ребенка при рождении: 1-я группа – пациентки с ФМ (m>4000 г, n= 40), 2-я группа – с нормальной массой тела новорожденного (m=2501–3999 г, n=80). Каждая группа была разделена на две подгруппы (1а; 1 б; 2 а; 2 б) в зависимости от наличия или отсутствия ГСД. В подгруппу 1а были включены пациентки с ФМ без ГСД (n=30), 1б – с ФМ и наличием ГСД (n=10); подгруппа 2а включала здоровых пациенток с нормальной массой тела ребенка при рождении (контроль, n=50), подгруппу 2б составили пациентки с нормальной массой плода и ГСД (n=30). Полуколичественная оценка уровней липидов сыворотки крови (n=360) выполнена методом масс-спектрометрии с ионизацией электрораспылением.
Достаточность объема выборки определяли с помощью следующей формулы:
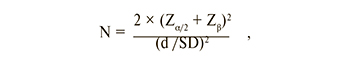
где N – объем выборки; Zα/2 и Zβ – значения нормального распределения при вероятности α/2 и β соответственно; d – разность групповых средних значений; SD – среднеквадратическое отклонение. Уровень значимости выбрали равным 0,05, мощность критерия – 0,8. При этих условиях Zα/2 + Zβ = 2,8. Метод масс-спектрометрии с электрораспылением позволяет получать результат с относительным среднеквадратическим отклонением порядка 10%. Величину отношения d/SD в данном исследовании выбрали равной 1,3. Отсюда размер выборки должен быть не меньше n=10 человек в каждой группе.
Комплексное обследование женщин включало сбор клинико-анамнестических данных, проведение перорального глюкозотолерантного теста в сроки 24–28 недель. ГСД диагностировали с помощью глюкозотолерантного теста с 75 г глюкозы между 24–28 неделями беременности, согласно рекомендациям Международной ассоциации по изучению диабета во время беременности (IADPSG), если ГСД не был верифицирован ранее.
Cыворотку крови центрифугировали 10 минут при 700 g и 4° С, супернатант замораживали в криовиалах и хранили при –80° С. Экстракты липидов получали в соответствии с модифицированным методом Фолча. К 40 мкл сыворотки крови добавляли 480 мкл смеси хлороформ-метанол (2:1, об./об.), смесь инкубировали в течение 10 минут, фильтровали с использованием фильтровальной бумаги и в полученный раствор добавляли 150 мкл водного раствора NaCl (1 моль/л). Смесь центрифугировали при 3000 об./мин в течение 5 мин при температуре окружающей среды. Органический нижний слой, содержащий липиды, отбирали и высушивали в потоке азота, затем повторно растворяли в смеси ацетонитрил-2-пропанол (1:1, об./об.) для последующего масс-спектрометрического анализа.
Определение молекулярного состава образцов проводили с помощью масс-спектрометрии с электрораспылительной ионизацией на масс-спектрометре Maxis Impact qTOF (Bruker Daltonics, Бремен, Германия). Масс-спектры получали в режиме положительных ионов в диапазоне m/z 400–1000 со следующими настройками: напряжение на капилляре 4,1 кВ, давление распыляющего газа 0,7 бар, скорость потока осушающего газа 6 л/мин, температура осушающего газа 200° C. Для идентификации соединений, входящих в состав образца, выполняли тандемную масс-спектрометрию.
Пики липидов идентифицировали с помощью созданного в лаборатории R-кода, который сравнивает измеренные значения m/z с рассчитанными по элементному составу точными массами и присваивает идентификацию при совпадении экспериментальной и теоретической масс в пределах 10 ppm. Допустимые параметры каждой ацильной или алкильной цепи сложных липидов следующие: число атомов углерода в диапазоне 10–26 и число двойных связей в диапазоне 0–6. Рассматривали аддукты молекул липидов с протоном и катионом аммония. Более точную идентификацию проводили по результатам тандемного масс-спектрометрического анализа рассматриваемого пика. Номенклатура липидов соответствовала терминологии Lipid Maps [17] и сокращенной нотации [18].
Для статистической обработки результатов использовали скрипты, написанные на языке R [19], и программу RStudio [20]. Обработку многомерных масс-спектрометрических данных выполняли с помощью многофакторного анализа OPLS-DA (дискриминантный анализ с помощью ортогональных проекций на скрытые структуры) [21]. Анализ OPLS-DA реализован с использованием библиотеки «ropls» [22]. Были созданы модели для классификации образцов по признаку наличия/отсутствия макросомии. Качество OPLS-DA-модели оценивали по ее способности описывать дисперсию анализируемых данных (R2) и прогнозировать возможные новые данные (Q2). Параметр Q2 рассчитывали путем 7-кратной кросс-валидации. Чтобы оценить значимость Q2 и R2, использовали 100-кратный критерий перестановки. Характеристики модели оценивали по значениям чувствительности, специфичности и площади под ROC-кривой (AUC). Кроме того, OPLS-DA использовали для выявления липидов, которые являются наиболее значимыми для классификации. Это делается путем анализа влияния переменной на проекцию (VIP). Для выявленных с помощью VIP-анализа липидов оценивали статистическую значимость отличия их уровней между исследуемыми группами. Статистический анализ проводили с помощью теста Манна–Уитни. Для описания количественных данных использовали медиану (Me) и квартили Q1 и Q3. Величину порогового уровня значимости p принимали равной 0,05.
Результаты и обсуждение
Экстракты липидов сыворотки крови 120 пациенток, полученные в I, II и III триместрах беременности (n=360), были проанализированы методом масс-спектрометрии для определения особенностей молекулярного состава сыворотки пациенток с ФМ по сравнению с нормой. На первоначальном этапе оценивали возможность классификации полученных образцов по признаку наличия–отсутствия ФМ на основании липидного состава на различных сроках беременности (11–14 недель, 24–28 недель, 30–32 недели). На втором этапе использовали аналогичный подход для подгрупп (1а, 1б, 2а, 2б), что дало возможность различать сыворотку беременных с ФМ и сочетание ФМ с ГСД. Оценку проводили с помощью метода многофакторного анализа методом OPLS-DA. На рис. 1 представлен характерный вид графика счетов, построенного по результатам OPLS-DA. В данном случае представлен график счетов OPLS-DA-анализа данных от образцов общей подгруппы, взятых на 11-й неделе гестации. Точки, соответствующие образцам от пациенток с ФМ и нормальной массой тела при рождении, хорошо разделились на два кластера. Для двух групп наблюдается хорошее разделение, что свидетельствует о заметных отличиях липидного профиля сравниваемых образцов. Это свидетельствует о заметных отличиях уже в I триместре липидного профиля пациенток с развивающейся ФМ по сравнению с контрольной группой.
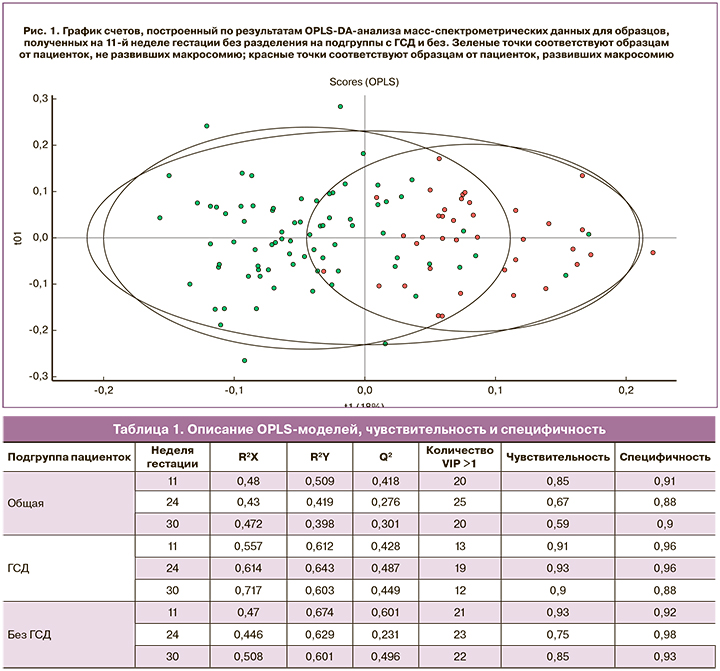
Качество получаемых моделей оценивали по их способности описывать (R2) и предсказывать (Q2) дисперсию данных. Рассматриваемая модель характеризуется R2Y=0,509; Q2=0,418. Хотя у величины Q2 нет стандарта для сравнения или определенной пороговой величины для определения значимости, кроме теоретического максимума, равного 1, но в литературе встречается эмпирически выведенное допустимое значение для биологических моделей Q2>0,4.
Таким образом, можно заключить, что данную модель можно использовать для классификации образцов сыворотки и прогнозирования развития ФМ при взятии крови на скрининге I триместра беременности. Это позволяет выделить группу высокого риска развития ФМ. Для данной группы пациенток необходимо рекомендовать прохождение глюкозотолерантного теста в I триместре беременности с целью раннего выявления ГСД и своевременного начала терапевтических вмешательств, а также тщательный клинический мониторинг за пациентками, имеющими нормогликемию.
 Отдельный интерес представляют результаты, полученные при классификации четырех подгрупп (1а, 1б, 2а, 2б) на различных сроках беременности, когда есть информация о наличии ГСД. Характеристики разработанных моделей сведены в табл. 1. Параметры большинства моделей превышают пороговое значение Q2>0,4 и свидетельствуют о хорошей прогностической способности у пациенток с ФМ и ГСД на всех сроках беременности. Низким значением Q2 характеризуются модели, созданные для сыворотки крови, взятой на 24-й и 30-й неделях беременности из общей подгруппы и 24-й неделе беременности из подгруппы без ГСД.
Отдельный интерес представляют результаты, полученные при классификации четырех подгрупп (1а, 1б, 2а, 2б) на различных сроках беременности, когда есть информация о наличии ГСД. Характеристики разработанных моделей сведены в табл. 1. Параметры большинства моделей превышают пороговое значение Q2>0,4 и свидетельствуют о хорошей прогностической способности у пациенток с ФМ и ГСД на всех сроках беременности. Низким значением Q2 характеризуются модели, созданные для сыворотки крови, взятой на 24-й и 30-й неделях беременности из общей подгруппы и 24-й неделе беременности из подгруппы без ГСД.
На рис. 2 приведены ROC-кривые для каждой из созданных моделей, а также площади под ними (AUC). Все величины AUC оказались не меньше 0,89. Кроме того, была рассчитана оценка чувствительности и специфичности OPLS-DA-моделей (табл. 2). Наименьшей чувствительностью характеризуется модель, созданная для образцов общей подгруппы, собранных на 30-й неделе беременности (чувствительность равна 0,59); наименьшей специфичностью – модели для образцов общей подгруппы и подгруппы с ГСД, собранных на 24-й и 30-й неделях беременности соответственно (специфичность равна 0,88). Модель с наилучшей чувствительностью получена для образцов подгрупп с ГСД и без, собранных на 24-й и 11-й неделях беременности соответственно. Модель с наилучшей специфичностью создана для образцов подгруппы с ГСД, собранных на 24-й неделе. При подстановке в разработанные модели липидомных данных новых образцов отдельных пациентов на выходе можно получить оценку принадлежности рассматриваемого образца к одной из групп, использованных для построения соответствующей модели. Выбор модели определяется сроком, на котором образец получен, и результатом глюкозотолерантного теста. Полученные нами данные дают возможность классифицировать ФМ в зависимости от наличия или отсутствия ГСД, причем можно рекомендовать выполнение липидомного анализа сыворотки крови как в I, так и во II триместрах.
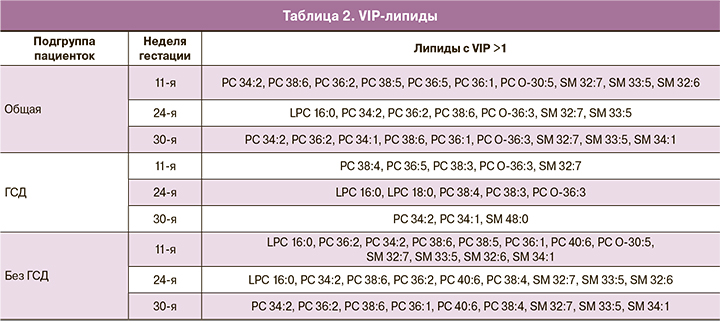
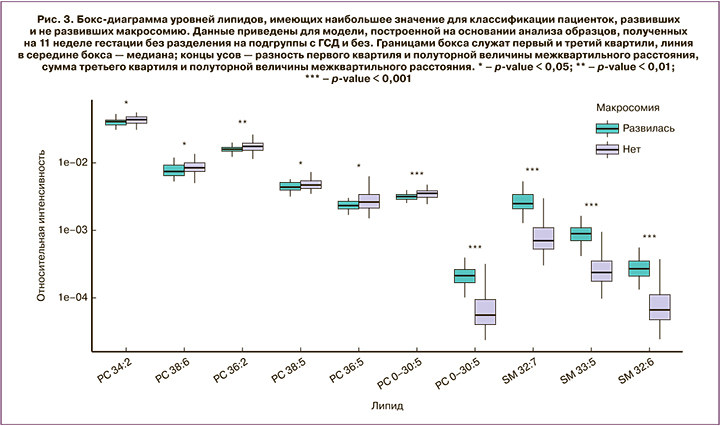
Помимо создания классифицирующих моделей, метод OPLS-DA позволяет выявить биологические факторы (в данном случае липиды), способствующие сортировке образцов по группам. Это можно сделать на основании так называемого параметра VIP. Факторы, у которых VIP >1, наиболее существенны. На основании такого анализа можно определить молекулы, характеризующие исследуемые группы, для последующего исследования механизмов развития патологии. Количество масс-спектрометрических пиков с VIP >1 для каждой из моделей приведено в табл. 1. В результате проведенной идентификации и анализа Манна–Уитни были определены липиды, уровни которых статистически значимо отличаются в группах с ФМ и нормальной массой плода. На рис. 3 приведена бокс-диаграмма липидов с VIP >1, исходя из модели для образцов общей подгруппы 11-й недели гестации, график счетов которой изображен на рис. 1. Указанные липиды относятся к следующим классам: фосфатидилхолины, плазмалогены и сфингомиелины. Липиды с VIP >1 и статистически значимым отличием между группами для других моделей сведены в табл. 2.
В целом все статистически значимые идентифицированные липиды принадлежат к группе фосфолипидов: фосфатидилхолины, сфингомиелины, лизофосфатидилхолины и плазмалогены. Фосфолипиды являются высокоспециализированными липидами, а также незаменимыми факторами роста и развития, необходимыми для функционирования всех без исключения клеток. В последнее время все больше внимания уделяется обмену фосфолипидов, которым отводится важная патогенетическая роль в развитии метаболических заболеваний.
Лизофосфатидилхолины представляют собой продукты гидролиза фосфатидилхолина, катализируемого фосфолипазой А2. В исследовании Barber M. и соавт. [23], проводимом на малой выборке, концентрации лизофосфатидилхолинов в плазме были снижены у лиц, страдающих ожирением и СД 2 типа. Кроме того, лизофосфатидилхолин (LPC 18:2) был предложен в качестве независимого предиктора СД 2 типа [24, 25].
Некоторые исследователи показали роль сфингомиелинов в развитии инсулинорезистентности, уровни которых в адипоцитах положительно коррелировали с уровнем инсулина и индексом инсулинорезистентности (HOMA-IR) у лиц с избыточной массой тела [25, 26].
В своем исследовании Patel N. и соавт. [27] продемонстрировали положительную корреляционную зависимость между уровнями фосфатидилхолинов и лизофосфатидилхолинов в пуповинной крови и массой тела ребенка при рождении от матерей с ожирением (0,04; 0,02–0,07), а также прибавкой веса у детей в первые 6 месяцев жизни (0,05; 0,00–0,10). Высокие уровни лизофосфатидилхолинов (LPCs) имели линейную зависимость с гипергликемией у женщин в 28 недель беременности (16:1 (β=0,65; 95% ДИ 0,03–0,10) и 18:1 (0,52; 0,02–0,80).
Заключение
Липидомный анализ сыворотки крови обнаруживает отличия липидного профиля у беременных с ФМ и нормальной массой плода уже на ранних сроках беременности (11–14 неделя), чувствительность и специфичность разработанной математической модели составили 85 и 91% соответственно. Причем данные об уровне глюкозы в крови в пробе с нагрузкой (глюкозотолерантный тест) повышают точность выделения группы высокого риска развития ФМ: для группы с ГСД чувствительность и специфичность модели составили 91 и 96% для образцов крови I триместра беременности. То есть уже на ранних сроках беременности липидомный анализ крови позволяет выделить группу высокого риска развития ФМ. Развитие разработанных моделей может привести к созданию методов оценки риска макросомии, что позволит снизить ее частоту, улучшить материнские и перинатальные исходы. В дальнейшем могут быть предложены не только диагностические подходы, но и новые алгоритмы ведения беременных с ФМ. Анализ особенностей липидома сыворотки крови расширяет возможности изучения молекулярных процессов, вызывающих ФМ, понимание которых позволит впоследствии раскрыть ключевые звенья патогенеза данного осложнения.



