Рак яичников – одно из наиболее распространенных онкологических заболеваний женских половых органов, которое, несмотря на наличие достаточно специфичных и чувствительных серологических маркеров, у большинства пациенток по-прежнему диагностируется на поздних стадиях, когда опухоль уже распространена по брюшине. Современные стандарты лечения рака яичников, наряду с активным хирургическим вмешательством, включают различные схемы адъювантной и неоадъювантной химиотерапии, в первую очередь на основе препаратов платины, которые во многих случаях оказываются весьма эффективными. Однако процент рецидивов и смертность все еще остаются высокими. В настоящее время многие исследователи и клиницисты связывают возможность дальнейшего прогресса в повышении эффективности лечения этого заболевания не только с рациональным использованием существующих методов комбинированного и комплексного лечения, но и с разработкой принципиально новых патогенетических подходов, основанных на современных достижениях биохимии, молекулярной биологии и иммунологии опухолей.
Следует отметить, что многолетние попытки использовать в лечении рака яичников различные виды гормонотерапии так и не привели к значительному успеху; не нашли пока своего места в лечении данного заболевания и современные молекулярно-направленные («таргетные») препараты. В последние годы значительный интерес и надежды вызывает возможность иммунотерапевтического воздействия на рак яичников, направленного на подавление активности одного из сигнальных путей так называемых «контрольных точек иммунитета» – PD-1/PD-L, который в физиологических условиях контролирует выраженность и длительность аутоиммунного ответа, предотвращая повреждение собственных тканей [1–3].
Основными компонентами этого сигнального пути являются: белок программируемой клеточной гибели PD-1 (programmed cell death protein 1) и два его лиганда: PD-L1 и PD-L2. PD-1 представляет собой мембранный рецептор 1-го типа, принадлежащий к семейству CD28/CTLA-4 регуляторов Т-клеток и экспрессирующийся на их поверхности. Из лигандов наиболее значим PD-L1, известный также, как кластер дифференцировки 274 (CD274) или гомолог B7 1-го типа (B7-H1). В норме PD-L1 экспрессируется на антигенпрезентирующих дендритных и макрофагоподобных клетках периферических органов, а также на клетках плаценты, островков поджелудочной железы и сетчатки. В то же время мРНК PD-L1 обнаружена в значительно более широком спектре тканей, а индуцированная экспрессия PD-L1 может наблюдаться и на Т- и В-лимфоцитах, естественных киллерах, макрофагах, мезенхимальных стволовых и эпителиальных клетках. Активация PD-1/PD-L1-пути стимулирует апоптоз антигенспецифичных Т-клеток в лимфоузлах и одновременно подавляет апоптоз регуляторных супрессорных Т-клеток, что позволяет опухоли уйти от иммунного ответа организма. В связи с этим моноклональные антитела к PD-1 и PD-L1, предотвращающие их взаимодействие друг с другом и ингибирующие иммуносупрессивные эффекты опухолей, находят сейчас активное применение в терапии многих онкологических заболеваний, в первую очередь меланомы [4] и почечно-клеточной карциномы [5, 6]. В последние годы предпринимаются достаточно серьезные попытки применения этого вида иммунотерапии при раке яичников, в том числе резистентном к препаратам платины [3, 7].
Экспрессию PD-1 и/или PD-L1 в опухолях и инфильтрирующих опухоли лимфоцитах активно изучают иммуногистохимическими (ИГХ) методами в качестве предиктора эффективности анти-PD-1/PD-L-иммунотерапии [8]. Эти белки рассматривают и как молекулярные маркеры общего прогноза течения онкологических заболеваний и выживаемости пациентов, и в некоторых предварительных исследованиях уже продемонстрировано неблагоприятное влияние высокой активности PD-1/PD-L-пути на клиническое течение целого ряда опухолей [9–12]. В немногочисленных исследованиях последних лет показана положительная взаимосвязь экспрессии PD-1 и/или PD-L1 при раке яичников с распространенностью и степенью злокачественности опухоли [13, 14], ее ассоциация с наличием мутаций генов BRCA1/2 и TP53 [15, 16] и микросателлитной нестабильностью, являющейся одним из показателей чувствительности к анти-PD-1/PD-L-терапии [17]. Продемонстрирована также экспрессия этих белков на инфильтрирующих опухоль макрофагах и лимфоцитах, неоднозначно влияющая на выживаемость пациенток.
В то же время, по данным ряда крупных рандомизированных исследований, связь результатов ИГХ-определения экспрессии PD-1 и PD-L1 в опухолях с эффективностью анти-PD-1-терапии оказалась неоднозначной и, по-видимому, зависит от вида злокачественного новообразования [8, 18]. Скорее всего, наличие этих противоречий связано с трудностями стандартизации ИГХ-метода, результаты которого зависят от техники подготовки образцов, применяемых антител, различающихся по специфичности и сродству к различным эпитопам исследуемых белков, а также от критериев, используемых при интерпретации полученных данных. Одной из важнейших проблем ИГХ-тестирования PD-1 и PD-L1 является и то, что эти молекулы экспрессируются не только на клетках самой опухоли, но и на инфильтрирующих ее клетках иммунной системы. Причем на данном этапе исследований неизвестно, какой тип экспрессии более значим для предсказания ответа на иммунотерапию. Другой проблемой является наличие не связанных с мембраной форм данных белков, которые могут давать ложноположительные результаты; при этом их роль в патогенезе опухолей пока не очень ясна.
В решении хотя бы части проблем, связанных с ИГХ-тестированием, может помочь исследование растворимых форм PD-1 (sPD-1) и его лиганда (sPD-L1), обнаруженных относительно недавно в периферической крови, в том числе и онкологических больных [19]. Происхождение sPD-1 и sPD-L1 пока точно не установлено, однако, как и растворимые формы других мембранных белков, они могут образовываться либо в результате гидролитического отщепления внеклеточного домена мембраносвязанной молекулы, либо на более раннем этапе – при альтернативном сплайсинге мРНК этой нативной мембранной формы. Имеющиеся к настоящему времени данные свидетельствуют о том, что sPD-L1 образуется преимущественно в результате протеолитического отщепления внеклеточной части трансмембранного белка, тогда как sPD-1 – в результате альтернативного сплайсинга. В экспериментальных исследованиях показана способность sPD-1 подавлять активность PD-1/PD-L1(2)-пути, блокируя связывание находящегося на опухолевых клетках лиганда с мембранным рецептором T-лимфоцитов. sPD-L1 также способен снизить активность PD-1/PD-L1(2)-пути, блокируя рецептор, но, по некоторым данным, может также стимулировать апоптоз T-лимфоцитов, аналогично мембранному белку, т.е. подавлять противоопухолевый иммунитет.
Большинство публикаций о роли sPD-1 и sPD-L1 при разных онкологических заболеваниях, вышедших в последние несколько лет, суммированы в фундаментальном обзоре [19], а также в метааналитических работах [20, 21], однако это направление активно развивается, и еще несколько исследований опубликовано уже после выхода этих обзорных статей [22–26]. Недавно мы провели пилотное исследование, включавшее 62 больных с новообразованиями яичников, и показали, что уровень sPD-L1, но не sPD-1, коррелирует с распространенностью рака яичников [27]. В настоящее время обследованные группы больных раком и доброкачественными опухолями яичников существенно расширены, что позволило более репрезентативно оценить клиническое значение исследуемых маркеров.
Цель настоящего исследования – анализ содержания растворимых форм PD-1 и PD-L1 в плазме крови больных злокачественными, пограничными и доброкачественными новообразованиями яичников и их взаимосвязи с клинико-морфологическими характеристиками рака яичников.
Материалы и методы
В исследование вошли 125 больных новообразованиями яичников в возрасте от 18 до 78 лет (медиана – 54 года), проходивших обследование и лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава РФ, в отделении онкогинекологии Рязанского областного клинического онкологического диспансера, в отделении инновационной онкологии и гинекологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ в период с марта 2017 по апрель 2018 гг. Из 125 обследованных пациенток у 22 (18%) выявлены доброкачественные новообразования яичников, у 9 (7%) – пограничные и у 94 (75%) – рак яичников. В качестве контроля обследованы 34 практически здоровых женщины в возрасте от 18 до 68 лет (медиана – 44 года).
У 14 из 22 больных с доброкачественными опухолями выявлены серозные цистаденомы (у 1 – с муцинозным компонентом), у 4 – эндометриоидные, у 2 – муцинозная сосочковая цистаденома и у 2 – серозная киста яичников. Среди больных с пограничными опухолями у 6 (67%) они имели серозный и у 3 (33%) – муцинозный гистологический тип.
Стадирование и гистологическая классификация злокачественных опухолей яичников проведены в соответствии с рекомендациями Международной федерации акушерства и гинекологии (FIGO) 2014 г. IА стадия выявлена у 4, IВ – у 2, IС – у 18 больных; 3 пациентки имели IIВ, 6 – IIС, 9 – IIIА, 6 – IIIВ, 41 – IIIС и 4 – IV стадию заболевания; также обследована 1 больная с карциномой in situ. Из-за небольшого размера подгрупп при статистическом анализе пациенты были объединены в 4 группы: I стадия – 25; II – 9; IIIАВ – 15, IIIС и IV – 45 человек. По гистологическому строению у 72 пациенток выявлены серозные, у 10 – эндометриоидные и у 7 – муцинозные аденокарциномы яичников; у одной пациентки выявлен светлоклеточный, у 1 – аденогенный и у 1 – недифференцируемый рак яичников.
Исследование проведено согласно требованиям комиссии по этике ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава РФ, ГБУ «Рязанский областной клинический онкологический диспансер», ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава РФ.
Концентрацию sPD-L1 и sPD-1 определяли в плазме крови, полученной по стандартной методике с использованием ЭДТА до начала специфического лечения, с помощью наборов реактивов для прямого иммуноферментного анализа Human PD-L1 Platinum ELISA и Human PD-1 ELISA kit (Affimetrix, eBioscience, США) в соответствии с инструкциями производителя. Измерения проводили на автоматическом иммуноферментном анализаторе BEP 2000 Advance (Siemens Healthcare Diagnostics, Германия). Содержание маркеров выражали в пикограммах (пг) на 1 мл плазмы крови.
Статистическая обработка данных
Поскольку распределение изучаемых показателей отличалось от нормального, при сравнении показателей и анализе их взаимосвязей с клинико-морфологическими факторами использовали непараметрические критерии: Манна–Уитни – при сравнении 2 независимых групп, Краскела–Уоллиса – при сравнении 3 и более независимых групп; тест корреляции рангов Спирмена (rs). В таблицах представлены показатели медианы (Me) и квартилей (Q1;Q3). Различия и корреляции считали статистически значимыми при p<0,05. Для расчетов использовали программу Statistica 7.0.
Результаты и обсуждение
В таблице 1 представлены показатели концентрации sPD-L1 и sPD-1 в плазме крови больных с различными новообразованиями яичников и группы контроля. Уровень sPD-L1 в плазме больных раком яичников заметно ниже, чем в контрольной группе (медианы 43,8 и 61,5 пг/мл соответственно), хотя различие не достигает уровня статистической значимости. При этом у пациенток с доброкачественными опухолями уровень sPD-L1 (медиана 22,7 пг/мл)
статистически значимо снижен как по сравнению с контролем, так и относительно больных раком яичников (p<0,01). Уровень этого маркера также значительно снижен при пограничных опухолях (медиана 28,7 пг/мл), но различия с контролем и с группой больных раком яичников не достигают порога статистической значимости, что, скорее всего, связано с небольшим числом наблюдений.
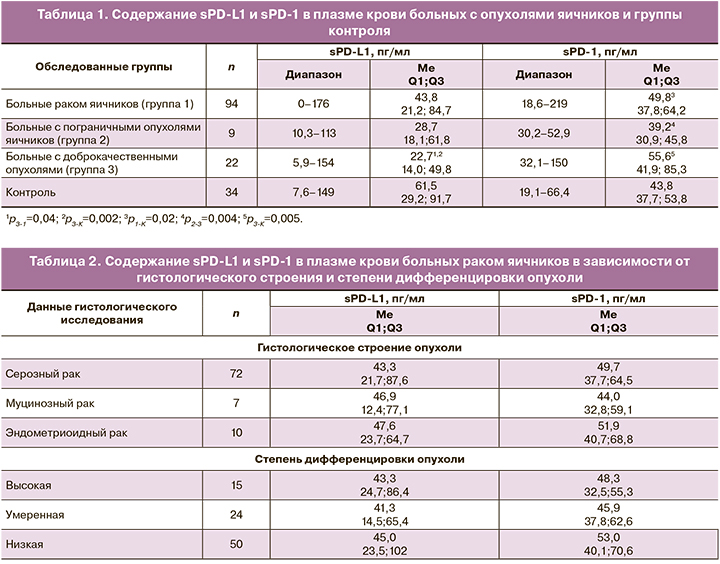
Содержание sPD-1 в плазме больных раком яичников незначительно, но статистически значимо повышено по сравнению с контролем (медианы 49,8 и 43,8 пг/мл соответственно; p=0,02), а также выше, чем у пациенток с пограничными опухолями (медиана 39,2 пг/мл; p=0,004). Наиболее высокий уровень sPD-1 обнаружен в плазме крови пациенток с доброкачественными новообразованиями яичников (медиана 55,6 пг/мл), причем различия с контролем и пациентками с пограничными опухолями статистически значимы (p=0,005 и p=0,004 соответственно). Корреляции между уровнями sPD-L1 и sPD-1 в плазме крови ни в одной из обследованных групп не обнаружено.
Значимой взаимосвязи уровней sPD-L1 и sPD-1 в плазме крови с возрастом и менопаузным статусом ни у пациенток, ни в контрольной группе не выявлено, хотя в литературе описано увеличение уровня sPD-L1 с возрастом [22].
У большинства обследованных пациенток (77%) аденокарциномы яичников относились к серозному типу, эндометриоидные и муцинозные раки составили соответственно 11% и 7%. Еще три гистологических типа (светлоклеточный, аденогенный и недифференцируемый рак) представлены единичными наблюдениями. Статистически значимых различий уровней sPD-L1 и sPD-1 в плазме крови в зависимости от гистологического строения рака яичников не обнаружено (табл. 2).
Степень дифференцировки опухоли удалось оценить у 89 пациенток: 53% опухолей были отнесены к низкой степени дифференцировки, умеренно дифференцированные опухоли составили 25%, высокодифференцированные – 22% (см. табл. 2). Уровни sPD-L1 и sPD-1 в плазме крови больных раком яичников от степени дифференцировки опухоли не зависели.

При анализе уровней исследуемых маркеров в плазме крови в зависимости от показателей распространенности рака яичников (табл. 3) установлено, что уровень sPD-L1 статистически значимо возрастал с увеличением стадии заболевания – от 17,8 пг/мл при I стадии до 94,1 пг/мл при IV стадии (p<0,001 по тесту Краскела-Уоллиса; rs=0,52; p<0,001). Таким образом, наблюдавшееся в общей группе пациенток снижение уровня sPD-L1, по сравнению с контролем, происходит полностью за счет показателей маркеров у больных I–II и в меньшей степени – IIIA–B стадий. Уже при IIIC стадии, характеризующейся наличием внутрибрюшинных метастазов за пределами таза и/или в регионарных лимфоузлах, уровень маркера практически равен контрольному, составляя 59,9 пг/мл. Концентрация sPD-1 в плазме крови не зависит статистически значимо от стадии рака яичников, хотя по медиане в 1,5 раза ниже при I стадии, чем при IV (p=0,02; см. табл. 3).
Статистически значимых различий уровней данного маркера в зависимости от размера первичной опухоли при одностороннем поражении яичников не выявлено, однако при двустороннем поражении уровень sPD-L1 вдвое выше, чем при одностороннем (p=0,03; см. табл. 3). Уровень sPD-L1 у пациенток с асцитом более чем вдвое выше, чем у больных без асцита (p<0,001; см. табл. 3). Для sPD-1 наблюдаются противоположные тенденции – он снижен у больных с двусторонним поражением яичников и при наличии асцита (различия не достигают порога статистической значимости).
Содержание СА-125 в сыворотке крови определено у 86 больных раком яичников (2,7–9970; медиана 308 Ед/л) и 8 пациенток с пограничными опухолями (25–3109; медиана 455 Ед/мл). Уровень sPD-L1 (но не sPD-1) слабо, но статистически значимо положительно коррелировал с уровнем СА-125 (rs=0,36; p<0,001). У 36 пациенток определен также уровень маркера HE4 (36,8–8049; медиана 257 пмоль/л), который еще более значимо положительно коррелировал с sPD-L1 (rs=0,54; p<0,001).
Таким образом, уровень sPD-L1 – растворимой формы ключевого лиганда белка контролируемой клеточной гибели PD-1 – в плазме крови больных раком яичников не отличается от показателей группы контроля, но увеличивается по мере нарастания распространенности процесса, а также коррелирует с уровнем классических маркеров рака яичников СА-125 и НЕ4. По данным литературы, увеличение концентрации sPD-L1 в сыворотке или плазме крови на поздних стадиях заболевания наблюдали также у больных раком желудка [28], печени [29], почки, немелкоклеточным раком легкого (НМРЛ) [30], некоторыми видами лимфом [24]. Для этих заболеваний показано неблагоприятное влияние высоких уровней sPD-L1 в периферической крови на выживаемость пациентов. В большинстве этих публикаций, в том числе и в нашем исследовании больных почечно-клеточным раком [26], обнаружено также повышение уровня sPD-L1 у онкологических больных по сравнению с контролем. В то же время представленные в литературе данные по плоскоклеточному раку головы и шеи противоречивы, а при раке поджелудочной железы и раке шейки матки статистически значимого увеличения уровня sPD-L1 и его взаимосвязи с клинико-морфологическими факторами не выявлено [19].
В отличие от лиганда, уровень растворимого рецептора sPD-1 мало зависит от распространенности рака яичников, его уровень не коррелирует с уровнями СА-125 и НЕ4. Более того, отмечается тенденция к снижению уровня sPD-1 на поздних стадиях, при двустороннем поражении яичников и наличии асцита. Публикаций, посвященных клиническому значению sPD-1, очень мало. Описано повышение уровня данного маркера на фоне успешного лечения больных НМРЛ эрлотинибом, его взаимосвязь с риском развития гепатоцеллюлярного рака у больных гепатитом С, а при исследовании больных раком поджелудочной железы, шейки матки, головы и шеи взаимосвязи уровней sPD-1 с распространенностью процесса и прогнозом заболевания не обнаружено [19].
К сожалению, по большинству локализаций опубликованы только единичные исследования (в особенности это касается sPD-1), в которых использованы разнообразные тест-системы и биологический материал (либо сыворотка, либо плазма крови). Все это приводит к значительному разбросу получаемых результатов и невозможности на данном этапе определить четкие пороговые значения для предиктивных, прогностических и диагностических целей. В частности, в единственном исследовании sPD-L1 при новообразованиях яичников [25] использовали систему, разработанную непосредственно в лаборатории авторов, тогда как наше исследование выполнено в плазме крови с помощью стандартизованных наборов реактивов для иммуноферментного анализа.
В последние годы опубликовано несколько работ о роли сигнальной системы PD-1/PD-L при раке яичников, причем их экспрессию оценивали как на опухолевых клетках, так и на инфильтрирующих опухоль клетках иммунной системы, используя не только ИГХ-метод [13, 14], но и определение соответствующих мРНК [16]. Можно отметить продемонстрированное в одном из этих исследований [13] увеличение экспрессии PD-L1 при распространенном процессе и в опухолях высокой степени злокачественности, совпадающее с некоторыми закономерностями, выявленными нами для sPD-L1 в плазме крови. В то же время J. Chatterjee et al. [25], изучавшие sPD-L1 в плазме, не сравнивали полученные данные с клинико-морфологическими факторами и прогнозом заболевания, но, в отличие от нас, выявили статистически значимое увеличение уровня маркера у больных раком яичников по сравнению с контролем и пациентками с доброкачественными опухолями. Как уже отмечено, это может быть связано с принципиальным различием использованных иммуноферментных методов.
Заключение
На основании проведенного сравнительного иммуноферментного исследования содержания растворимых форм компонентов сигнального пути одной из ключевых контрольных точек иммунитета PD-1/PD-L1 в плазме крови больных раком, доброкачественными, пограничными новообразованиями яичников и здоровых женщин можно сделать вывод о том, что уровень растворимого лиганда sPD-L1 у больных раком яичников не отличается от контроля, но статистически значимо возрастает по мере увеличения распространенности опухолевого процесса. У больных с доброкачественными опухолями яичников концентрация sPD-L1 статистически значимо ниже, чем в контроле и при раке яичников. В то же время уровень растворимого рецептора sPD-1 у больных раком яичников выше, чем у здоровых женщин, однако его показатели не связаны с распространенностью заболевания. На основании полученных данных, а также опубликованных результатов исследования sPD-L1 при опухолях других локализаций можно предположить, что циркулирующий в периферической крови sPD-L1 взаимодействует с PD-1 на супрессорных Т-лимфоцитах и блокирует их функцию так же, как мембранная форма лиганда, способствуя ускользанию опухоли от иммунного ответа и прогрессированию болезни. Однако существование такого механизма пока еще не доказано. Более неоднозначным является вопрос о клиническом значении растворимого рецептора sPD-1, уровень которого не зависит от распространенности рака яичников. Полученные нами данные позволяют предполагать, что растворимый лиганд sPD-L1, но не его рецептор sPD-1, может быть потенциально значимым фактором прогноза рака яичников. Кроме того, следует отметить, что наибольший интерес для онкологов может представлять исследование динамики растворимых форм sPD-L1 и sPD-1 в плазме крови больных раком яичников на фоне специфической анти-PD-1/PD-L-терапии для оценки ее эффективности.



