Диагностика патологических пролиферативных процессов органов женской репродуктивной системы является актуальной проблемой современной гинекологии. В структуре всех онкогинекологических причин смертности у женщин злокачественные новообразования яичников занимают пятую позицию в структуре летальности, обусловленной опухолями всех локализаций у женщин [1]. Эндометриоз характеризуется формированием эндометриоидной ткани вне полости матки и поражает примерно 10-15% женщин репродуктивного возраста [2, 3], вызывая бесплодие и существенно ухудшая качество жизни пациентов [4]. Эндометриоз считается доброкачественным заболеванием; тем не менее, клетки эндометриоидных гетеротопий проявляют черты, сходные с онкотрансформированными клетками: нарушение регуляции пролиферации, апоптоза, миграции, способность стимулировать ангиогенез, резистентность к воздействию имму-нокомпетентных клеток приводят к росту и распро-странению эндометриоидных очагов [5].
Циркулирующие микроРНК представляют собой подкласс малых некодирующих РНК, которые были обнаружены практически во всех жидкостях организма, где, как предполагается, участвуют в межклеточных коммуникациях [6]. Биогенез микроРНК в клетке происходит сначала в ядре, а затем в цитоплазме, где они обеспечивают пост-транскрипционную регуляцию экспрессии целевых генов [7]. Изменение экспрессии микроРНК в опу-холевых тканях яичника и при эндометриозе яичника было продемонстрировано в ряде работ, что свидетельствует об их существенной роли в патогенезе данных заболеваний [8, 9]. МикроРНК могут секретироваться в комплексе со специфическими белками, либо в составе экзосом в межклеточное пространство или циркуляторное русло [10]. Экзосомы являются разновидностью внеклеточных везикул, содержащих специфический молекулярный репертуар, благодаря которому они способны влиять на активность клеток-мишеней [10, 11]. Изменение состава циркулирующих экзосом, в частности содержания микроРНК, может отражать активность патологического процесса, и в этой связи экзосомальные микроРНК рассматриваются в качестве перспективных неинвазивных маркеров [12]. В ряде исследований был изучен диагностический потенциал циркулирующих микроРНК при различных типах рака яичника (РЯ) [13]. Результаты оказались противоречивыми, что может быть обусловлено несколькими причинами: различиями в методах отбора и группировки пациентов, использовании сыворотки или плазмы крови, а также в методах детекции и идентификации микроРНК. Кроме этого, в подавляющем большинстве исследований анализировался общий состав микроРНК плазмы или сыворотки крови без индивидуального анализа экзосомальных фракций. Необходимо отметить, что состав циркулирующих экзосомальных микроРНК при эндометриозе остается практически не изученным. Еще одним ограничением исследований в данной области является применение в подавляющем большинстве работ метода полимеразной цепной реакции, который, обладая высокой чувствительностью в определении конкретных микроРНК, не позволяет оценить весь спектр микроРНК в исследуемых образцах. В этой связи, в данной работе был использован метод секвенирования нового поколения, позволяющий проводить наиболее полное профилирование экзо- сомальных микроРНК.
Целью проведенного исследования была оценка дифференциальной экспрессии экзосомальных микроРНК в плазме крови пациентов с распро-страненными стадиями серозного РЯ и наружного генитального эндометриоза, а также добровольцев соответствующих групп контроля для выявления потенциальных маркеров данных заболеваний.
Материалы и методы
В одномоментное (поперечное) исследование, выполненное в НМИЦ АГП им. В.И. Кулакова (Москва, Россия), были включены пациенты с серозным РЯ высокой степени злокачественности III—IV стадий по классификации FIGO (the International Federation of Gynecology and Obstetrics) (n=7) и с эндометриоидной кистой яичника (ЭКЯ, n=6) при распространенном наружном генитальном эндометриозе III-IV стадий по классификации rASRM (the revised American Society for Reproductive Medicine). Диагноз был верифицирован гистологически. Для образцов крови пациентов исследуемых групп были подобраны образцы крови женщин сопоставимого постменопаузального (n=6, 65 (10) лет в группе контроля и 63 (5) года в группе пациентов с РЯ, р=0,59) и репродуктивного (n=5, 34 (2) года в группе контроля и 31 (1) год у пациентов с ЭКЯ, р=0,06) возраста соответственно.
Критерии включения: информированное добровольное согласие на участие в исследовании; данные о сопутствующей экстрагенитальной патологии (в том числе острых инфекционно-воспалительных и аутоиммунных процессах), доброкачественных и злокачественных заболеваниях любой локализации на момент включения в исследование и перенесенных ранее; фолликулярная (пролиферативная) фаза менструального цикла для женщин репродуктивного возраста; постменопауза для пациентов с РЯ и женщин, составивших их группу контроля; отсутствие приема гормональных препаратов. Отсутствие заболеваний репродуктивных органов и экстрагенитальной патологии у наблюдаемых групп контроля исключено на основании данных анамнеза, ультразвукового исследования органов малого таза, клинического анализа крови и онкомаркеров СА125 и НЕ4).
Образцы крови пациентов в объеме 10 мл были получены до оперативного вмешательства. Транспортировка крови в лабораторию осуществ-лялась в пробирках с этилендиаминтетрауксусной кислотой в течение 30 минут от момента получения материала. Кровь центрифугировалась в течение 20 минут при 300 g, при 4°C. После центрифугирования надосадочная жидкость отбиралась и повторно центрифугировалась 15 минут при 3000 g. Полученную плазму вносили в криопробирки порциями по 1,5—2 мл. Промаркированные образцы замораживались и хранились при температуре -80°С. Пробоподготовка плазмы и хранение образцов осуществлялись в условиях Лаборатории по сбору и хранению биоматериалов НМИЦ АГП им. В.И. Кулакова.
Для поиска потенциальных маркеров РЯ и ЭКЯ было произведено исследование представленности микроРНК в экзосомах различных групп пациентов методом высокопроизводительного секвенирования. Перед выделением РНК, плазму крови размораживали и центрифугировали 16000 g при 4°С. Экзосомальные РНК выделяли из 3 мл полученной после центрифугирования плазмы крови при помощи набора реагентов ExoRNeasy Maxi kit (Qiagen), и далее использовали для создания библиотек ком-плементарных ДНК малых РНК при помощи набора NEBNext Multiplex Small RNA Library Prep Set for Illumina, строго в соответствии с методикой про-изводителя. Анализ микроРНК проводили методом высокопроизводительного секвенирования на платформе Illumina NextSeq, с использованием набора реагентов Illumina NextSeq 500/500 High Output Kit ver. 2,5 (75 cycles).
В результате секвенирования были получены прочтения нуклеотидных последовательностей для образцов, которые были картированы на базу данных miRbase v21 (miRbase.org) для идентификации зрелых микроРНК. Для нормализации данных и анализа дифференциальной экспрессии микроРНК в группах использовался алгоритм DESeq2 [14]. Для дальнейшего исследования были отобраны микроРНК с количеством прочтений >10, учитывалась также кратность изменений >1,5. При отборе микроРНК статистически значимыми считались результаты при рadj<0,05, где рadj — p-значение с учетом поправки средней доли ложных отклонений гипотез при проведении множественных сравнений (false discovery rate, FDR). Для отобранных микроРНК был выполнен поиск возможных мишеней в базе данных MicroRNA-Target Interactions (miRTarBase [15]), содержащей информацию более, чем о пятидесяти тысячах взаимодействий микроРНК с мишенями, данные о которых регулярно обновляются согласно систематическому анализу релевантных исследований. Были отобраны только те взаимодействия «микроРНК - ген», которые были выявлены одним или несколькими релевантными («сильными», по классификации авторов базы данных) методами: полимеразная цепная реакция в реальном времени (qPCR), Вестерн-блот (WesternBlot), методы высокопроизводительного репортерного анализа (reporter assay kit). Полученные списки потенциальных мишеней использовались для поиска сигнальных путей, регулируемых этими мишенями и, как следствие, изменяющих свою активность. Использовалась модель известных и прогнозируемых белок-белковых взаимодействий (база https://string-db.org/) и проводился анализ представленности генов- мишеней в различных сигнальных путях из базы данных WikiPatways (https://www.wikipathways.org). В результате «обогащения» сигнальных путей для каждой пары сравниваемых групп были отобраны те из них, которые продемонстрировали наибольшую статистическую значимость (XD-score, q-value), определяемую с помощью точного теста Фишера перекрывающихся с заданным списком мишеней. При выборе сигнальных путей использовалась поправка на тканеспецифичность - были отобраны пути с наиболее высокими показателями представленности, свидетельствующими об активности при патологических процессах в яичниках.
Результаты
По данным секвенирования в экзосомах было выявлено 480 микроРНК с различной представлен-ностью в группах сравнения. Списки дифференциально экспрессирующихся микроРНК (ДЭМ), а также кратность и направление изменений представлены в таблице 1 и на рисунке 1.

Среди выявленных ДЭМ, дифференцирующих пациентов от добровольцев репродуктивного возраста группы контроля (рис. 1А), 22 демонстрировали кратность изменений в 2 раза и более при ЭКЯ: 14 ДЭМ - с повышенной и 8 ДЭМ - с пониженной экспрессией. При РЯ были получены статистически значимые различия экспрессии 13 микроРНК (повышение - 12 ДЭМ, снижение - 1 ДЭМ), которые дифференцировали пациентов от добровольцев постменопаузального возраста группы контроля (рис. 1Б); наибольшая кратность изменений наблюдалась для miR-200b-3p, miR-4488, miR-141-3p (увеличение в 21,5, 16,7 и 11,7 раз, соответственно). Также была проведена оценка различий представленности микроРНК в экзосомах крови больных РЯ и ЭКЯ. Было выявлено 27 ДЭМ, из которых 18 - с повышенной и 9 - с пониженной экспрессией в 2 и более раз, соответственно (табл. 1, рис. 1В).
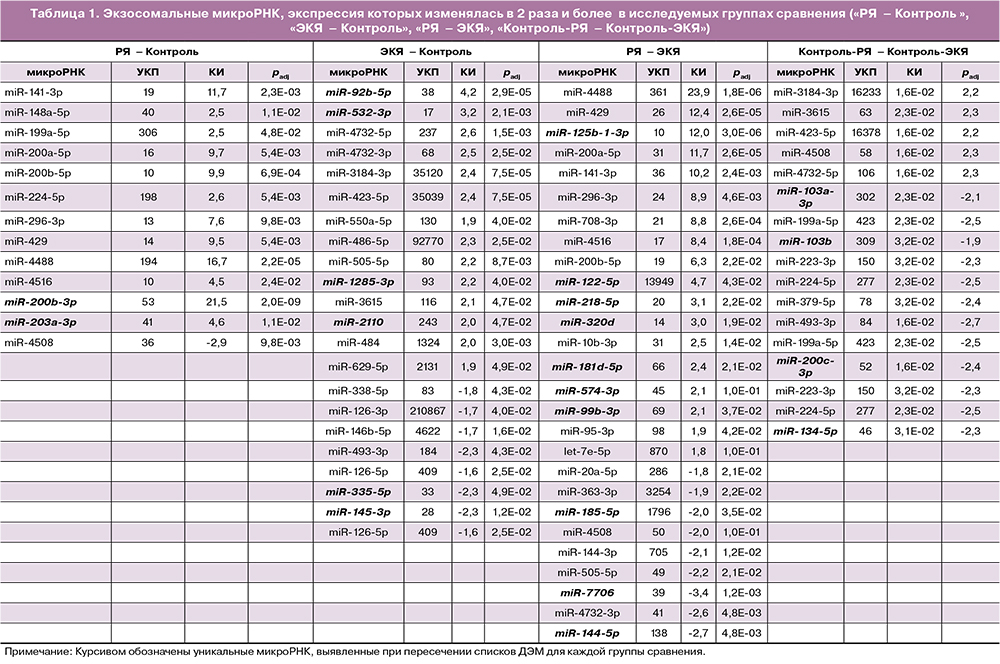
В связи с тем, что исследуемые группы представлены пациентами разных возрастов, для оценки возможного влияния возрастного фактора также было проведено сравнение между контрольными группами. Были установлены достоверные различия представленности 17 экзосомальных микроРНК у женщин групп контроля репродуктивного и пост-менопаузального возрастов: в постменопаузе выявлено повышение 5 ДЭМ и снижение 12 ДЭМ. Однако пересечение списков ДЭМ групп сравнения «РЯ - ЭКЯ» и «Контроль-РЯ» - «Контроль-ЭКЯ» показало присутствие всего двух общих ДЭМ (miR- 484 и miR-4508); кроме того, их экспрессия при РЯ и ЭКЯ была снижена по сравнению с женщинами групп контроля. Это свидетельствует об отсутствии влияния возрастного фактора на представленность остальных микроРНК в группе сравнения «РЯ - ЭКЯ» (рис. 2).

Пересечение списков ДЭМ, полученных при сравнениях «ЭКЯ» - «Контроль-ЭКЯ», «РЯ» - «Контроль-РЯ», не выявило общих микроРНК (рис. 2), что свидетельствует об уникальности набора микроРНК для каждой патологии. Списки микроРНК по каждому пересечению представлены в таблице 1. Также в результате данного пересечения для каждой группы были установлены уникальные ДЭМ с кратностью изменений в 2 раза и более: 18 микроРНК - при ЭКЯ, 2 микроРНК - при РЯ и 26 микроРНК - при «РЯ - ЭКЯ» (выделены курсивом в табл. 1). Наличие уникальных ДЭМ в экзосомах плазмы крови может свидетельствовать о специфическом изменении их состава в зависимости от исследуемой патологии. Отобранные в качестве потенциальных маркеров ДЭМ представлены в таблице 2.
Кроме уникальных ДЭМ, в представленные списки были добавлены ДЭМ, которые встречались в парах сравнения «РЯ - ЭКЯ» и «Контроль-РЯ» - «Контроль-ЭКЯ». Так, для РЯ маркерные ДЭМ miR-199a-5p и miR-224-5p выявлялись также при сравнении контрольных групп разного возраста. С учетом распространенности РЯ преимущественно в постменопаузальном возрасте, использование данных ДЭМ в качестве маркеров не будет приводить к ложноположительным результатам. Тем не менее, возрастной фактор необходимо учитывать при их потенциальном использовании.
Полученные в ходе исследования списки ДЭМ были использованы для поиска потенциальных генов-мишеней в базе данных MirTarBase v. 7.0. Поскольку микроРНК теоретически могут реализовывать взаимодействия с большим количеством матричных РНК (мРНК), по результатам поиска отбирались только наиболее вероятные пары «микроРНК - мРНК», взаимодействие которых было установлено с высокой степенью валидации (подтвержденные одновременно методами qPCR, WesternBlot, reporter assay kit и др. по данным MirTarBase). Полученные таким образом набо-ры генов-мишеней были использованы для анализа представленности функциональных групп генов (gene set enrichment analysis) по базе данных WikiPathways. На основании статистических параметров значимости и достоверности выбора наборов генов-мишеней для того или иного процесса (XD, q-value [16]) и их представленности для каждой группы сравнения были отобраны пути, из которых были выделены списки наиболее представленных в двух группах сравнения. Параметр XD указывает, насколько значимо изучаемый список генов интегрируется в тот или иной процесс, реализуемый определенной сетью молекулярных взаимодействий. Параметр q представляет собой скорректированное значение достоверности (p) для параметра XD. Отобранные пути для групп сравнения представлены в таблице 3.

Среди клеточных процессов и сигнальных каскадов особенного внимания заслуживают пути, акти-вируемые эстрогенами и андрогенами, факторами роста и морфогенными регуляторами. Также была выявлена группа путей, контролируемых интерлей-кинами (IL-2, -3, -4, -5, -6, -7, -9), которые могут участвовать в регуляции воспалительных процессов при формировании очагов патологического процесса при раке и эндометриозе. Также были установлены внутриклеточные процессы, участвующие в регуляции репарации ДНК при ее повреждении. Обращает на себя внимание обогащение с высоким значением параметра XD по регуляторным путям, ассоциированным с повреждением ДНК, реализующимся при участии микроРНК (miRNA involved in DDR). Активация указанных путей, а также сигнализация, опосредованная интерлейкинами, TP53 и факторами роста может свидетельствовать о развитии воспалительного процесса и окислительного стресса в местах формирования исследованных экзосом. Повреждение ДНК, в свою очередь, может быть фактором, индуцирующим процессы апоптоза, аутофагии и клеточного старения, которые также были выявлены в результате обогащения списков генов-мишеней ДЭМ.
Также по генам-мишеням микроРНК в обеих парах сравнения достоверно выявлялся интегральный опухолевый путь (Intedrated Cancer Pathway). В обеих группах были выявлены следующие гены- мишени, участвующие в данном пути: AKT1, ATM, BARD1, BAX, BCL2, BRCA1, CASP3, CDK4, CHEK1, CHEK2, JAK1, MDM2, PLK1, PTEN, RB1, SMAD2, SMAD3, TP53. Анализ функциональных взаимодействий показал многочисленные взаимосвязи между выявленными генами-мишенями микроРНК, что указывает на их существенный вклад и совместную вовлеченность в процессы опухолевого роста. Функциональная кластеризация генов-мишеней показала их участие в процессах регуляции клеточного цикла, сигнальных путей репарации ДНК, путях, активируемых эстрогенами и андрогенами, факторами роста и интерлейкинами. На рисунке 3 показана кластеризация и взаимосвязь генов- мишеней, а также их участие в клеточных процессах и путях внутриклеточной сигнализации.

Таким образом, проведенный анализ идентифи-цированных в экзосомах микроРНК может служить подтверждением их специфичности для патогене-тических процессов, ассоциированных с исследуемыми пролиферативными патологиями яичников.
Обсуждение
Изучение экзосом является перспективным направлением молекулярной медицины в связи с входящими в их состав нуклеиновыми кислотами, белками, гликоконъюгатами, липидами и даже органеллами — данные компоненты динамично отображают патофизиологические условия [17], участвуют в межклеточных коммуникациях [10, 11] и при этом защищены от внешнего ферментативного воздействия липидным бислоем везикулярной мембраны [18]. В представленном исследовании был проведен транскриптомный анализ экспрессии циркулирующих экзосомальных микроРНК плазмы крови у больных с серозным РЯ III—IV стадий и пациентов с распространенным наружным генитальным эндометриозом III—IV стадий и ЭКЯ. Было показано, что перечень микроРНК изменен в крови пациентов с РЯ и ЭКЯ, по сравнению с образцами крови наблюдаемых групп контроля.
Количество прочтений при секвенировании является параметром относительной представленности микроРНК в исследуемом образце. Слишком низкие значения количества прочтений существенно снижают вероятность детекции и использования в сравнительном анализе кандидатных микроРНК. Поэтому в качестве потенциальных маркеров необ-ходимо отбирать ДЭМ с максимально возможными количеством прочтений и кратностью изменений. На основании данных критериев был проведен отбор 11 микроРНК (табл. 2).
Изменение представленности микроРНК может быть обусловлено не только конкретным заболеванием, но и гормональными изменениями, характерными для фаз менструального цикла [19, 20] и периодов активности репродуктивной системы [21] у пациентов разных возрастов. Однако данные остаются противоречивыми. В исследовании S. Moustafa et al. определение перечня микроРНК (miR-125b-5p, miR-150-5p, miR-342-3p, miR-451a, miR-3613-5p, let-7b) позволило высокоточно дифференцировать образцы пациентов с легкими и тяжелыми формами эндометриоза (AUC=0,94) вне зависимости от фазы менструального цикла и приема гормональных препаратов (комбинированные оральные контрацептивы, прогестерон, и др.) [22]. N. Zafari et al. также были получены данные об отсутствии влияния фазы менструального цикла на экспрессию miR-199b- 3p и miR-224-5p, тогда как изменения let-7d-3p у пациентов с эндометриозом были взаимосвязаны с фазой цикла, а у наблюдаемых группы контроля — нет [20]. Для проверки гипотезы о конфаундерном влиянии возраста нами было проведено сравнение экспрессии микроРНК у здоровых добровольцев репродуктивного и постменопаузального возрастов. Несмотря на то, что были получены статистически значимые различия экспрессии 26 экзосомальных предположительно «возраст-ассоциированных», микроРНК, сравнение их экспрессии у здоровых добровольцев и пациентов с пролиферативными процессами не обнаружило совпадений, что свидетельствует об отсутствии влияния возрастного фактора на представленность данных микроРНК при РЯ и ЭКЯ. Это означает, что использование данных ДЭМ в качестве маркеров не будет приводить к ложноположительным результатам. С одной стороны, это позволяет считать применение предложенных микроРНК (табл. 2) релевантным для выявления РЯ и ЭКЯ в различных возрастных группах и, в том числе, для использования в качестве маркеров при сложностях дифференциальной диагностики данных пролиферативных процессов на распространенных стадиях. Однако, с другой стороны, учитывая ограничения проведенного пилотного исследования, мы считаем, что при потенциальном использовании микроРНК возрастной фактор по- прежнему необходимо учитывать.
Полученные нами данные по некоторым маркерам сопоставлены с результатами опубликованных исследований и приведены в таблице 4.

Согласно данным литературы, к наиболее изученным при заболеваниях яичников относятся микроРНК семейств miR-200, let-7, miR-199 [19, 20, 37]. В работе Q. Cao et al. [38] была показана прогностическая значимость определения микроРНК в тканях серозного РЯ высокой степени злокачественности: повышение экспрессии miR-200a, miR-200b и miR-200c ассоциировано с сокращением общей выживаемости. Нами было обнаружено повышение экспрессии представителей данного семейства (miR-203a-3p, miR-200b-5p и miR-141-3p), что можно интерпретировать в качестве отображения процессов, происходящих в опухолевой ткани. Преимуществом является обнаружение изменений при помощи неинвазивного метода. В дальнейшем может быть также изучена роль данного маркера в прогнозировании выживаемости пациентов с распространенными стадиями РЯ. Что касается обнаруженного повышения miR-141-3p при РЯ, S. Masoumi-Dehghi et al. было показано, что miR-141-3p индуцирует активность рецептора 2 типа эндотелиального фактора роста (VEGFR-2), что интенсифицирует опухолевый ангиогенез [23]. Также при исследовании активности сигнального пути JAK-STAT3 в культурах клеток РЯ авторами было показано, что секретируемые опухолью экзосомальные микроРНК miR-141-3p, выступая в качестве важных посредников межклеточной коммуникации, подавляют активность цитокин-индуцируемых супрессоров (SOCS5), что приводит к стимуляции активности JAK-STAT3 (The Janus kinase/signal transducer and activator of transcription) в эндотелиальных клетках. Нами были получены данные о повышении экспрессии miR-203a-3p (padj=0,011) при распространенных стадиях серозного РЯ; аналогичные данные были опубликованы D. Taylor et al. в 2008 г. [30]. Авторы также показали эквивалентные изменения в экзо- сомах плазмы крови и непосредственно в клетках опухоли. Полученные изменения экспрессии данной микроРНК могут быть объяснены механизмами эпигенетической регуляции, в том числе гипометилированием.
miR-486-5p отобран нами, как маркер распростра-ненного эндометриоза с ЭКЯ (padj=0,025), что подтвер-ждает воспроизводимость исследования микроРНК. N. Nakamura et al. было показано повышение экспрессии данной микроРНК в сыворотке крови и перитонеальной жидкости при РЯ, по сравнению с изменениями при эндометриозе. В связи с зависимостью экспрессии miR-486-5p от степени распространения заболевания предложено использовать определение данной микроРНК в качестве маркера тяжести течения эндометриоза. Также ими была показана роль данной микроРНК в индукции пролиферации при ЭКЯ и РЯ, ассоциированном с ЭКЯ [32].
Наряду с сопоставимыми данными нами были получены результаты, не опубликованные ранее при изученных нозологиях (табл. 4) или отличающиеся от опубликованных ранее данных. Ранее J. Liu et al. было показано, что при дифференцировке образцов крови пациентов с РЯ от образцов пациентов группы контроля определение miR- 4732-5p в плазме характеризуется 85,7% чувствительностью и 82,4% специфичностью (AUC=0,889, р<0,0001) [36]. Также авторами было показано, что данная микроРНК является информативным маркером для мониторинга пациентов с ранними стадиями для выявления прогрессирования заболевания (р=0,018). В отличие от упомянутого исследования, нами не было обнаружено статистически значимого изменения miR-4732-5p у пациентов с серозным РЯ, по сравнению с пациентами с ЭКЯ и наблюдаемыми женщинами группы контроля. Следует отметить, что изменения данной микроРНК нами были отмечены при ЭКЯ — у пациентов наблюдалось повышение ее экспрессии, по сравнению с наблюдаемыми женщинами группы контроля (padj=0,015).
Для более углубленного изучения биологической роли выявленных ДЭМ нами был проведен анализ регуляторной функции потенциальных 1288 мишеней в нескольких сигнальных путях, наиболее вероятно задействованных в патогенезе и дифференцировке изучаемых пролиферативных процессов. На основании выявленных наиболее статистически значимых различий были идентифицированы гены- мишени нескольких сигнальных путей: AKT1, ATM, BARD1, BAX, BCL2, BRCA1, CASP3, CDK4, CHEK1, CHEK2, JAK1, MDM2, PLK1, PTEN, RB1, SMAD2, SMAD3, TP53 (табл. 2). Функциональная кластеризация обозначенных генов-мишеней показала их участие в процессах регуляции клеточного цикла, сигнальных путей факторов роста, апоптоза и репарации ДНК, что может служить подтверждением их специфичности для патогенетических процессов, ассоциированных с исследуемыми пролиферативными патологиями яичников. Было установлено сходство анализируемых групп по активации нескольких сигнальных путей — многочисленные взаимосвязи между выявленными генами-мишенями микроРНК указывают на их существенный вклад и совместную вовлеченность в процессы пролиферативной активности при РЯ и ЭКЯ. Подробно механизмы регуляции изложены в ряде работ, в частности в обзоре 2021 г. A. Gajek et al. [39], а также в оригинальных исследованиях [40, 41].
Заключение
Благодаря стабильности экзосом плазмы крови изучение микроРНК, входящих в их состав, является перспективным направлением поиска маркеров пролиферативных процессов. Наличие ДЭМ в экзо- сомах плазмы крови свидетельствует о специфических изменениях при РЯ и ЭКЯ. В качестве маркерных для РЯ и ЭКЯ были выбраны следующие ДЭМ: miR-141-3p, -199a-5p, -200b-3p, -203a-3p, -224-5p, -4488 (повышены при РЯ), miR-486-5p, -3184-3p, -4732-5p, -423-5p, -92b-5p (повышены при ЭКЯ).
Рассмотрение возможного участия в сигнальных путях экзосомальных микроРНК, отобранных на первом этапе исследования, позволило назвать их кандидатами в маркеры благодаря полученной спе-цифичности. Возможность создания классифици-рующего кластера подтверждает перспективность применения жидкостной биопсии для исследования маркерного потенциала экзосомальных микроРНК.



