Среди многочисленных неблагоприятных факторов, оказывающих влияние на течение беременности и ее исход, необходимо выделить табакокурение.
В России в период социально-экономических преобразований, которые сопровождались ростом свободной торговли табачными изделиями, наплывом рекламы и одновременно значительным снижением профилактической работы, ограничивающей курение в обществе, стал наблюдаться рост табакокурения [1].
Частота курения в России на сегодняшний день – одна из самых высоких среди индустриально развитых стран. По мнению экспертов ВОЗ (2015), эта ситуация будет только ухудшаться, способствуя росту показателя среди женского населения, в том числе и среди беременных женщин [1, 2]. Указанный факт требует проведения активных антиникотиновых мероприятий.
В последние годы во всем мире проведено множество медико-социальных исследований, позволивших углубить представление о вредном влиянии активного и пассивного курения на течение и исход беременности [1–7]. В табачном дыме содержится около 7000 химических компонентов, многие из которых являются фармакологически активными, токсичными, мутагенными, канцерогенными и свободно проходящими через плацентарный барьер.
По данным ВОЗ (2013), курящие беременные и роженицы имеют высокий риск формирования плацентарной недостаточности (ПН), преждевременных родов, преждевременной отслойки нормально расположенной плаценты или ее предлежания. Следствием перечисленных осложнений является рождение детей с синдромом задержки развития плода (ЗРП) и более высокой частотой мертворождений. Кроме того, у плодов курящих матерей чаще диагностируют врожденные аномалии [1, 8].
В настоящее время ведущими в диагностике ПН являются методы эхографии и функциональной оценки состояния плода (кардиотокография (КГТ), кардиоинтервалография (КИГ), допплерометрическое исследование кровотоков). Однако при анализе общепринятых функциональных тестов в диагностике ПН было выявлено, что они высокоинформативны только при ее тяжелых формах. Например, при ультразвуковой био- и плацентометрии диагностика ПН составляет 55%; при КТГ и допплерометрии – 42,9%, и только при выраженной патологии информативность этих тестов повышается до 83,3% [9].
В связи с этим актуальной является разработка дополнительных методов диагностики нарушений фетоплацентарной системы на основе изучения показателей лазерной допплеровской флоуметрии (ЛДФ). Оценка показателей ЛДФ позволяет своевременно выявлять пациенток с высоким риском развития ПН, диагностировать ранние нарушения плацентарного комплекса и прогнозировать возможные осложнения.
Метод ЛДФ обладает неоспоримыми достоинствами: неинвазивный, измерения осуществляются in vivo, не имеет противопоказаний к применению. Кроме того, метод позволяет изучать влияние различных факторов, воздействующих на эндотелий сосудов, диагностировать их повреждения, получать оперативную информацию в реальном масштабе времени [10, 11].
ЛДФ успешно применяют в оценке состояния микроциркуляции у больных с различными заболеваниями сердечно-сосудистой и дыхательной системы, а также с поражениями системы микроциркуляции в диабетологии, онкологии, урологии, офтальмологии, гастроэнтерологии, дерматологии, стоматологии, педиатрии, акушерстве и гинекологии, при инфекционных заболеваниях [10–13]. При этом нет исследований, посвященных комплексной оценке микроциркуляторных и эндотелиальных нарушений у беременных на фоне табакокурения.
В связи с этим цель исследования – оценить состояние микроциркуляции фетоплацентарного комплекса у беременных с табакокурением методом ЛДФ.
Материалы и методы
Исследование было одобрено региональным независимым этическим комитетом Астраханского государственного медицинского университета (заседание РНЭК от 17.11.2013 г., протокол № 4).
Для проведения ЛДФ нами были отобраны 105 беременных, разделенных на 3 группы. Контрольную группу составили 35 практически здоровых беременных с физиологическим течением беременности. В основную группу вошли 35 беременных с табакокурением. Группа сравнения была представлена 35 беременными с гестационной артериальной гипертензией (АГ). Формирование групп исследования проводили по следующим критериям:
- критерии включения: возраст беременных (16–39 лет), срок гестации 11 недель и более, стаж курения свыше 3 лет (для основной группы), согласие женщин на участие в исследовании, наличие у беременной в анамнезе гестационной АГ (группа сравнения);
- критерии исключения: наличие сопутствующей экстрагенитальной патологии, ожирения, преэклампсии, кровотечения любой этиологии, стаж курения менее 3 лет (для основной группы), возраст беременной (40 лет и более), отказ женщин от участия в исследовании, наличие ВИЧ-инфекции, хронические вирусные гепатиты, туберкулез, сочетание беременности и злокачественных опухолей гениталий.
Возраст всех исследованных пациенток варьировал от 17 до 39 лет, составив в среднем 27,1±5,55 года. У пациенток с табакокурением средний возраст оказался равным 27,5±5,85 года, в контрольной группе – 25,5±4,63 года, в группе сравнения – 28,3±5,85 (р=0,07) года. Индекс массы тела (ИМТ) находился в пределах 18,5–25,0 кг/м2.
Среднее количество выкуриваемых в день сигарет беременными составляло 8,9±3,68 штуки, стаж курения – 5,1±1,7 года.
ЛДФ проводили с помощью лазерного анализатора микроциркуляции крови «ЛАКК-02» в одноканальной модификации (ТУ 9442-002-13232373-2003, лазерное изделие класса 1, заводской номер 345), изготовляемого научно-производственным предприятием «Лазма».
Согласно рекомендациям Научного совета по лазерной медицине РФ (протокол № 10, 2011), выбор объекта исследования непосредственно определяется задачами функциональной диагностики в каждом конкретном случае [9]. С учетом цели исследования областью изучения параметров и расположения электрода была выбрана передняя брюшная стенка (проекция дна матки в зависимости от гестационного срока). Исследование и оценка показателей осуществлялись в каждом триместре беременности (11–14 недель, 15–28 недель, 29–40 недель) на фоне полного физического и психоэмоционального покоя, в первой половине дня, длительность исследования – 3 минуты.
В исследуемых группах при обработке ЛДФ-грамм были определены значения показателя микроциркуляции (ПМ), оцениваемого в перфузионных единицах (пф. ед.). Кроме того, был изучен показатель индекса флаксмоций (ИФМ) в условных единицах (у.е.).
Для сравнения количественных показателей двух несвязанных групп использовали непараметрический тест Манна–Уитни, трех групп – Краскела–Уоллиса. При сравнении количественных показателей двух связанных групп использовали W-критерий Вилкоксона, трех групп – критерий Фридмана.
Качественные признаки описывали в процентах (%). Для выявления различий между двумя группами по качественным признакам использовали критерий χ2 (с поправкой Йетса – df) при помощи составления таблиц сопряженности 2×2. При оценке значимости различий между тремя группами по качественным признакам применяли критерий χ2 с построением произвольных таблиц сопряженности.
Критический уровень значимости принимали ≤0,05.
При статистической обработке использовали пакет программ Statistica (StatSoft Inc., США, версия 8.0).
Результаты и обсуждение
Анализируя социальный статус пациенток, установили, что курящие беременные чаще были безработными (68,6%) и проживали в сельской местности (51,4%), р=0,003.
Все обследованные пациентки группы контроля и сравнения находились на диспансерном наблюдении по беременности в женских консультациях, в то время как среди курящих пациенток этот показатель оказался равным только 43% (р=0,001).
Течение беременности в основной группе сопровождалось различной акушерской патологией (табл. 1).
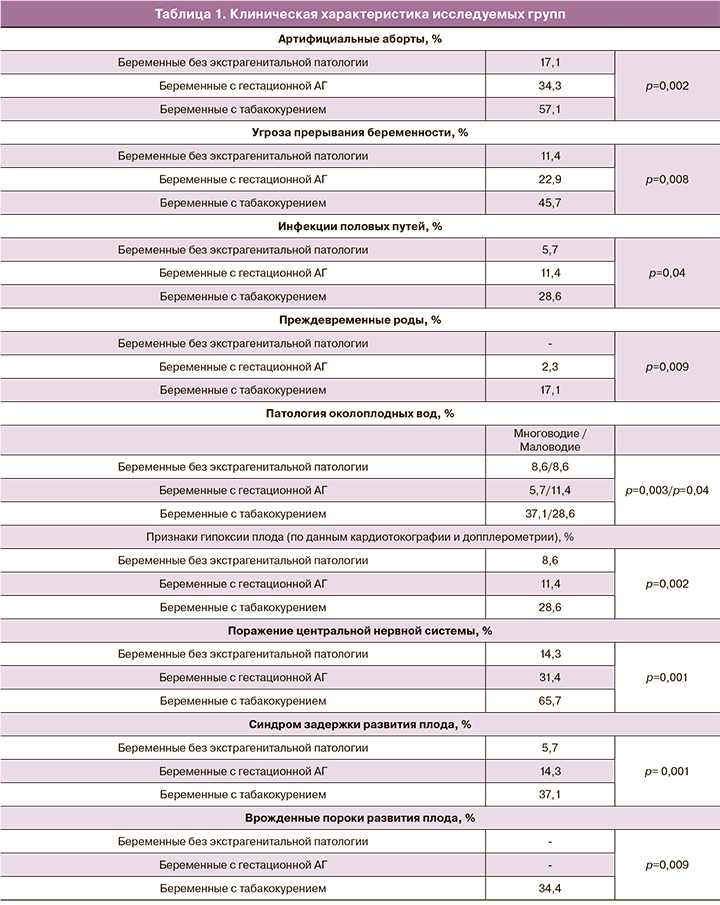
Практически у каждой пациентки беременность протекала на фоне перманентной угрозы ее прерывания и в 17,1% случаях завершилась преждевременными родами (р=0,009).
Как следует из табл. 1, у курящих матерей чаще рождались дети с врожденными пороками развития – 34,4%, при отсутствии их в других исследуемых группах (р=0,009). Так, пороки развития сердечно-сосудистой системы встречались у 25,7% детей (р=0,04). Реже наблюдались пороки развития почек, легких, опорно-двигательного аппарата – 2,9% случаев (р=0,06).
При гистологическом исследовании плацент курящих родильниц значительно чаше отмечались выраженные компенсаторно-дегенеративные изменения. У 86% курящих беременных отмечалось их сочетание с воспалительными процессами, что свидетельствовало о выраженных функциональных нарушениях плацентарного кровотока (р=0,003).
В табл. 2 представлены результаты исследования кожной микроциркуляции (ПМ и ИФМ) у беременных с физиологически протекающей беременностью, АГ и у пациенток с табакокурением.

В результате обработки ЛДФ-грамм и оценки базальных параметров микроциркуляции установлено, что у беременных с физиологически протекающей беременностью и гестационной АГ по мере увеличения срока гестации отмечался рост ПМ.
При анализе изучаемых показателей обращал на себя внимание факт, что у беременных с гестационной АГ при увеличении ПМ медиана и интерпроцентильные размахи оказались ниже, чем в группе контроля.
У беременных на фоне табакокурения по мере увеличения гестационного срока отмечалось снижение ПМ (р=0,001), что проявлялось в формировании спастического гемодинамического типа нарушений микроциркуляции фетоплацентарного комплекса [14].
Так, у беременных с табакокурением значение медианы ПМ в I триместре беременности составляло 5,47 пф. ед. при интерпроцентильных значениях размаха 3,46; 8,75; во II триместре беременности – 3,76 пф. ед. при интерпроцентильных размахах 2,11; 5,06 соответственно. В III триместре беременности значение медианы ПМ продолжало снижаться и составило 2,77 пф. ед. при интерпроцентильных размахах 1,65; 3,94 (р=0,001).
При сравнении значений этих показателей у беременных с физиологическим течением беременности и с гестационной АГ, наоборот, отмечалось статистически значимое увеличение показателей (р=0,001).
В.И. Козловым и соавт. (2006) была предложена классификация, согласно которой выделяют четыре степени расстройств микроциркуляции по значению ИФМ, характеризующиеся различными уровнями декомпенсации тканевого кровотока [10].
Согласно данной классификации, у беременных с табакокурением с увеличением гестационного срока отмечается снижение показателя ИФМ, что свидетельствует о прогрессировании нарушений микроциркуляции из легкой степени в среднетяжелую (р=0,02). Так, в I триместре беременности ИФМ оказался равным 1,54 у.е., в III триместре зарегистрировано его снижение до 1,22 у.е. В группе контроля и сравнения данный показатель находился в референтных значениях.
Заключение
Таким образом, использование метода ЛДФ, наряду с уже существующими, позволяет рано диагностировать гемодинамические нарушения микроциркуляции фетоплацентарного комплекса.
Важной особенностью этого метода является возможность его применения с 11–12 недель беременности, что совпадает с началом формирования плаценты. При нарушении функции плаценты в I триместре беременности преимущественно регистрируется спастический гемодинамический тип нарушений микроциркуляции.
Внедрение ЛДФ и оценка ЛДФ-грамм в указанные сроки гестации, начиная с конца I триместра беременности, позволит осуществлять мониторинг за состоянием фетоплацентарного комплекса и своевременно прогнозировать развитие осложнений беременности.



