В научном мире и практическом здравоохранении происходит постепенное накопление достоверной информации о влиянии новой коронавирусной инфекции (НКИ) на течение беременности, становление и функционирование фето-плацентарного комплекса (ФПК), вертикальную передачу SARS-CoV-2, механизмы прогрессирования и особенности клинических проявлений в период гестации и пуэрперии, эффективность методов профилактики, лечения и реабилитации [1–3]. Беременные женщины относятся к группе населения с высокой чувствительностью к вирусу SARS-CoV-2 [4, 5]; при этом с НКИ ассоциировано существенное повышение частоты ранних репродуктивных потерь (до 20%), преждевременных родов (до 25%), преждевременного разрыва фетальных оболочек (до 23%), преэклампсии (до 12% – следует дифференцировать с «псевдопреэклампсическим» синдромом), преждевременной отслойки нормально расположенной плаценты (в 2–6 раз), задержки роста плода (ЗРП) (25–30%), дистресса плода (до 30%), влагалищных родоразрешающих операций (в 3–5 раз), кесарева сечения (более 40%), акушерских кровотечений (более 50%), низкой массы тела при рождении (до 30%). Госпитализация в отделение реанимации и интенсивной терапии (ОРИТ) требуется более чем 40% новорожденных [6–9]. Для беременных характерно наличие как «смазанной» и неспецифической клинической картины, так и прогрессирование НКИ с трансформацией в тяжелую и крайне тяжелую формы с показаниями для лечения в ОРИТ, развитием критического состояния на фоне стабильного течения заболевания. Это вполне объяснимо, с одной стороны, увеличением доли беременных старшей возрастной группы и сопутствующими соматическими заболеваниями [10–12], с другой – действием гормонов и белков беременности, обладающих иммуносупрессивными свойствами, уменьшением количества и активности натуральных киллеров, дендритных клеток, синтеза интерферонов, стимуляцией пироптоза, ведущих к ослаблению противовирусной защиты и быстрому развитию системного воспалительного ответа с реализацией цитотоксического и протромботического «шторма» [13–16].
В настоящее время опубликовано достаточное количество работ по проблеме «НКИ и беременность». Однако анализ баз данных Scopus, eLibrary.ru, PubMed, Cochrane, Medline, Hinari не показал наличия статей, раскрывающих механизмы формирования плацентарной недостаточности (ПН) вследствие НКИ, предлагающих прогностические критерии плацента-ассоциированной патологии плода.
Цель исследования: оценить лабораторно-инструментальные характеристики формирования ЗРП вследствие НКИ для выделения патогенетически обоснованных информативных предиктивных маркеров.
Материалы и методы
Основной этап исследования проводился в 2020 г. в период пандемии НКИ, при распространении наиболее агрессивного штамма дельта. Для оценки влияния НКИ на состояние ФПК была сформирована группа высокого риска по ЗРП с применением шкалы факторов риска ЗРП, согласно международному консенсусу Delphi (2016) [17]. Основной критерий включения: наличие 1 фактора риска ЗРП со значением ОШ>2,0 или 3 и более факторов риска при ОШ<2,0. Критерии невключения: многоплодие, экстрагенитальная и инфекционная патология (кроме НКИ), врожденные пороки и наследственная патология плода. Критерии исключения: крайне тяжелое течение НКИ, несоблюдение протокола обследования. Группу наблюдения составили 140 беременных высокого риска ЗРП, которым в 18–21 недель и 26–34 недель проведен мониторинг содержания в крови маркеров: воспаления (МВ) – фактор некроза опухоли (ФНО)α, С-реактивный белок (СРБ); децидуализации стромальных клеток (МД) – ПАМГ – плацентарный α-1-микроглобулин; апоптоза (МА) – лимфоциты с фенотипом CD95+ – рецептор инициации апоптоза FasR-FasL (ЛCD95+) [18, 19]; клеточной трансформации в плаценте – ФРП (фактор роста плаценты); протромботического состояния (МПС) – ФН (фибронектин – универсальный маркер гемостаза, функционального состояния эндотелия), MPV (средний объем тромбоцита); эндотелиальной дисфункции (МЭД) – ИЦ АЭАТ (индекс цитотоксичности антиэндотелиальных антител) [20], общий IgE, HOMA-IR (индекс инсулинорезистентности, IR)] [21].
Ретроспективный анализ исхода беременности позволил из 140 беременных высокого риска ЗРП первоначально выделить 2 группы: группу 1 составили 68 беременных, не болевших НКИ в период наблюдения, и группу 2 – 72 беременные, перенесшие НКИ в конце II и III триместрах беременности. В группе 1 ЗРП диагностирована у 63,2% (43/68) беременных, в группе 2 – у 80,6% (58/72), χ2=4,39, p=0,03. В зависимости от реализации ЗРП и наличия соматической и другой акушерской патологии каждая группа исследования была разделена на две подгруппы: 1А подгруппа была представлена 32 беременными с изолированной ЗРП, 1Б – 11 беременными с ЗРП в сочетании с преэклампсией, преждевременными родами, экстрагенитальными заболеваниями (хронический пиелонефрит, хронический бронхит, сахарный диабет, нейро-циркуляторная дистония, гипертоническая болезнь); 2А подгруппу составила 41 беременная с ЗРП, 2Б – 17 беременных с ЗРП в сочетании с аналогичной подгруппе 1Б патологией.
Для реализации поставленной цели по оценке влияния НКИ на формирование ЗРП в итоге были сформированы 2 группы сравнения: в группу 1 вошли 32 беременные с ЗРП без сочетания с другой акушерской и соматической патологией; в группу 2 – 41 беременная с ЗРП, перенесшие НКИ (дельта-штамм) различной степени тяжести в конце II и III триместрах беременности (с 24 до 34 недель). Контрольную группу составили 30 здоровых женщин с физиологической беременностью. Инфицирование НКИ возможно в любом сроке беременности, и на ее фоне стираются грани манифестации ЗРП в виде раннего или позднего фенотипов, в связи с чем «истинный» ранний фенотип ЗРП, обусловленный нарушением ремоделирования маточно-плацентарных сосудов и плацентации, четко выделить сложно. Учитывая данное обстоятельство, в разделе «результаты» приводятся данные лишь частоты диагностики ЗРП до и после 32 недель гестации, без разделения на фенотипы.
Уровень АЭАТ определялся по технике перекрестной пробы антител к моноцитам и эндотелиальным клеткам в сыворотке крови. Цитотоксическое действие сыворотки с расчетом ИЦ АЭАТ определяли по следующим критериям: если количество разрушенных клеток составляло до 10% – результат отрицательный, от 10 до 20% – слабоположительный, от 20 до 50% – положительный, от 50 до 100% – резкоположительный [20]. Выявление ЛCD95+ проводилось методом иммуноферментного анализа (ИФА) с применением моноклональных антител на проточном цитометре Becton Dickinson FACS Calibur. Сывороточные концентрации ФРП, ФНОα, СРБ, ПАМГ, инсулина, общего IgE, плазменное содержание ФН определяли ИФА с набором соответствующих реагентов. MPV как показатель тромбоцитарной активации определяли на автоматическом гематологическом анализаторе Sysmex XN-1000 (Sysmex Corporation, Япония). Для диагностики ПН учитывался алгоритм обследования, включающий ультразвуковое исследование (УЗИ), ультразвуковую допплерографию ФПК, кардиотокографию, данные клинического обследования [19]. Диагноз ПН верифицировался морфологическим исследованием плацент [22]. Диагностика НКИ и ЗРП соответствовала действующим клиническим рекомендациям [17, 23].
Статистический анализ
Для статистической обработки данных использована программа IBM SPSS Statistics, версия 25. Характер распределения показателей проводился с применением критериев Шапиро–Уилка и Колмогорова–Смирнова. Непараметрические показатели были представлены медианой с межквартильным размахом (Ме – 50%, нижний (25%) и верхний (75%) квартили [Q1–Q3]). Для сравнения групп применяли непараметрический дисперсионный анализ Краскела–Уоллиса с последующими межгрупповыми сравнениями по критерию U Манна–Уитни с поправкой Бонферрони (критический уровень p<0,017). Для сравнения номинальных признаков в случае четырехпольной таблицы применяли критерий χ2 Пирсона с поправкой Йейтса. Статистически значимыми результаты считали при р<0,05. Для подтверждения информационной ценности (качества) отдельных параметров и индексов использовали ROC-анализ с построением ROC-кривой и определением площади под ней (AUC). При соответствии AUC значениям 0,9–1,0 информационная ценность оценивалась критерием «качество отличное»; при значениях AUC 0,8–0,9 – качество «очень хорошее»; при AUC 0,7–0,8 – «хорошее»; AUC 0,6–0,7 – «среднее»; AUC 0,5–0,6 – качество «неудовлетворительное». С целью оценки влияния факторов на формирование патологии плода вычисляли отношение шансов (ОШ) с расчетом 95% доверительного интервала (ДИ). Прогностическая значимость предикторного индекса (ПИ) характеризовалась важнейшими операционными характеристиками клинической эпидемиологии – чувствительностью (Se) и специфичностью (Sp) [24, 25].
Результаты и обсуждение
Возраст беременных 1-й и 2-й групп сравнения до 35 лет отмечен у 31,2% (10/32) и 34,1% (14/41), более 35 лет – у 68,8% (22/32) и у 55,9% (27/41) соответственно (χ2=0,000, p=0,99). Анализ клинического течения С19 у беременных 2-й группы выявил, что у 92,7% (38/41) и у 7,3% (3/41) диагностировались средняя и тяжелая степени тяжести НКИ. Данные компьютерной томографии (КТ) по шкале визуальной оценки легких свидетельствовали о поражении легочной ткани у всех беременных 2-й группы: картина КТ1 диагностировалась у 31,7% (13/41) беременных с НКИ средней степени тяжести, КТ2 – у 14,6% (6/41) женщин с НКИ средней степени тяжести, КТ3–4 – у 7,3% (3/41) беременных с НКИ тяжелой степени. Следовательно, каждая вторая беременная с плацента-ассоциированной патологией плода (53,6%), инфицированная SARS-CoV-2, имела поражение легких. В зависимости от триместра беременности установлено, что у 22% (9/41) беременных НКИ подтверждена в конце II триместра и у 78% (32/41) – в III триместре гестации. Все женщины с поражением легочной ткани имели возраст старше 35 лет и заболели НКИ в III триместре. Данная ассоциация тяжести течения НКИ с возрастом и гестационным сроком подтверждается рядом исследований [11] и вполне объяснима как изменением иммунореактивности организма, так и характером адаптационных процессов в органах дыхательной системы и свертывающей системы крови в III триместре гестации [13, 26], а также повышением экспрессии ангиотензинпревращающего фермента 2 (ACE-2), являющегося, наряду с трансмембранной сериновой протеазой 2 (TMPRSS 2) и трансмембранным гликопротеином CD147 (басигин), входными «воротами» для проникновения SARS-CoV-2 в клетку-хозяина в плаценте и околоплодных водах на поздних сроках беременности [27].
Оценка состояния ФПК в динамике беременности с дифференциацией темпов прироста показателей предполагаемой массы плода (ПМП) и окружности живота (ОЖ) позволила получить следующие результаты по реализации ЗРП. Частота ЗРП, с учетом степени замедления прироста ПМП, ОЖ<10-го процентиля в сочетании с нарушением кровотока в ФПК, составила 71,9% (23/32) в 1-й группе и 43,9% (18/41) – во 2-й (χ2=4,63, p=0,03). Диагностика выраженной ЗРП, с учетом ПМП <3-го процентиля, наблюдалась в 1-й группе в 28,1% (9/32), во 2-й – в 56,1% (23/41) (χ2=4,63, p=0,03). Манифестация ЗРП до и после 32 недель гестации имела место: в 1-й группе – в 25% (8/32) и 75% (24/32) наблюдений, во 2-й – в 24,4% (10/41) и 75,6% (31/41) соответственно гестационным срокам (соотношение 1:3; χ2=0,05, p=0,83). Данные показатели, несомненно, зависят как от индивидуальных особенностей, так и от времени инфицирования SARS-CoV-2 и тяжести вирусной альтерации ФПК [3, 7, 9]. Первые ультразвуковые критерии ЗРП в основном диагностировались через 3–6 недель после инфицирования SARS-CoV-2, что вполне обосновывает разработку прогностических лабораторных маркеров. Допплерографическая характеристика кровотоков ФПК у беременных без НКИ и переболевших НКИ показала различия по степени нарушений гемодинамики. Соответственно 1-й и 2-й группам наблюдались следующие патологические показатели кровотока: нарушение IА ст. диагностировано у 78,1% (25/32) и у 24,4% (10/41) беременных (χ2=18,70, p<0,001); IВ ст. – у 9,4% (3/32) и у 31,7% (13/41) (χ2=4,01, p=0,04); II ст. – у 6,3% (2/32) и у 26,8% (11/41) (χ2=3,89, p=0,04); III ст. – у 6,3% (2/32) и у 17,1% (7/41) (χ2=1,08, p=0,30). Анализ показал, что более тяжелые нарушения кровотока (II и III ст.) статистически значимо преобладали у беременных с НКИ – 43,9% (18/41) против 12,5% (4/32) (χ2=6,20, p<0,01); при этом группы также значимо различались по нарушениям фетального кровотока (IВ, II, III ст.) с преобладанием патологических изменений у беременных с НКИ – 75,6% (31/41) против 21,9% (7/32) в 1-й группе (χ2=18,69, p<0,001). Маловодие различной степени выраженности в 1-й и 2-й группах выявлено у 12,5% (4/32) и у 56,1% (23/41) (χ2=12,85, p<0,001), что подтверждает статистически значимое преобладание данной патологии при ЗРП вследствие НКИ. Все случаи олигогидрамниона в обеих группах наблюдались при выраженной ЗРП.
В настоящее время рекомендуется, согласно действующим клиническим рекомендациям [17], применять классификацию ЗРП с выделением «ЗРП» и «выраженной ЗРП»: при определении ПМП/ОЖ в пределах 9–3-го процентилей в сочетании с нарушением кровотоков в ФПК выставляют диагноз «ЗРП»; при выявлении ПМП<3-го процентиля – «выраженной ЗРП». Ранее применялась классификация ЗРП в зависимости от отставания от гестационного возраста основных фетометрических характеристик (в неделях) [19]: I ст. – на 1–2 недели, II ст. – на 3–4 недели, III ст. – более 4 недель. В рамках исследования у беременных 1-й и 2-й групп с ЗРП (всего 73 наблюдения) проведены диагностические параллели между представленными классификациями: сопоставлены степени ЗРП по фетометрическим данным (I, II, III ст.) с ЗРП согласно процентильной оценке ПМП. Получены следующие результаты: ЗРП I ст. имела место у 52,1% (38/73) беременных, ЗРП II ст. – у 24,7% (18/73), III ст. – у 23,2% (17/73); «ЗРП» (ПМП от 9-го до 3-го процентиля с нарушением кровотоков) составила 56,2% (41/73), «выраженная ЗРП» (ПМП <3-го процентиля) – 43,8% (32/73). Сопоставление тяжести ЗРП по степеням отставания фетометрических данных (в неделях) с оценкой ЗРП по ПМП (процентильной шкале) выявило следующую закономерность: 91,4% ЗРП II и III ст. (в неделях) соответствовали критериям «выраженная ЗРП» (по процентильной шкале ПМП), а 100% ЗРП I ст. и 8,6% ЗРП II ст. соответствовали критериям «ЗРП» (ПМП от 9-го до 3-го процентиля с нарушением кровотоков в ФПК). Аналогичные данные, без статистических различий, получены при отдельных сопоставлениях в 1-й группе без НКИ и во 2-й группе с НКИ, что подтверждает универсальность самих диагностических критериев ЗРП, независимо от ее этиологического фактора.
Оперативное родоразрешение путем кесарева сечения в связи с тяжестью фетальной патологии, ассоциированной с ПН, было проведено у 40,6% (13/32) в 1-й группе и у 78% (32/41) во 2-й группе (χ2=9,12, p<0,01); при этом экстренное абдоминальное родоразрешение чаще наблюдалось у беременных с НКИ – 43,9% (18/41) против 12,5% (4/32) в 1-й группе (χ2=6,20, p<0,01).
Следовательно, с клинической точки зрения у беременных высокого риска ЗРП отмечается негативное влияние НКИ на течение беременности и ее исход по сравнению с группой беременных, не перенесших данную инфекцию, что подтверждается статистически значимой более высокой общей частотой реализации ЗРП (ОШ 2,41 [95% ДИ 1,12–5,17]), повышением частоты «выраженной ЗРП» (ОШ 3,27 [95% ДИ 1,22–8,76]), олигогидрамниона (ОШ 8,94 [95% ДИ 3,65–30,17]) и более тяжелой степени нарушений кровотоков в системе «мать-плацента-плод» (ОШ 11,07 [95% ДИ 3,68–33,27]), а также более частым оперативным родоразрешением, в основном по поводу критического состояния плода. Поиск обоснования данного отрицательного влияния НКИ на рост и развитие плода нами осуществлен в направлении изучения влияния данной инфекции на механизмы формирования ПН и ЗРП по результатам лабораторного мониторинга беременных.
Среди механизмов формирования ПН многие исследователи [13, 19] выделяют провоспалительное состояние как фактор дестабилизации иммунобиологического надзора, метаболизма, интеграции гормонов, функциональных реакций органов и систем, включая функциональную систему «мать-плацента-плод». Для НКИ воспаление является ведущим повреждающим звеном в патогенетической цепи сложных взаимосвязей SARS-CoV-2 и организма [13, 14, 16]. Результаты исследования МВ в динамике II и III триместров беременности (табл. 1, 2) показали, что в группах высокого риска ЗРП в сроке 18–21 недель (до заболевания НКИ во 2-й группе) отмечается статистически значимое повышение уровней ФНОα, СРБ, свидетельствующее о доклиническом формировании провоспалительного статуса у данного контингента беременных. При этом в III триместре во 2-й группе с НКИ происходит значительное нарастание МВ, отличное как от контроля (p<0,001) – в 3,2 раза по ФНОα и в 5,5 раза по СРБ, так и от 1-й группы с ЗРП без НКИ (p<0,001) – в 1,8 раза по ФНОα и в 3,1 раза по СРБ.
При осложненном течении беременности известна ассоциативная взаимосвязь воспаления и протромботических изменений [13], ведущих к нарушению гемодинамики в маточно-плацентарной/плацентарно-плодовой системах, микроциркуляции и тканевой ишемии. Тромбовоспаление – особо важное звено генеза C19, связанное как с прогрессированием заболевания, так и с неблагоприятным прогнозом [26]. Оценка МПС в динамике гестации (табл. 1, 2) показала нарастание универсального маркера гемостаза ФН у беременных группы высокого риска ЗРП (с 322 до 449 мкг/мл – в 1-й группе и с 335 до 544 мкг/мл – во 2-й группе, p<0,001), со значимым преобладанием показателя в III триместре при НКИ – в 1,2 раза. Динамика показателя MPV, свидетельствующего об активации тромбоцитарного звена гемостаза [28], была несколько другой: отсутствовали статистические различия между контролем и группами высокого риска в сроке 18–21 недель, с наличием значимых различий в III триместре с обеими группами (p<0,001), превышением показателя MPV в 1,3 раза во 2-й группе с НКИ по сравнению с 1-й группой (p<0,001).
Анализ клинического течения НКИ, ее исходов показал, что одним из наиболее неблагоприятных патологических изменений, характерных для тяжелого течения инфекции, является формирование патологической IR [21]. С данным нарушением регуляции всех видов обмена веществ, клеточного энергообеспечения связывают летальные исходы при НКИ у женщин с ожирением, гипертензией, метаболическим синдромом, сахарным диабетом [11]. В период гестации развитие IR является «нормой беременности» и связано с эволюционно закрепленной функцией по энергопластическому обеспечению плода [29], однако при срыве компенсаторно-приспособительных процессов происходит трансформация в патологическую IR с нарастающей гиперинсулинемией (ГИ). В динамике обследования беременных высокого риска ЗРП были выявлены интересные данные по HOMA-IR, статистически значимое повышение которого отмечено только в III триместре у беременных с ЗРП на фоне НКИ (3,12 [2,86; 347] против 1,97 [1,62; 2,15] в 1-й группе (p<0,001) и против 1,69 [1,32; 2,14] в контроле (p<0,001)). Уровень инсулина в группах сравнения значимо нарастал к III триместру у женщин с ЗРП, причем наибольший прирост гормона отмечался у беременных с НКИ в 1,4 раза в сравнении с 1-й группой и в 1,9 раза в сравнении с контролем. Повышение HOMA-IR на фоне НКИ укладывается в общепринятое понимание защитной роли IR при острых инфекциях, что связано с необходимостью защиты клетки-хозяина от вируса через внутриклеточные оксидативный стресс и воспаление [20]. Выявленная особенность влияния НКИ на ФПК в виде формирования патологических IR и ГИ заключается в том, что нарушение соотношения уровней IR в организме беременной, в плаценте и у плода, которые в норме различаются на 2–3 порядка [21, 29], приводит к снижению усвоения плодом энергетических и пластических биосубстратов и вносит свой вклад в развитие ЗРП.
В научных исследованиях [13, 29] убедительно доказана прямая связь МВ, МПС, патологических IR и ГИ с функциональным состоянием сосудистого эндотелия – развитием эндотелиальной дисфункции (ЭД). В ряде работ [8, 15, 19] ЭД отводится важная роль в механизмах формирования ПН, в частности ЗРП; при этом сведения по иммунной альтерации эндотелиоцитов у беременных с ПН отсутствуют. Нами получены данные по уровню ИЦ АЭАТ в динамике физиологической и осложненной ЗРП беременности. Цитотоксическое действие АЭАТ в виде положительной и резко положительной реакции зафиксировано в III триместре гестации в группе беременных с ЗРП и НКИ (табл. 2). В 1-й группе и контроле ИЦ АЭАТ фиксировался в виде отрицательной или слабоположительной реакции как во II, так и III триместрах беременности. Данное обстоятельство свидетельствует о дополнительном повреждающем воздействии SARS-CoV-2 на эндотелиоциты с развитием аутоиммунного процесса у беременных, что, с одной стороны, является неблагоприятным фактором прогрессирования С19, с другой – важным механизмом сосудистых нарушений в ФПК с реализацией ПН. Мониторинг уровня общего IgE, являющегося как маркером ЭД, так и индикатором иммунопатологического процесса у беременных с С19 [19], показал, что нарастание IgE отмечено как в 1-й, так и во 2-й группах со II триместра – в 1,3 раза по сравнению с контролем. Наиболее значимые уровни общего IgE прослежены во 2-й группе в III триместре – в 1,5 раза выше по сравнению с 1-й группой (p<0,001), что вполне объяснимо усилением иммунопатологических реакций и нарастанием ЭД на фоне НКИ.
Маркеры децидуализации, запрограммированной клеточной гибели, клеточной пролиферации и трансформации, характеризующие местный статус ФПК, в частности материнскую (ПАМГ), плодовую (ЛCD95+) части плаценты, плацентарный ангиогенез (ФРП), показали разнонаправленную динамику параметров, статистически значимо различающихся с контролем (табл. 1, 2). Уровень ПАМГ, осуществляющего контроль децидуализации стромальных клеток и регуляцию биологической активности инсулиноподобных факторов роста, у беременных высокого риска ЗРП отличается от референсных значений со II (p<0,001) и в III (p<0,001) триместрах гестации, причем наибольшие отклонения – в 1,5 раза – зафиксированы у женщин с НКИ в сроке 26–34 недель по сравнению с 1-й группой, в 7,7 раза – по сравнению с контролем. Если характер изменений в децидуальной оболочке можно объективизировать по концентрации сывороточного уровня ПАМГ, то состояние синцитиотрофобласта (плодовой части плаценты), индуцирующего апоптоз лимфоцитов, можно оценить по уровню лимфоцитов, экспрессирующих Fas/APO-1/CD95-рецептор, что связано с защитной функцией трофобласта и направлено на снижение иммунопатологических реакций в ФПК [18]. Согласно полученным данным, имеются различия в содержании ЛCD95+ у здоровых беременных и беременных женщин групп высокого риска ЗРП (p<0,001), при этом отмечается активное нарастание содержания иммуноцитов, готовых к апоптозу, в III триместре у беременных с НКИ (68,5% против 52,6% в 1-й группе (p<0,001)). Важным маркером клеточной пролиферации, развития и стабильного состояния сосудистой сети плаценты является ФРП, который закономерно снижался в 1-й и 2-й группах высокого риска ЗРП с максимальным отклонением в III триместре у женщин с ЗРП на фоне НКИ. Данный факт вполне объясним как прямым влиянием SARS-CoV-2 на ФПК через специфические рецепторы, так и опосредованным действием системных и местных патологических механизмов ЗРП и НКИ.
Для наиболее информативных параметров в отношении прогнозирования ЗРП у беременных с НКИ в конце II и III триместрах определены пороговые значения: ФРП<160 нг/мл [AUC=0,781, ОШ 0,89 (95% ДИ 0,72–0,96), p<0,01, Se 72,7%, Sp 66,9%]; ФНОα>30 нг/мл [AUC=0,706, ОШ 1,85 (95% ДИ 1,49–2,39), p<0,01, Se 70,1%, Sp 76,3%]; ПАМГ>140 нг/мл [AUC=0,693, ОШ 1,68 (95% ДИ 1,23–2,07), p<0,01, Se 67,7%, Sp 72,8%]; HOMA-IR>2,4 [AUC=0,687, ОШ 1,52 (95% ДИ 1,16–1,98), p=0,01, Se 73,3%, Sp 65,7%].
Согласно данным ROC-анализа, мониторинг маркеров состояния ФПК показал для отдельных параметров лишь «среднее» и «хорошее» качество прогнозирования ЗРП вследствие НКИ (рисунок). Для преодоления недостаточной информативности отдельных показателей был предложен ПИ, включающий интегральные характеристики ключевых патогенетических механизмов формирования ЗРП у беременных с НКИ. В качестве ПИ ЗРП у беременных, перенесших НКИ в конце II и III триместрах, предложен расчет коэффициента ПИ=ФРП/ФНОα, параметры которого характеризуют выраженность воспаления, контроль процессов клеточной пролиферации и трансформации, плацентарного ангиогенеза (ФРП, ФНОα) и обладают «хорошей» информативностью, в отличие от других отдельных показателей (ПАМГ, HOMA-IR), обладающих «средней» информационной ценностью. Значения ПИ представлены в таблице 2.
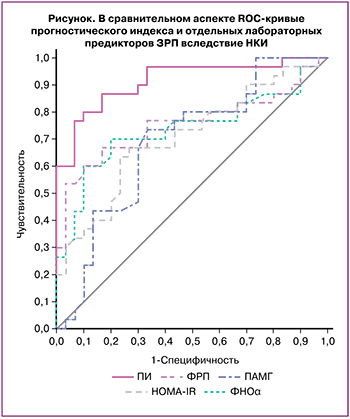
Анализ значений ПИ показал статистически значимые различия как с контролем, так и между 1-й и 2-й группами, что позволяет рекомендовать учитывать их при ведении беременных с НКИ. ROC-анализ подтвердил более высокую информационную ценность ПИ по сравнению с отдельными показателями (рисунок): AUC=0,906, ОШ 3,65 (95% ДИ 2,97–4,28), p<0,001, Se 86,7%, Sp 84,3%, что характеризует «отличное» качество прогнозирования ЗРП вследствие НКИ.
Заключение
Независимо от вариантов течения НКИ, беременные женщины относятся к уязвимой для SARS-CoV-2 группе населения, что обусловлено как гестационной иммуносупрессией, так и широким представительством в ФПК поверхностных рецепторов для внутриклеточного проникновения вируса C19. В настоящем сравнительном когортном исследовании в динамике II и III триместров беременности на примере наиболее агрессивного дельта-штамма НКИ выделены механизмы формирования ПН у беременных с НКИ, оценены лабораторно-инструментальные характеристики ЗРП вследствие НКИ с выделением высокоинформативных патогенетически обоснованных прогностических маркеров ЗРП.
Доказано, что НКИ способствует усилению таких важных для ПН звеньев патогенеза, как воспаление и протромботический статус, запрограммированная клеточная гибель и, в итоге, дестабилизация сосудистого эндотелия с нарастанием эндотелиальной дисфункции. Наряду с системными изменениями влияние НКИ на состояние ФПК реализуется и через модуляцию местных процессов в плодовой и материнской частях плаценты – децидуализации и плацентарного ангиогенеза. В ходе исследования выделены новые механизмы формирования ЗРП у беременных с C19: развитие патологических IR и ГИ в конце II и III триместрах беременности на фоне НКИ может нарушать компенсацию IR в ФПК и, следовательно, снижать усвоение энергопластического материала как плацентой, так и плодом; кроме того, присоединение иммунопатологического процесса к эндотелиоцитам вследствие их значительной альтерации SARS-CoV-2 способствует нарастанию эндотелиально-гемостазиологических, тромбовоспалительных, гемоциркуляторных, метаболических нарушений, включая ФПК.
Различия в динамике изменений маркеров ФПК у беременных группы высокого риска ЗРП без НКИ и заболевших НКИ позволили с применением статистических и математических методов выделить ПИ данной фетальной патологии, ассоциированной с ПН, основанный на выраженности воспаления и особенностях плацентарного ангиогенеза, и рекомендовать включать предложенный ПИ в комплекс динамического обследования беременных, переболевших НКИ.
Углубленное изучение патогенетических механизмов с выделением ведущих в формировании патологии плода при ПН вследствие заболеваний, имеющих важное медико-социальное значение, перспективно для определения приоритетных направлений врачебной тактики.



