Основными и значимыми проблемами перинатальной медицины и современного акушерства являются плацентарная недостаточность (ПН) и преэклампсия (ПЭ) [1–3]. В настоящее время выделяют ряд патогенетических механизмов, характерных для развития ПН: плацентарная ишемия с нарушением микроциркуляции, иммунопатологические реакции в плаценте, нарушение структуры синцитиотрофобласта, нарушение плацентарного ангиогенеза и отсутствие формирования нормального ворсинчатого древа, оксидативный стресс в тканях плаценты, дисбаланс запрограммированной клеточной гибели и клеточной пролиферации, цитокинового и гормонального профиля в фетоплацентарном комплексе (ФПК), неэффективный плацентарный энергообмен [4, 5]. Доказано, что только адекватный маточно-плацентарный кровоток (МПК) может обеспечить обмен веществ, достаточный для нормального развития плода, а в случае неполноценной инвазии трофобласта, особенно в ранние сроки гестации, закладываются основы ПН [6].
Изучению ПЭ посвящено много исследований, в которых также ведущим механизмом в патогенезе является нарушение МПК [7, 8]. При этом часть спиральных артерий миометрия не трансформируются на протяжении всей своей длины, у другой части преобразования происходят лишь в их децидуальных сегментах, что сохраняет способность сосудов к вазоконстрикции и приводит к снижению объемного кровотока в межворсинчатом пространстве. В результате возникает ишемия с развитием системного оксидативного стресса, нарушением микроциркуляции, генерализованная эндотелиально-гемостазиологическая дисфункция, иммунопатологические реакции системного характера, полисистемный дисбаланс запрограммированной клеточной гибели и клеточной пролиферации [9, 10].
Первоначальное снижение плацентарной перфузии является, при наличии предрасполагающих условий, ранним этапом системных изменений, характерных для ПЭ, что и подтверждает детерминированность ПЭ морфофункциональными нарушениями в системе «мать-плацента-плод» [11, 12]. Причем развитие ПЭ может идти по разным патогенетическим механизмам, в результате чего формируются ранний или поздний клинический вариант данного осложнения. Для ранней ПЭ характерна неполноценная инвазия трофобласта, нарушение плацентации, ремоделирования спиральных артерий, васкуло- и ангиогенеза, гипоксия тканей ФПК, отсутствие компенсаторных механизмов, раннее развитие эндотелиальной дисфункции и изменение энергообмена в плаценте. Поздняя ПЭ прогностически более благоприятна, клинически протекает менее тяжело, патология ФПК менее выражена, терапия более эффективна, отмечается более тесная связь с экстрагенитальной патологией, в основном сосудистого и метаболического генеза [7, 13]. Анализ литературы, посвященный патогенезу развития ПН и ПЭ, показывает сходство развития данных осложнений [6, 14]. Кроме того, в пользу единства генеза ПН и ПЭ свидетельствуют эпидемиологические исследования, указывающие на частое сочетание реализации ПН с последующим развитием ПЭ [15–17]. Все вышеизложенное свидетельствует о необходимости дальнейшего углубленного изучения данного вопроса, что позволит обосновать выбор единого метода профилактики данных осложнений гестации.
Цель исследования: выявить патогенетические механизмы формирования ПН и ПЭ для обоснования возможности их профилактики.
Материал и методы исследования
В исследование были включены 140 беременных женщин группы высокого риска по развитию тяжелых форм ПН. Отбор проводился с применением шкалы оценки риска декомпенсации ПН [18]. Ретроспективно, с учетом исхода беременности, были сформированы две группы: I группу составили 68 женщин с ПН; II группу – 72 женщины с сочетанием ПН и ПЭ. Результаты обследования беременных II группы дополнительно анализировались с учетом срока реализации ПЭ (манифестация ранней ПЭ до 34 недель, поздней ПЭ – после 34 недель). Контрольную III группу составили 30 здоровых женщин с физиологической гестацией.
Основной критерий включения: наличие 7 баллов и более по прогностической шкале оценки риска декомпенсации ПН. Критерии исключения: многоплодная беременность, выраженная экстрагенитальная патология, инфекционные заболевания, врожденные аномалии и наследственные заболевания плода.
Диагностика ПН и степени ее тяжести в период гестации проводилась по комплексной диагностической оценочной шкале с расчетом итогового показателя [18]. При этом учитывались результаты ультразвукового исследования, ультразвуковой допплерографии кровотоков в маточно-плацентарно-плодовом комплексе, кардиотокографии, клинического наблюдения. При значении итогового показателя 0 баллов констатировали отсутствие ПН, от 1 до 3 баллов – диагностировали I степень тяжести ПН (дисфункция плаценты); от 4 до 9 баллов – II степень тяжести (декомпенсированная ПН); от 10 до 13 баллов – III степень тяжести (прогрессирующая ПН), от 14 баллов и более – IV степень тяжести (критическая ПН). Для оценки ФПК применялись ультразвуковая система GE Voluson S6 (GE Healthcare, США), фетальный монитор «Corometrics-259» (Индия). Степень нарушения кровотоков оценивали согласно классификации А.Н. Стрижакова с соавт. [12]. При диагностике ПЭ учитывались критерии, представленные в клиническом протоколе ФГБУ НЦАГиП им. В.И. Кулакова Минздрава России (2016).

В крови женщин в сроки 8–12, 18–24, 28–34 недель беременности методами иммуноферментного, иммунофлюоресцентного, биохимического анализов («ДИА-плюс» (НПО «Биотехнология»); «Весkmеn Coulter» (США); «НВО Иммунотех» (Москва); моноклональные антитела к поверхностным антигенам лимфоцитов человека «Мед Био Спектор» (Россия); «Протеиновый контур» (Санкт-Петербург); «P&D systems» (Великобритания); «KRYPTOR» (Германия); биохимический анализатор «Конелаб ПРАЙМ 60» (Thermo Fisher Scientific, США); агрегометр Payton (США)) определяли содержание маркеров сосудисто-эндотелиальной дисфункции – циркулирующие эндотелиальные клетки (ЦЭК), общий IgE, количество тромбоцитов и их максимальная амплитуда агрегации (МААТ), фибронектин (ФН); апоптоза и воспалительного ответа – лимфоциты с фенотипом CD95+ и фактор некроза опухоли альфа (ФНОα); децидуализации стромальных клеток – плацентарный α1-микроглобулин (ПАМГ); плацентарного ангиогенеза и энергообеспечения – фактор роста плаценты (ФРП) и плацентарная щелочная фосфатаза (ПЩФ); модуляции иммунного ответа – плацентарный белок РАРР-А. Производился общий анализ крови с подсчетом лейкоцитарных индексов для оценки общего реактивного потенциала организма (ИСЛК – индекс сдвига лейкоцитов крови, ИА – индекс аллергизации). Концентрация магния в сыворотке крови определялась колориметрическим способом (реактивы Magnesium XB, «Biocom», Германия), внутриэритроцитарного магния – по методу H.J. Holtmeiera (2008). Концентрацию углекислого газа в крови определяли с помощью газового анализатора «ABL 800 FLEX» (Radiometer medical, Дания). Морфологическое исследование плацент проводилось с учетом критериев А.П. Милованова (2014).
Статистическая обработка данных была произведена с помощью программ MedCalc statistical software 14 и OriginPro 8.1. Анализ на нормальность распределений значений был проведен с помощью критериев Шапиро–Вилка и Лиллифорс. Результаты подвергали статистической обработке с использованием параметрических (среднее арифметических величин (М) и их среднее квадратическое отклонение (М±δ), критерий Фишера–Стьюдента (t)) и непараметрических (медиана (Ме) и межквартильный интервал (LQ – нижний (25-й) квартиль, HQ – верхний (75-й) квартиль), U-критерий Манна–Уитни, коэффициент ранговой корреляции Спирмена (k)) критериев. Для проверки статистической значимости различий категориальных переменных оценивался критерий согласия χ2 Пирсона. Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05 [19].
Результаты исследования и их обсуждение
 Были получены следующие результаты анализа течения и исходов беременности у женщин обеих групп сравнения (n=140): частота раннего токсикоза составила 80,0% (112 наблюдений), при этом средне-тяжелая его степень отмечена в 12,9% (n=18) случаев; ПН реализовалась в группе высокого риска по тяжелым формам ПН в 100% (n=140), в том числе тяжелые формы (с развитием задержки роста плода (ЗРП) и/или хронической гипоксии плода (ХГП)) составили 88,6% (n=124), следовательно, дисфункция плаценты (I ст. тяжести ПН – без нарушения состояния плода) составила 11,4% (n=16), ЗРП – 70% (n=98), при этом частота II и III ст. тяжести ЗРП – 35,7% (n=50), ХГП – 82,9% (n=116); ПЭ различной степени тяжести – 51,4% (n=72); преждевременная отслойка нормально расположенной плаценты – 5,7% (n=8); преждевременные роды – 14,3% (n=20); плодово-плацентарный показатель – 4,7±0,3; массо-ростовой показатель новорожденных – 54,8±5,3; частота гипоксически-ишемического поражения центральной нервной системы – 17,1% (n=24), при этом средней тяжелой степени – 7,1% (n=10); нарушение адаптации новорожденных в раннем неонатальном периоде имело место в 100% (n=140), перевод детей на второй этап лечения потребовался в 27,1% (n=38). Следовательно, в группе высокого риска по тяжелым формам ПН, изолированно от ПЭ, ПН реализовалось в 48,6% (n=68), в сочетании с ПЭ – в 51,4% (n=72).
Были получены следующие результаты анализа течения и исходов беременности у женщин обеих групп сравнения (n=140): частота раннего токсикоза составила 80,0% (112 наблюдений), при этом средне-тяжелая его степень отмечена в 12,9% (n=18) случаев; ПН реализовалась в группе высокого риска по тяжелым формам ПН в 100% (n=140), в том числе тяжелые формы (с развитием задержки роста плода (ЗРП) и/или хронической гипоксии плода (ХГП)) составили 88,6% (n=124), следовательно, дисфункция плаценты (I ст. тяжести ПН – без нарушения состояния плода) составила 11,4% (n=16), ЗРП – 70% (n=98), при этом частота II и III ст. тяжести ЗРП – 35,7% (n=50), ХГП – 82,9% (n=116); ПЭ различной степени тяжести – 51,4% (n=72); преждевременная отслойка нормально расположенной плаценты – 5,7% (n=8); преждевременные роды – 14,3% (n=20); плодово-плацентарный показатель – 4,7±0,3; массо-ростовой показатель новорожденных – 54,8±5,3; частота гипоксически-ишемического поражения центральной нервной системы – 17,1% (n=24), при этом средней тяжелой степени – 7,1% (n=10); нарушение адаптации новорожденных в раннем неонатальном периоде имело место в 100% (n=140), перевод детей на второй этап лечения потребовался в 27,1% (n=38). Следовательно, в группе высокого риска по тяжелым формам ПН, изолированно от ПЭ, ПН реализовалось в 48,6% (n=68), в сочетании с ПЭ – в 51,4% (n=72).
Во II группе ранняя ПЭ диагностирована в 72,2% (n=52), из них умеренная ПЭ – в 57,7% (n=30), тяжелая ПЭ – 42,3% (n=22); поздняя ПЭ диагностирована в 27,8% (n=20), среди которых умеренная ПЭ составила 80% (n=16), а тяжелая ПЭ – 20% (n=4). В целом, в группе беременных высокого риска по декомпенсации ПН тяжелая ПЭ составила 18,6% (n=26), умеренная ПЭ – 32,9% (n=46).
Данные гистологического исследования плацент показали, что частота нарушений функции плаценты составила 48,6% (68 наблюдений), компенсаторно-приспособительных сосудистых реакций ворсин – 44,3% (n=62); воспалительной альтерации и дегенеративных изменений морфофункциональных структур (ворсин, сосудистого коллектора, соединительной ткани) – 32,9% (n=46).
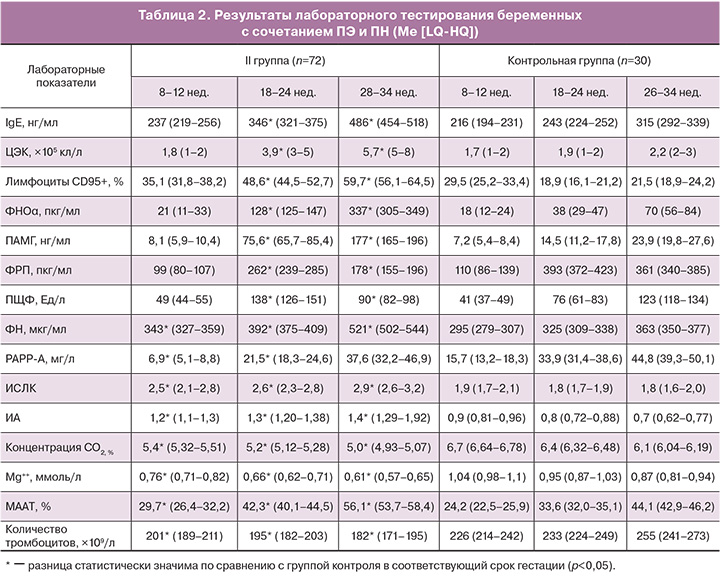
Результаты лабораторного обследования выявили достоверные различия между женщинами с физиологической беременностью и исследуемыми группами по содержанию в крови маркеров гестационной дезадаптации (табл. 1, 2).
Проанализировав полученные результаты, нужно отметить, что маркеры эндотелиальной дисфункции, такие как МААТ, ЦЭК, общий IgE, показали единый тренд в течение беременности, как у женщин с ПН, так и у женщин с сочетанием ПЭ и ПН.
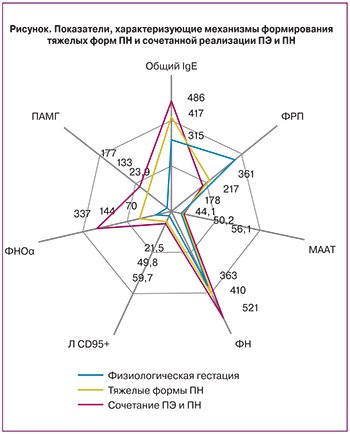
В группе контроля, у женщин с ПН содержание общего IgE, ЦЭК и МААТ к концу второй волны инвазии цитотрофобласта выросло в 1,2, 1,6 и 1,2 раза; у женщин с сочетанием ПЭ и ПН данные изменения были более выражены и составили 1,4, 2 и 1,3 раза. В III триместре значения общего IgE, ЦЭК и МААТ у женщин I группы относительно группы контроля повысились в 1,3, 1,6 и 1,2 раза; у женщин II группы – в 1,5, 2,6 и 1,3 раза. Для оценки гемостаза выбран универсальный маркер – ФН, содержание которого при физиологической беременности равномерно увеличивалось. У женщин с ПН уровень ФН с ранних сроков гестации был выше (р>0,05), а у женщин с сочетанием ПЭ и ПН данное повышение было статистически значимым, при этом в динамике увеличение составляло от 1,2 до 1,4 раза. Эти данные подтверждают значимость сосудисто-эндотелиальной дисфункции в формировании как ПН, так и ПЭ. Причем, у женщин с ПЭ изменения более выражены уже с I–II триместров.
Изучение индуцированного трофобластом апоптоза иммуноцитов [1, 5, 9], выражающегося в изменении содержания в крови лимфоцитов с фенотипом CD95+ и ФНОα, показало, что при сочетании ПЭ и ПН происходит более выраженная активация защитных свойств плаценты от иммунопатологических реакций, чем при формировании ПН: во II триместре – в 1,2 и 1,6 раза соответственно показателям; в III триместре – в 1,2 и 2,3 раза, причем значения этих показателей у женщин I и II групп статистически значимо отличаются от группы контроля.
Однонаправленность изменений маркеров запрограммированной клеточной гибели и системной воспалительной реакции подтверждает единство нарушений в ФПК как при ПН, так и при формировании ПЭ.
Концентрация ПАМГ, характеризующего децидуализацию стромальных клеток, во II и III триместрах меняется однопланово, как при ПН, так и при сочетании ПЭ и ПН. При ПН уровень ПАМГ превышает значения контрольной группы во II триместре в 3,6 раза, в III – в 5,6 раза. В группе беременных с ПЭ и ПН увеличение значений относительно группы контроля более выражено: во II и III триместрах – в 5,2 и 7,4 раза.
Содержание ФРП, характеризующего плацентарный ангиогенез [5, 12], в группах сравнения было достоверно снижено относительно среднего показателя в группе женщин с физиологической беременностью во II и III триместрах. При этом концентрация ФРП у женщин с ПН была ниже в 1,3 и 1,7 раза, а у женщин при развитии ПЭ – в 1,5 и 2 раза соответственно. Результаты изменений показателей гомеостаза представлены на рисунке.
Изменение содержания ПЩФ в сыворотке крови у беременных с ПН, а также при сочетании ПЭ и ПН, заключается в увеличении концентрации во II триместре в 1,7 и 1,8 раза относительно группы контроля; в III триместре происходит ее снижение в 1,2 и 1,4 раза соответственно. Данное волнообразное изменение содержания ПЩФ может быть объяснено тем, что повышение ПЩФ во II триместре является результатом адаптационной гиперферментемии, наблюдающейся при начальных нарушениях в ФПК, а последующее снижение уровня фермента, в более поздние сроки гестации, свидетельствует об истощении биосинтетических процессов в плаценте.
Концентрация плацентарного белка PAPP-A, рассматриваемого в настоящее время как маркера модуляции иммунного ответа и маркера ПЭ (прогностическая точность – 64,4% (ВОЗ, 2012)), была достоверно снижена в динамике гестации, причем с ранних сроков, как у женщин с ПН, так и у женщин с ПЭ и ПН, относительно группы контроля. У беременных с ПН концентрация РАРР-А была снижена в I, II и III триместрах соответственно в 1,8, 1,3 и 1,1 раза относительно женщин с физиологической гестацией. При сочетании ПЭ и ПН снижение содержания РАРР-А, относительно группы контроля, было более существенным – в 2,3, 1,6 и 1,2 раза соответственно.
Анализ динамики общего реактивного потенциала организма (лейкоцитарные индексы – ИСЛК, ИА), показал однонаправленность изменений в сравниваемых группах относительно группы контроля. Следует отметить, что отклонения показателей у женщин при сочетании ПЭ и ПН, в сравнении с женщинами с физиологической гестацией, были выражены в большей мере (р<0,05), чем у беременных I группы (р>0,05).
Результаты исследования содержания эндогенного углекислого газа, нормализирующего, как известно, тонус гладкой мускулатуры матки и сосудов ФПК, улучшающего МПК и плодово-плацентарный кровоток, регулирующего кислотно-основное состояние крови, увеличивающего степень деоксигенации оксигемоглобина [18], и магния, рассматриваемого в качестве эссенциального микроэлемента, регулирующего более 300 ферментативных реакций и участвующего в клеточном энергообмене [10, 12], в крови беременных женщин показали, что уже в I триместре имеются достоверные различия между исследуемыми беременными и женщинами с физиологической гестацией. У женщин с ПН, а также при сочетании ПЭ с ПН, с ранних сроков отмечено снижение концентрации углекислого газа (р<0,05) и магния (р<0,05). Причем в течение патологической беременности дефицит эндогенного углекислого газа, сывороточного и эритроцитарного магния нарастал. Данные сведения позволяют судить о вероятной причине возникновения как ПН, так и ПЭ у ряда беременных женщин, что делает возможным проведение единых персонализированных превентивных мероприятий уже с ранних сроков гестации, в отношении как ПН, так и ПЭ.
Корреляционный анализ между количественными значениями изученных маркеров сосудисто-эндотелиальной дисфункции (ЦЭК, общий IgE, МААТ, ФН); апоптоза и воспалительного ответа (лимфоциты с фенотипом CD95+, ФНОα); децидуализации стромальных клеток (ПАМГ); плацентарного ангиогенеза и энергообеспечения (ФРП, ПЩФ); медиатора иммунного ответа (РАРР-А); общего реактивного потенциала (ИСЛК, ИА); концентрации магния, эндогенного углекислого газа в I и II группах показал наличие средней силы и сильной ассоциативной связи (k от 0,65 до 0,93).
Внутригрупповой анализ результатов лабораторного тестирования беременных II группы выявил более ранние и более выраженные изменения при ранней ПЭ. При поздней ПЭ эти изменения были менее выражены, приближались к значениям I группы и проявлялись к III триместру. Реализация ранней ПЭ тесно патогенетически связана со структурно-функциональными нарушениями в ФПК с ранних сроков гестации, в то время как поздняя ПЭ больше связана с альтерацией на последующих этапах беременности, обострением экстрагенитальной патологии, синергическим действием других акушерских осложнений.
Исследование показало, что динамическая количественная объективизация ведущих механизмов развития нарушений в ФПК при ПН и при сочетании ПЭ и ПН позволяет за 4–6 недель до клинической манифестации данных осложнений выявлять их предикторы (РАРР-А, МААТ, ИСЛК, ИА, ФН, ЦЭК, лимфоциты CD95+, ФРП, концентрация СО2, Mg++), что обосновывает назначение превентивных мероприятий и, следовательно, предиктивный и превентивный подход к ведению беременных группы высокого риска. С учетом анамнеза, экстрагенитальной патологии, течения предыдущих и настоящей беременности, данных лабораторного тестирования становится возможным выбор персонализированного профилактического агента. Так, у женщин с нарушением сосудисто-тромбоцитарного звена с ранних сроков беременности для профилактики ПН и ПЭ обоснован прием низких доз ацетилсалициловой кислоты (согласно клиническому протоколу по ПЭ); препаратов магния; при наличии у женщин факторов, предрасполагающих к снижению чувствительности дыхательного центра к углекислому газу, или сниженной концентрации в крови углекислого газа – регулируемые дыхательные тренировки, в частности, проведение карбогенопрофилактики путем дыхания через гиперкапникатор (например, аппарат В.Ф. Фролова ТДИ-01); у женщин с привычным невынашиванием в анамнезе и/или «компрометирующим» отцовским фактором – гестаген дидрогестерон; при наличии сосудистой патологии, хронических воспалительных заболеваний органов малого таза методом выбора может быть применение ангиопротектора диосмина [7, 12, 18, 20]. Выделение общих ведущих патогенетических механизмов формирования ПН и ПЭ позволяет стратифицировать беременных женщин в отношении выбора единого метода профилактики.
Заключение
Таким образом, анализ данных по состоянию общего реактивного потенциала организма, а также по содержанию маркеров сосудисто-эндотелиальной дисфункции, апоптоза, воспалительного ответа, энергообмена в плаценте, децидуализации, ангиогенеза, модуляции иммунного ответа в крови у женщин высокого риска по развитию тяжелых форм ПН показал однонаправленность изменений как при развитии ПН, так и при реализациии ПЭ, что свидетельствует в пользу патогенетической связи нарушения формирования плацентарного комплекса и развития ПЭ.
При этом сроки реализации и степень тяжести ПЭ обусловлены началом и степенью сосудисто-эндотелиальной дезадаптации, активацией иммунопатологических реакций в плаценте, активацией индуцированной трофобластом запрограммированной клеточной гибели лимфоцитов, изменениями регуляции клеточной трансформации, децидуализации и энергообмена в плаценте, появлением и выраженностью системного воспалительного ответа: при характерных изменениях в ранней плаценте в виде эмбриоплацентарной дисфункции в последующем реализуется ранняя ПЭ; при изменениях на более поздних этапах функционирования ФПК формируется поздняя ПЭ. Необходимо отметить, что лабораторные предикторы (РАРР-А, МААТ, ИСЛК, ИА, ФН, ЦЭК, лимфоциты CD95+, ФРП, концентрация СО2, Mg++) регистрируются за 4–6 недель до клинической манифестации ПЭ и ПН, что обосновывает предиктивный и дифференцированный превентивный подход к ведению беременных группы высокого риска.



