Опухоль из клеток вольфова протока впервые описана американскими патоморфологами M.H. Kariminejad и R.E. Scully в 1973 г. В своей статье «Female adnexal tumor of probable Wolffian origin» ученые представили 9 наблюдений доброкачественных опухолей из клеток вольфова протока, располагающихся в широкой связке матки и маточной трубе [1]. На сегодняшний день опубликовано не более 100 наблюдений данной опухоли [2–12].
Во время эмбриогенеза антимюллеров гормон (АМГ) контролирует закладывание мюллерова (парамезонефрального) протока, из которого в последующем развиваются матка, маточные трубы, верхняя треть влагалища, а также вольфова (мезонефрального) протока, из которого развиваются придатки яичка, семенные пузырьки, семявыносящий и семявыбрасывающий протоки. В эмбриогенезе яичников усиленное развитие мезенхимы происходит в основании тел первичных почек, из которых выходит вольфов (мезонефральный) проток (рис. 1). У плода мужского пола высокий уровень АМГ вызывает регрессию мюллеровых протоков, а тестостерон приводит к дифференцировке вольфовых протоков. У плода женского пола вольфовы протоки подвергаются инволюции, а низкий уровень АМГ позволяет развиваться мюллерову протоку [13]. Таким образом, при нарушении дифференцировки женских половых органов у плода из зачатков вольфова протока развиваются новообразования.
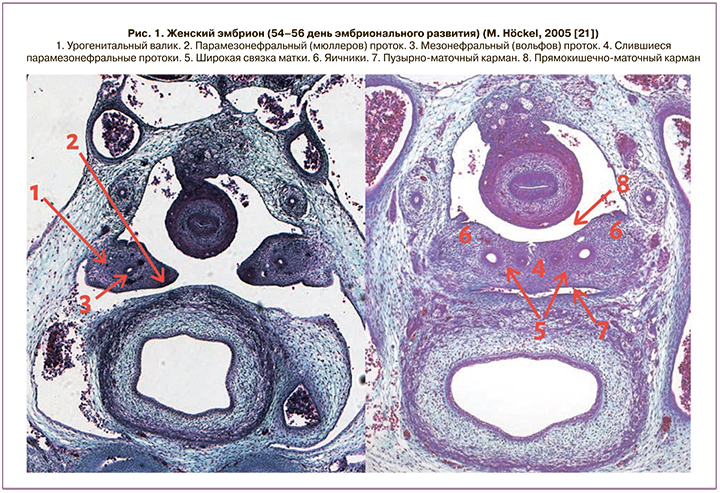
В настоящее время, согласно Международной морфологической классификации злокачественных опухолей яичников, новообразование именуется опухолью из клеток вольфова протока (WHO Classification of tumours of female reproductive organs. Revised 4th Edition – 9110/1). Синоним – «опухоль придатков, предположительно вольфова происхождения» (female adnexal tumour of probable Wolffian origin – FATWO) [14]. В подавляющем числе наблюдений опухоль обнаруживается в широкой связке матки, фаллопиевых трубах, мезосальпинксе и яичнике [15]. Однако в современной литературе описаны новообразования забрюшинной локализации в боковом канале брюшной полости [16].
Опухоли вольфова протока классифицируются ВОЗ как опухоли с неясным потенциалом злокачественности. В источниках литературы описано 19 случаев этих опухолей с отдаленным метастазированием в органы грудной и брюшной полости [17–20].
Настоящее клиническое наблюдение включает наблюдение опухоли из клеток вольфова протока у пациентки, проходившей лечение по поводу рака шейки матки IВ1 стадии.
Клиническое наблюдение
Пациентка 45 лет, обратилась в МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России по поводу рака шейки матки IB1 стадии (сT1b1N0M0). На догоспитальном этапе выполнено полное клинико-инструментальное обследование. Серологические опухолевые маркеры эпителиальных опухолей яичников и рака шейки матки были в пределах нормальных значений: СА-125 – 6 ЕД/мл (0–35 ЕД/мл), НЕ4 – 29,1 пмоль/л (пременопауза до 70 пмоль/л, постменопауза до 140 пмоль/л); антиген SCC – 2,2 нг/мл (0–2,5 нг/мл).
По данным ультразвукового исследования органов малого таза правый яичник расположен в типичном месте, размерами 22×10×18 мм, нормальной эхоструктуры. Левый яичник расположен выше уровня дна тела матки, с нечетким, но достаточно ровным контуром, размерами 57×31×33 мм, представлен многокамерным анэхогенным образованием с гиперэхогенными перегородками толщиной до 2 мм и анэхогенным гомогенным содержимым кистозных полостей, а также с наличием слабогиперэхогенного солидного компонента размерами 35×22×25 мм. При исследовании в режиме энергетического допплеровского картирования визуализируются умеренно выраженный кровоток в солидном компоненте с наличием извитых сосудов и формированием сосудистых лакун, а также сосуды в капсуле и перегородках образования. При мультифокальном допплеровском исследовании с анализом кривых скоростей кровотока были зарегистрированы следующие показатели кровотока: индекс резистентности – 0,32–0,41; максимальная артериальная скорость – 60–80 см/с; максимальная венозная скорость – 25–40 см/с; пульсативный индекс – 0,8–1,0. Высокие скорости артериального и венозного кровотока и низкий индекс резистентности указывают на отсутствие мышечной стенки во внутриопухолевых сосудах, характерное для злокачественных опухолей, что в совокупности с данными эхографического изображения левого яичника в режиме «серой шкалы» позволило нам сделать заключение о наличии злокачественной опухоли левого яичника (рис. 2).
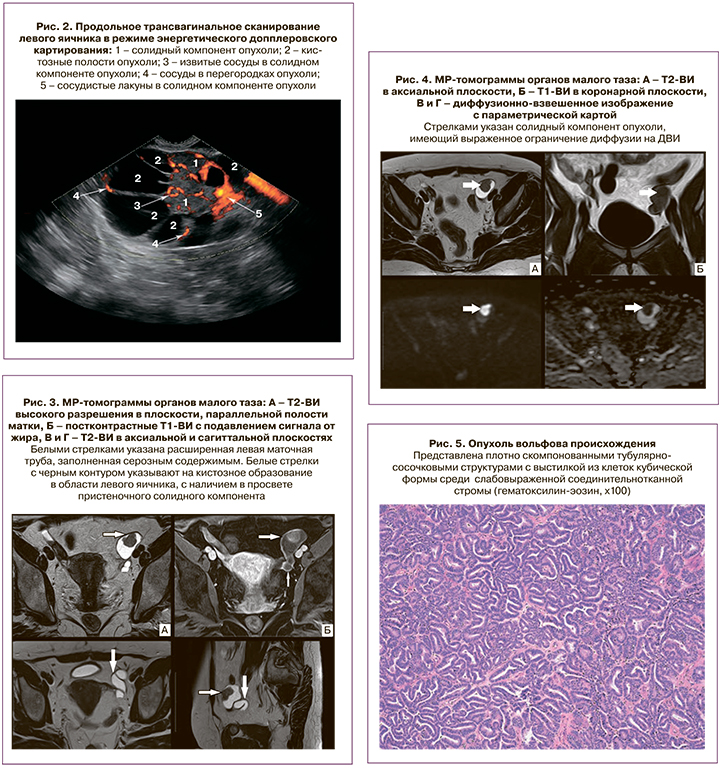
По данным магнитно-резонансной томографии (МРТ) органов малого таза в области левых придатков визуализируется извитая расширенная левая маточная труба, заполненная серозным содержимым, заканчивающаяся кистозным образованием (размерами 41×36×47 мм), с наличием в просвете пристеночного солидного компонента (размерами 26×19×30 мм). Солидный компонент образования имеет умеренно неоднородный низкоинтенсивный сигнал на Т1- и Т2-взвешенных изображениях (ВИ) (несколько выше по сравнению с мышечными тканями), контуры солидного компонента бугристые, четкие, признаков инфильтративного роста опухоли в окружающую клетчатку не выявлено. При динамическом усилении препаратами Gd отмечается умеренное накопление контраста в солидном компоненте и в стенке кистозного образования. На сериях диффузионно-взвешенных изображений (ДВИ) в солидном компоненте отмечается выраженное ограничение диффузии, средние значения измеряемого коэффициента диффузии на параметрических картах составляют 548×10-6 мм2/с (рис. 3, 4).
Таким образом, по результатам обследования у пациентки диагностируется рак шейки матки IB1 стадии (сT1b1N0M0). Что касается новообразования левого яичника, то нельзя исключить злокачественный его характер, стадируемый как IA (сT1aN0M0). Учитывая основной диагноз, пациентке было показано хирургическое лечение в объеме нервосберегающей расширенной гистерэктомии с придатками, срочное гистологическое исследование опухоли левого яичника.
На операции при ревизии свободной жидкости в малом тазу нет, в области левых придатков визуализируется кистозно-солидное образование до 6 см в диаметре с бугристой поверхностью, синюшно-бордового цвета. Препарат отправлен на срочное гистологическое исследование, по данным которого опухоль трактовалась как аденокарцинома. Интраоперационно принято решение о проведении субтотальной резекции большого сальника.
При патологоанатомическом исследовании в зоне трансформации шейки матки обнаружен очаг (протяженностью 0,5 см) инвазивной эндоцервикальной аденокарциномы обычного гистологического типа с инфильтрацией в стенку шейки матки на глубину 0,4 см. Вне опухоли матка обычного для каждого из отделов гистологического строения.
В левом яичнике в области ворот на границе с мезовариумом визуализируется киста диаметром 2,5 см, в которой определяется солитарный опухолевый узел диаметром 1,7 см, связанный со стенкой кисты тонкой ножкой. Поверхность узла гладкая, на разрезе узел представлен однородной тканью желто-серого цвета. В просвете кисты – прозрачная желтоватая жидкость. Окружающая ткань яичника – без особенностей макро- и микроскопического строения. Как уже было сказано выше, на замороженных срезах срочного интраоперационного исследования был ошибочно поставлен диагноз аденокарциномы яичника. При плановом гистологическом исследовании: опухолевый узел имеет строение эпителиальной опухоли из плотно прилежащих друг к другу тубулярно-сосочковых структур, выстланных клетками кубической формы среди слабо выраженной стромы, представленной тонкими соединительнотканными септами с сосудами. Клетки опухоли с округлыми ядрами, часть – с ядрышками. Митотическая активность отсутствует (рис. 5, 6).
Учитывая структуру опухоли, невыраженный клеточный атипизм и отсутствие митозов и некротических изменений, диагноз рака яичника оказался сомнительным. При сравнении с опухолью в шейке матки по строению это были разные опухоли. Было выполнено иммуногистохимическое исследование для уточнения гистогенеза опухоли. В клетках опухоли левого яичника не выявлена экспрессия с антителами ингибина, виментина, кальретинина, хромогранина, CD-99, CD-10, WT-1, к рецепторам эстрогенов. Опухолевые клетки экспрессируют СК-7, ЕМА. р-53 – слабоположительная в части клеток (рис. 7–9).

Обсуждение
В представленном клиническом наблюдении опухоль яичника выявлена на дооперационном этапе при обследовании по поводу аденокарциномы шейки матки (патоморфологический диагноз: эндоцервикальная аденокарцинома обычного типа).
По данным литературы, в большинстве наблюдений новообразование яичника из клеток вольфова протока диагностируется случайно при обследовании по поводу других заболеваний, как и произошло в представленном наблюдении. Возраст пациенток обычно варьирует от 13 до 83 лет (медиана – 50 лет) [22]. Обследованной пациентке 45 лет.
Визуальные методы диагностики не могут дифференцировать опухоль из клеток вольфова протока от других опухолей ввиду малочисленности наблюдений. Однако анализ японскими учеными МРТ двух клинических наблюдений новообразований показал, что низкая интенсивность сигнала вокруг опухоли на Т2-ВИ может быть характерной особенностью данной опухоли [23]. В обсуждаемом случае при проведении МРТ солидный компонент образования имел умеренно неоднородный низкоинтенсивный сигнал на Т1- и Т2-ВИ (несколько выше, по сравнению с мышечными тканями), контуры солидного компонента бугристые, четкие, признаков инфильтративного роста опухоли в окружающую клетчатку не было выявлено.
Несмотря на то что большинство опухолей из клеток вольфова протока характеризуются доброкачественным течением, описан ряд клинических случаев агрессивного поведения опухоли. Вовлечение капсулы яичника в опухолевый процесс, клеточный полиморфизм, высокая митотическая активность являются факторами неблагоприятного прогноза заболевания. По данным литературы, рецидив развивается в 5–10% наблюдений [24–26].
Дифференциальная диагностика проводится с опухолями Сертоли–Лейдига, гранулезоклеточными опухолями, высокодифференцированными эндометриоидными аденокарциномами яичников и маточных труб.
В данном наблюдении не выявлена экспрессия с антителами ингибина, виментина, кальретинина, хромогранина, CD-99, CD-10, WT-1, что помогает исключить опухоли стромы яичника и полового тяжа, которые, как уже было упомянуто выше, встают в один дифференциально-диагностический ряд с опухолью вольфова происхождения. Следует также отметить отрицательную реакцию с антителами к рецепторам эстрогенов, что не позволяет отнести эту опухоль к эндометриоидной. Экспрессия СК-7, ЕМА, очаговая и слабоположительная реакция с р-53 в данном случае не представляет диагностической значимости, так как очаговая экспрессия этих маркеров не является специфичной для определения гистогенеза и потенциала злокачественности опухолей в яичнике.
По данным мировой литературы, все опухоли вольфова происхождения должны быть панцитокератин-положительными. Описана иммуногистохимическая реакция с антителами к виментину, кальретинину, цитокератину-7, эстрогеновым и прогестероновым рецепторам, SMA, CD10, ингибину, c-kit и EMA, которая варьирует от наблюдения к наблюдению, поэтому носит вспомогательный характер и является методом исключения других наиболее распространенных опухолей, но никак не решающим диагностическим фактором [15].
При постановке диагноза опухоли вольфова происхождения рекомендуется учитывать в первую очередь расположение опухоли (в широких связках матки, в мезовариуме, на границе с тканью яичника – в местах типичной локализации остатков вольфова протока), отсутствие клеточного атипизма, инфильтративного роста в окружающие ткани и прочие признаки, типичные для других опухолей.
Недавнее исследование трех случаев опухолей вольфова протока, из которых две были доброкачественными, а одна злокачественной, показало, что злокачественная опухоль была CD56-положительной, а доброкачественные опухоли – CD-56-отрицательными [27]. В представленном клиническом случае по данным иммуногистохимического исследования экспрессия с антителами к CD-56 отсутствовала.
На сегодняшний день клинических рекомендаций по лечению опухоли из клеток вольфова протока нет. Тем не менее оптимальным методом лечения злокачественных опухолей из клеток вольфова протока принято считать радикальное хирургическое лечение: гистерэктомия с двусторонней аднексэктомией, субтотальная резекция большого сальника. Проведение органосохраняющего хирургического лечения в объеме резекции яичников допустимо лишь в случае доброкачественного характера опухоли яичников [6, 12, 24, 25].
Роль адъювантной химиотерапии, лучевой или гормональной терапии остается спорной. Однако при рецидивирующих или метастатических опухолях вольфова генеза есть опыт использования таргетной терапии (ингибиторов тирозинкиназы) [28].
Заключение
В обсуждаемом клиническом случае предпринятый объем операции соответствовал основному диагнозу: рак шейки матки IB1 ст. сT1b1N0M0, опухоль левого яичника из клеток вольфова протока. В морфологической структуре опухоли отсутствуют признаки выраженного атипизма и инвазивного роста, установлена низкая митотическая активность, отсутствие некроза, что указывает на условно доброкачественный характер опухоли. Пациентке рекомендовано динамическое наблюдение.
Таким образом, ввиду отсутствия рекомендаций по диагностике и лечению пациенток с опухолью из клеток вольфова протока описание соответствующих клинических наблюдений представляет интерес для онкологов, акушеров-гинекологов, онкогинекологов.



