Эндометриоз – процесс, при котором за пределами полости матки происходит доброкачественное разрастание ткани, по морфологическим и функциональным свойствам подобной эутопическому эндометрию. Эндометриоз поражает 10% женщин репродуктивного возраста и 35–50% женщин с тазовой болью и бесплодием [1–3]. Изменения тазовой анатомии, вызванные эндометриозом, приводят к нарушению выделения ооцита яичником, а также могут ингибировать захват яйцеклетки фимбриальным отделом и ее дальнейшую транспортировку по маточной трубе. Биохимические изменения в брюшной полости при эндометриозе приводят к иммобилизации спермы, ухудшению акросомальной реакции и, в свою очередь, нарушению слияния сперматозоида с яйцеклеткой [4, 5]. У женщин с эндометриозом отмечают плохое качество ооцитов и эмбрионов, а также снижение рецептивности эутопического эндометрия [6]. Эндометриоз яичников приводит к снижению овариального резерва, как в результате самого заболевания, так и в результате его хирургического лечения [4].
Все медикаментозные препараты, назначаемые при эндометриозе, подавляют овуляцию, а также имеют высокую стоимость, поэтому их назначение всем пациенткам после оперативного лечения может быть не целесообразным [7–9]. Медикаментозная терапия может быть эффективной только для купирования болевого синдрома, однако, убедительных данных о ее влиянии на фертильность не представлено [7, 8, 10]. Выявление пациенток с высоким риском рецидивирования после первичной операции позволяет дифференцированно назначать медикаментозную терапию, что уменьшит ненужные расходы, но не снизит фертильность у всех женщин. Кроме того, женщины с высоким риском рецидивирования эндометриоидных кист яичников (ЭКЯ) смогут своевременно сдать свои яйцеклетки в банки ооцитов [4]. Поэтому, определение и идентификация факторов риска рецидивирования ЭКЯ важны для повышения эффективности послеоперационной терапии и индивидуализации ведения пациенток в послеоперационном периоде [11].
Несмотря на большой интерес мирового сообщества к эндометриозу, практически не изучен вопрос о прогнозировании рецидивирования различных фенотипических форм эндометриоза [12, 13]. Почти все исследования сосредоточены на изучении эпидемиологических факторов и интраоперационных данных, а их результаты часто противоречат друг другу [14–17]. Биомаркеры, определяемые в тканевых образцах, могли бы стать более надежными предикторами и иметь большое практическое значение. В недавно опубликованных исследованиях найдены возможные биомаркеры рецидивирования ЭКЯ, однако, результаты некоторых работ прямо противоположны друг другу [4, 18].
Цель исследования: изучить экспрессию факторов пролиферации и апоптоза (ki-67, bcl-2), воспалительных факторов (NF-kβ p65, COX-2), факторов адгезии (b-катенин), эстрогеновых (ER-α) и прогестероновых (PR-α) рецепторов в эутопическом эндометрии и капсуле ЭКЯ у пациенток с рецидивирующим течением ЭКЯ иммуногистохимическим методом.
Материал и методы исследования
В исследование включены 60 пациенток с ЭКЯ (средний возраст составил 31,78±5,52 года) находившихся на лечении в отделении оперативной гинекологии ФГБУ НМИЦ АГП им. академика В.И. Кулакова Минздрава России в 2015–2017 гг.
Всем пациенткам проведено полное клинико-анамнестическое обследование: сбор анамнеза, общий и гинекологический осмотр, ультразвуковое исследование (УЗИ) органов малого таза, клинико-лабораторное обследование. Эндоскопическую операцию проводили по стандартизированной методике с помощью эндовидеохирургического оборудования фирмы «Karl Storz» (Германия). Всем пациенткам выполнены лапароскопия и гистероскопия. Во время операции осматривали органы брюшной полости и малого таза, при обнаружении ЭКЯ и/или эндометриоидных очагов оценивали степень распространенности эндометриоза. Диагноз ЭКЯ устанавливали на основании интраоперационного и гистологического исследований. Контроль эффективности проведенного лечения оценивали при клинико-анамнестическом обследовании через 1 и 1,5 года после оперативного вмешательства. Оценивали динамику жалоб, проводили общий и гинекологический осмотр, УЗИ органов малого таза, оценивали рецидивирование заболевания. Рецидив ЭКЯ определяли при наличии у пациентки соответствующих жалоб и выявлении кисты яичника более 1,0 см в диаметре при трансвагинальном УЗИ, не разрешающейся в течение нескольких последовательных менструальных циклов и имеющей другие ультразвуковые признаки ЭКЯ.
Критерии включения в исследование: репродуктивный возраст (18–45 лет); ЭКЯ, выявленные при лапароскопическом оперативном вмешательстве и подтвержденные при последующем гистологическом исследовании; отсутствие гормональной терапии в течение 6 месяцев до оперативного вмешательства; подписанное информированное согласие на участие в исследовании. Критерии исключения: тяжелая сопутствующая экстрагенитальная патология; злокачественные новообразования половых органов; острые воспалительные заболевания органов малого таза; наличие заболеваний, являющихся противопоказанием для оперативного лечения.
В зависимости от течения заболевания за период наблюдения 1,5 года после оперативного лечения пациентки разделены на две группы: 1-я группа – 41 пациентка без рецидива ЭКЯ (группа сравнения); 2-я группа – 19 пациенток с рецидивом ЭКЯ (основная группа).
В работе использовали гистологический и иммуногистохимический методы исследования. После фиксации в 10% растворе нейтрального формалина в течение 24 часов и стандартного протокола проводки, материал заливали в парафин. Далее серийные депарафинированные срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином. Исследование гистологических препаратов проводили в световом микроскопе при увеличении от х50 до х1000.
Иммуногистохимическое исследование капсулы ЭКЯ проводили при помощи набора Tissue-Tek Quick-Ray, который позволяет изготавливать парафиновые блоки с большим количеством образцов тканей (тканевые матрицы). Тканевая матрица (ТМА, tissue microarray) – это парафиновый блок, в котором упорядоченно расположены фрагменты тканей, вырезанные из заранее определенных участков других парафиновых блоков. Парафиновые столбики с образцами ткани, извлеченные с помощью панчера, помещали в готовые парафиновые матрицы, затем заливали парафином и отправляли на микротомию. Полученный после микротомии срез помещали на предметное стекло и подвергали дальнейшей окраске. В исследовании использовались кроличьи моноклональные антитела к фактору пролиферации клеток ki-67 (clone 30-9, rabbit monoclonal antibody, VENTANA), мышиные моноклональные антитела к регулятору апоптоза Bcl-2 (clone 124, mouse monoclonal antibody, VENTANA), кроличьи поликлональные антитела к транскрипционному фактору NF-kβ p65 (clone p65, rabbit polyclonal antibody, Spring Bioscience Corp.), мышиные моноклональные антитела к циклооксигеназе-2 (COX-2, clone СХ-294, mouse monoclonal antibody, Agilent), мышиные моноклональные антитела к b-катенину (clone 14, mouse monoclonal antibody, VENTANA) и кроличьи моноклональные антитела к эстрогеновому рецептору-α (ER-α, clone SP1, rabbit monoclonal antibody, VENTANA) и прогестероновому рецептору-α (PR-α, clone 1E2, rabbit monoclonal antibody, VENTANA). Препараты готовили по стандартному протоколу с использованием иммуногистостейнера Ventana Ultra (USA). Для правильной постановки иммуногистохимических реакций ставили положительные и отрицательные контроли. В качестве отрицательных контролей брали образцы исследуемых срезов, которые подвергались стандартной процедуре иммуногистохимической реакции, но без добавления первичных антител. Положительные контроли для каждого антитела выбирали в соответствии со спецификациями от фирмы производителя.
Экспрессию ki-67 подсчитывали в % на 3000 клеток одного типа. Экспрессию bcl-2, СОХ-2 и b-катенина оценивали в баллах: 0 баллов – отсутствие экспрессии, 1 балл – слабая экспрессия, 2 балла – умеренная экспрессия, 3 балла – сильная экспрессия.
Экспрессию NF-kβ p65 оценивали по иммуногистохимической шкале Ota [19]. Интенсивность оценивалась в баллах: 1+, 2+ и 3+. Чувствительность оценивалась в %, пересчитанных в баллы: 1+ – 0–10% позитивно окрашенных клеток, 2+ – 10–50% позитивно окрашенных клеток, 3+ – >50% позитивно окрашенных клеток.
Оценку экспрессии ER-α и PR-α проводили с учетом количества окрашенных клеток и интенсивности окраски в поверхностном эпителии, железах и строме эндометрия, используя метод гистологического счета Histo-score по формуле: HS=1а + 1b + 3c, где а – процент слабо окрашенных клеток, b – процент умеренно окрашенных клеток, с – процент слабо окрашенных клеток. Оценка результатов проводилась по следующей шкале: 0–10 баллов – отсутствие экспрессии, 11–80 баллов – слабая экспрессия, 80–140 баллов – умеренная экспрессия, 141–300 баллов – выраженная экспрессия.
Статистический анализ полученных данных проводили с применением стандартных методов математико-статистической обработки с использованием пакетов программ прикладного статистического анализа (Statistica for Windows 10.0, SPSS Statistics 22, Microsoft Excel). Для оценки межгрупповых различий значений признаков применяли тест Манна–Уитни. Для всех критериев и тестов величину критического уровня значимости принимали равной 0,05, то есть различия признавали статистически значимыми при p<0,05.
Результаты исследования
Иммуногистохимическое исследование эутопического эндометрия.
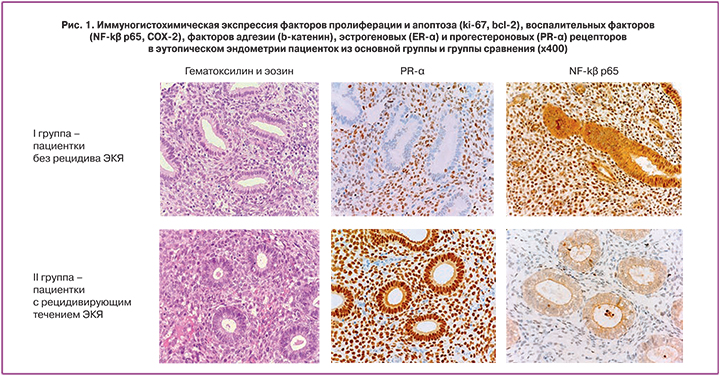
Материалом исследования являлся эутопический эндометрий пролиферативной и секреторной фаз менструального цикла от 19 пациенток с рецидивом ЭКЯ и 41 пациентки без рецидива этого заболевания (группа сравнения) полученный при оперативном лечении в результате диагностического выскабливания после гистероскопии. Мы изучили экспрессию факторов пролиферации и апоптоза (ki-67, bcl-2), воспалительных факторов (NF-kβ p65, COX-2), факторов адгезии (b-катенин), эстрогеновых (ER-α) и прогестероновых (PR-α) рецепторов иммуногистохимическим методом (табл. 1, рис. 1).
При гистологическом исследовании эутопического эндометрия пролиферативной фазы выявлено, что он соответствует средней и поздней фазам пролиферации. При гистологическом исследовании эутопического эндометрия секреторной фазы выявлено, что он соответствует ранней и средней фазам секреции. В зависимости от фазы менструального цикла эутопический эндометрий исследуемых пациенток был разделен на две группы.

Экспрессия ER-α, ki-67 и bcl-2 в стромальном и эпителиальном компонентах эутопического эндометрия статистически значимо не различается между исследуемыми группами пациенток (табл. 1).
Экспрессия PR-α в стромальном компоненте эутопического эндометрия от пациенток с рецидивирующим течением ЭКЯ выше по сравнению с пациентками без рецидива ЭКЯ, однако, полученные различия не являются статистически значимыми (р=0,152, р=0,817 соответственно, тест Манна–Уитни). Среднее значение экспрессии PR-α в эпителиальном компоненте эутопического эндометрия в секреторную фазу от пациенток с рецидивирующим течением ЭКЯ составило 285 баллов, от пациенток из группы сравнения – 255,56 балла. Экспрессия PR-α в эпителиальном компоненте эутопического эндометрия в секреторную фазу от пациенток из основной группы достоверно выше по сравнению с пациентками из группы сравнения (р=0,0253, тест Манна–Уитни) (табл. 1).
Экспрессия воспалительных факторов (NF-kβ p65, COX-2) повышена в стромальном компоненте эутопического эндометрия в пролиферативную фазу у пациенток с рецидивирующим течением ЭКЯ, однако, статистически значимые различия выявлены только для NF-kβ p65. Среднее значение экспрессии NF-kβ p65 в эпителиальном компоненте эутопического эндометрия в пролиферативную фазу от пациенток с рецидивирующим течением ЭКЯ составило 4,333 балла, от пациенток из группы сравнения – 3,656 баллов. Экспрессия NF-kβ p65 в стромальном компоненте эутопического эндометрия в пролиферативную фазу от пациенток с рецидивирующим течением ЭКЯ достоверно выше по сравнению с пациентками из группы сравнения (р=0,0278, тест Манна–Уитни) (табл. 1).
Экспрессия b-катенина в стромальном компоненте эутопического эндометрия, как в пролиферативную, так и в секреторную фазу от пациенток с рецидивирующим течением ЭКЯ выше по сравнению с пациентками без рецидива ЭКЯ, однако, полученные различия не являются статистически значимыми (р=0,626, р=0,817 соответственно, тест Манна–Уитни). Экспрессия b-катенина в эпителиальном компоненте эутопического эндометрия статистически значимо не различается между исследуемыми группами пациенток (р=0,894, р=0,537 соответственно, тест Манна–Уитни) (табл. 1).
Иммуногистохимическое исследование капсулы ЭКЯ
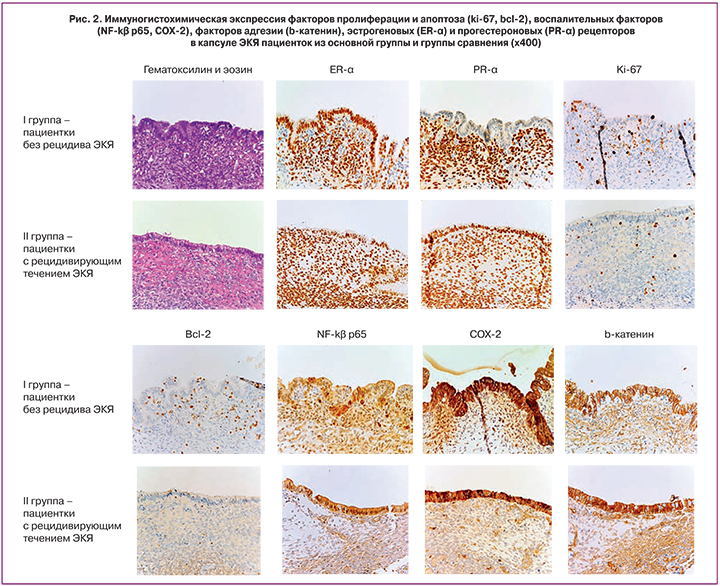
Мы исследовали экспрессию факторов пролиферации и апоптоза (ki-67, bcl-2), воспалительных факторов (NF-kβ p65, COX-2), факторов адгезии (b-катенин), эстрогеновых (ER-α) и прогестероновых (PR-α) рецепторов в капсуле ЭКЯ у 19 пациенток с рецидивом ЭКЯ и 29 пациенток без рецидива ЭКЯ иммуногистохимическим методом (табл. 2, рис. 2). При гистологическом исследовании капсула ЭКЯ была представлена участком стромы эндометриального типа с наличием неравномерно распределенных желез, выстланных эндометриальным эпителием, который мог быть индифферентным или с признаками пролиферации.
Экспрессия ER-α и Bcl-2 в стромальном и эпителиальном компонентах капсулы ЭКЯ статистически значимо не различается между исследуемыми группами пациенток (табл. 2).
Статически значимых различий в уровне экспрессии PR-α в стромальном компоненте капсулы ЭКЯ не выявлено (р=0,18, тест Манна–Уитни). Среднее значение экспрессии PR-α в эпителиальном компоненте капсулы ЭКЯ от пациенток с рецидивирующим течением ЭКЯ составило 188,46 балла (медиана 220, интерквартильный размах 220–250), от пациенток из группы сравнения – 71,15 баллов (медиана 10, интерквартильный размах 10–20). Экспрессия PR-α в эпителиальном компоненте капсулы ЭКЯ от пациенток из основной группы достоверно выше по сравнению с пациентками из группы сравнения (р=0,0277, тест Манна–Уитни) (табл. 2).
Статически значимых различий в уровне экспрессии ki-67 в стромальном компоненте капсулы ЭКЯ не выявлено (р=0,487, тест Манна–Уитни). Среднее значение экспрессии ki-67 в эпителиальном компоненте капсулы ЭКЯ от пациенток с рецидивирующим течением ЭКЯ составило 3,08% (медиана 0%, интерквартильный размах 5–12,5%), от пациенток из группы сравнения – 9,07% (медиана 5%, интерквартильный размах 2–13,75%). Экспрессия ki-67 в эпителиальном компоненте капсулы ЭКЯ от пациенток из основной группы достоверно ниже по сравнению с пациентками из группы сравнения (р=0,044, тест Манна–Уитни) (табл. 2).
Среднее значение экспрессии NF-kβ p65 в стромальном компоненте капсулы ЭКЯ от пациенток с рецидивирующим течением ЭКЯ составило 2,54 балла (медиана 3, интерквартильный размах 2–3), от пациенток из группы сравнения – 3,5 балла (медиана 4, интерквартильный размах 3–4). Экспрессия NF-kβ p65 в стромальном компоненте капсулы ЭКЯ от пациенток из основной группы достоверно ниже по сравнению с пациентками из группы сравнения (р=0,0082, тест Манна–Уитни). Статически значимых различий в уровне экспрессии NF-kβ p65 в эпителиальном компоненте капсулы ЭКЯ не выявлено (р=0,267, тест Манна–Уитни) (табл. 2).
Среднее значение экспрессии COX-2 в стромальном компоненте капсулы ЭКЯ от пациенток с рецидивирующим течением ЭКЯ составило 0,231 балла (медиана 0, интерквартильный размах 0–0), от пациенток из группы сравнения – 1,381 балл (медиана 1, интерквартильный размах 1–2). Экспрессия СОХ-2 в стромальном компоненте капсулы ЭКЯ от пациенток из основной группы достоверно ниже по сравнению с пациентками из группы сравнения (р=0,00245, тест Манна–Уитни). Статически значимых различий в уровне экспрессии COX-2 в эпителиальном компоненте капсулы ЭКЯ не выявлено (р=0,267, тест Манна–Уитни) (табл. 2).
Среднее значение экспрессии b-катенина в стромальном компоненте капсулы ЭКЯ от пациенток с рецидивирующим течением ЭКЯ составило 2,5 балла (медиана 3, интерквартильный размах 2–3), от пациенток из группы сравнения – 1,59 балла (медиана 2, интерквартильный размах 1–2). Экспрессия b-катенина в стромальном компоненте капсулы ЭКЯ от пациенток из основной группы достоверно выше по сравнению с пациентками из группы сравнения (р=0,017, тест Манна–Уитни). Уровень экспрессии b-катенина в эпителиальном компоненте капсулы ЭКЯ статистически значимо не различается между исследуемыми группами пациенток (р=0,943, тест Манна–Уитни) (табл. 2).
Мы сравнили экспрессию факторов пролиферации и апоптоза (ki-67, bcl-2), воспалительных факторов (NF-kβ p65, COX-2), факторов адгезии (b-катенин), эстрогеновых (ER-α) и прогестероновых (PR-α) рецепторов в эутопическом эндометрии и капсуле ЭКЯ у пациенток обеих исследуемых групп (табл. 1, 2).
Обнаружено достоверное понижение экспрессии ER-α в эпителиальном компоненте капсулы ЭКЯ по сравнению с эпителиальным компонентом эутопического эндометрия у пациенток с рецидивирующим течением ЭКЯ и пациенток из группы сравнения (р=0,000034, р=0,000356 соответственно), достоверное понижение экспрессии PR-α в капсуле ЭКЯ по сравнению с эутопическим эндометрием у пациенток с рецидивирующим течением ЭКЯ (в стромальном и эпителиальном компонентах) и пациенток из группы сравнения (в эпителиальном компоненте) (р=0,0197, р=0,00087, р<0,0001 соответственно), достоверное понижение экспрессии ki-67 в капсуле ЭКЯ по сравнению с эутопическим эндометрием (в стромальном и эпителиальном компонентах) у пациенток с рецидивирующим течением ЭКЯ и пациенток из группы сравнения (р=0,00098, р<0,0001, р=0,00119, 0,000079 соответственно), достоверное понижение экспрессии bcl-2 в капсуле ЭКЯ по сравнению с эутопическим эндометрием у пациенток с рецидивирующим течением ЭКЯ (в эпителиальном компоненте) и пациенток из группы сравнения (в стромальном компоненте) (р=0,00165, р=0,0225 соответственно), достоверное понижение экспрессии NF-kβ p65 в капсуле ЭКЯ по сравнению с эутопическим эндометрием у пациенток с рецидивирующим течением ЭКЯ (в стромальном компоненте) (р=0,00086 соответственно), достоверное повышение экспрессии COX-2 в капсуле ЭКЯ по сравнению с эутопическим эндометрием у пациенток из группы сравнения (в стромальном и эпителиальном компонентах) (р<0,0001, р=0,0011 соответственно) и достоверное повышение экспрессии b-катенина в капсуле ЭКЯ по сравнению с эутопическим эндометрием у пациенток с рецидивирующим течением ЭКЯ (в стромальном компоненте) (р=0,0179).
Обсуждение результатов
Как известно, провоспалительная, антиапоптотическая и проангиогенная активность являются важными факторами в патогенезе эндометриоза и связаны с половыми стероидами яичников [4]. По данным литературы, в эндометриоидной ткани изменена экспрессия ER [20] и PR [20, 21].
В нашем исследовании выявлено достоверное понижение экспрессии ER-α в капсуле ЭКЯ по сравнению с эутопическим эндометрием в обеих исследуемых группах пациенток. Полученные данные соответствуют данным литературы, согласно которым экспрессия ER-α понижена в эктопической эндометриоидной ткани [22].
Наиболее высокая экспрессия ER-α обнаружена в стромальном и эпителиальном компоненте эутопического эндометрия пролиферативной фазы по сравнению с эутопическим эндометрием секреторной фазы и капсулой ЭКЯ. Полученные результаты соответствуют данным других исследований [22, 23], согласно которым экспрессия ER-α, в основном, обнаруживается в эутопическом эндометрии пролиферативной фазы, а не в эктопической эндометриоидной ткани от женщин с эндометриозом яичников. Супрессия ER-α, которая наблюдается в секреторную фазу в эутопическом эндометрии, имеет важное значение для успешной имплантации и децидуализации [20].
По данным нашего исследования, экспрессия ER-α в стромальном и эпителиальном компоненте эутопического эндометрия и капсулы ЭКЯ статистически значимо не различается у пациенток с рецидивирующим течением ЭКЯ по сравнению с пациентками без рецидива ЭКЯ. Полученные результаты согласуются данными литературы, согласно которым уровень экспрессии ER в эутопическом эндометрии и эктопических эндометриоидных очагах не зависит от наличия/отсутствия рецидива эндометриоза [22]. Известно, что уровень mRNA ER-β, но не ER-α, повышен в эктопической эндометриоидной ткани по сравнению с эутопическим эндометрием [20], а эктопический эндометриоидный рост происходит только у подгруппы женщин с повышенным отношением ERβ/ERα и сниженным отношением PR-β/PR-α, что приводит к увеличению локальной продукции эстрогенов и способствует росту эндометриоидных очагов [20].
В нашем исследовании выявлено достоверное понижение экспрессии PR-α в капсуле ЭКЯ по сравнению с эутопическим эндометрием, как среди пациенток с рецидивом ЭКЯ, так и среди пациенток без рецидива ЭКЯ. По данным литературы, уровень экспрессии PR значительно ниже в эктопических эндометриоидных очагах по сравнению с эутопическим эндометрием [22], что соответствует нашим данным. Уровни мРНК PR-β и его белкового продукта понижены в эктопических эндометриоидных очагах, а уровень PR при иммуногистохимическом исследовании эндометриоидной ткани также имеет тенденцию к снижению [24]. Известно, что эктопическая эндометриоидная ткань не реагируют на действия прогестерона. Фенотип эндометриоидной ткани с резистентностью к прогестерону связан с повышенной способностью к клеточной пролиферации и выживаемости [20, 21]. Пониженное соотношение PR-β/PR-α и повышенное соотношение ER-β/ER-α найдено в эктопическом эндометрии от женщин с эндометриозом по сравнению с эутопическим эндометрием от женщин без эндометриоза [21].
Однако является ли измененное регулирование PR причиной или последствием прогестероновой резистентности при эндометриозе, пока не понятно.
Найдено достоверное повышение экспрессии PR-α в эпителиальном компоненте эутопического эндометрия секреторной фазы и в эпителиальном компоненте капсулы ЭКЯ у пациенток с рецидивирующим течением ЭКЯ по сравнению с пациентками без рецидива ЭКЯ. Наши данные согласуются с данными другого исследования [22], согласно которому уровень экспрессии PR достоверно понижен в эктопических эндометриоидных очагах по сравнению с эутопическим эндометрием, в то время как в эктопической эндометриоидной ткани уровень PR значительно выше в группе пациенток с рецидивом эндометриоза по сравнению с пациентками без рецидива заболевания.
В нашем исследовании выявлено достоверное понижение экспрессии ki-67 в капсуле ЭКЯ по сравнению с эутопическим эндометрием (в стромальном и эпителиальном компонентах) в обеих исследуемых группах пациенток. По нашим данным экспрессия ki-67 в эутопическом эндометрии статистически значимо не различается между исследуемыми группами пациенток, а экспрессия ki-67 в эпителиальном компоненте капсулы ЭКЯ от пациенток с рецидивом ЭКЯ достоверно ниже по сравнению с пациентками из группы сравнения, однако, интерквартильный размах совпадает на значительном протяжении. По данным S.E. Yalcin и соавт. [25], не выявлено статистически значимой разницы между средним значением индекса пролиферации ki-67 у пациенток с ранними стадиями эндометриоза (I–II) с рецидивом ЭКЯ и без рецидива ЭКЯ, однако, выявлены статистически значимые различия между средним значением индекса пролиферации ki-67 у пациенток с поздними стадиями эндометриоза (III–IV степени) с рецидивом ЭКЯ и без рецидива ЭКЯ [25]. По данным другого исследования [26] пролиферативная активность эпителиальных и стромальных клеток эндометриоидных гетеротопий яичников и эутопического эндометрия не коррелирует со стадией заболевания, но, по всей видимости, отражает особенности патогенеза заболевания.
В нашем исследовании выявлено достоверное понижение экспрессии bcl-2 в капсуле ЭКЯ по сравнению с эутопическим эндометрием у пациенток с рецидивирующим течением ЭКЯ (в эпителиальном компоненте) и пациенток из группы сравнения (в стромальном компоненте). Нарушение баланса между про- и антиапоптотическими белками приводит к аномальной клеточной диссеминации и невозможности правильного ответа на апоптотические стимулы, а также к низкому ответу на терапию, основанную на индуцировании апоптоза клеток. Идентифицировано более 25 членов белкового семейства Bcl-2 (B-клеточная лимфома 2), ответственного за регулирование клеточного апоптоза и кодируемого геном Bcl-2, который находится на хромосоме 18 [27]. Белок Bcl-2 присутствует в мембранах эндоплазматического ретикулума, ядерной капсулы и внешней митохондриальной мембраны. Он выполняет антиапоптотическую роль, ингибируя смещение цитохрома С из митохондриальной межмембранной области в цитозоль и предотвращает проапоптотические действия белков Bax и Bak. В результате, соотношение между белками Bcl-2 и Bax играет важную роль в процессе апоптоза [27].
По данным проведенных исследований [27], экспрессия белка Bcl-2 идентифицирована только в эутопическом эндометрии от женщин с эндометриозом по сравнению с эктопическим эндометрием от этих же женщин, что соответствует результатам нашего исследования. Предположительно, эндометриальная ткань этих пациенток имеет повышенный потенциал к диссеминации и, попадая в брюшную полость, развивается за пределами полости матки, что является возможным объяснением патогенеза эндометриоза. По данным R.K. Jones и соавт. [28], не выявлено статистически значимых различий между уровнем белков Bcl-2 и апоптозом в эктопической эндометриоидной ткани от женщин с эндометриозом и эутопическим эндометрием от пациенток без этого заболевания.
Таким образом, эктопический эндометрий (капсула ЭКЯ) имеет пониженную экспрессию ki-67 (фактор пролиферации) и пониженную экспрессию Bcl-2 (антиапоптотический фактор). По данным литературы [29], в развитии и прогрессировании эндометриоза важное значение имеет процесс нарушения репарации ДНК, так как при эндометриозе в ядрах и цитоплазме стромальных клеток выявлено прогрессирующее повышение экспрессии О6-метилгуанин-ДНК-метилтрансферазы (MGMT).
В нашем исследовании выявлено повышение экспрессии воспалительных факторов (NF-kβ p65, COX-2) в стромальном компоненте эутопического эндометрия в пролиферативную фазу у пациенток с рецидивирующим течением ЭКЯ по сравнению с пациентками из группы сравнения. Однако только экспрессия NF-kβ p65 в стромальном компоненте эутопического эндометрия в пролиферативную фазу у пациенток с рецидивирующим течением ЭКЯ достоверно выше по сравнению с пациентками из группы сравнения. В нашем исследовании выявлено достоверное понижение экспрессии NF-kβ p65 в стромальном компоненте капсулы ЭКЯ по сравнению со стромальным компонентом эутопического эндометрия у пациенток с рецидивом ЭКЯ. В то же время, экспрессия NF-kβ p65 достоверно понижена в стромальном компоненте капсулы ЭКЯ у пациенток с рецидивирующим течением ЭКЯ по сравнению с пациентками из группы сравнения.
NF-kβ является димерным фактором транскрипции, который регулирует экспрессию более 150 генов, вовлеченных в клеточные процессы иммунного ответа, воспалительный процесс, клеточную адгезию, ангиогенез, пролиферацию и апоптоз [30]. NF-kβ является ключевым транскрипционным фактором в регуляции экспрессии RANTES, которые индуцируют провоспалительные цитокины и хемокины и обычно ограничены в эндометриальной ткани [31]. Активация NF-kβ была обнаружена в перитонеальных эндометриоидных очагах, NF-kβ индуцировал клеточную пролиферацию и ингибировал апоптоз эндометриальных клеток. В эндометриоидных стромальных клетках эстрадиол активирует NF-kβ и ингибируется прогестероном [4]. Данные литературы относительно иммунореактивности NF-kβ у пациенток с рецидивирующим течением ЭКЯ неоднозначны. F. Shen и соавт. [18] обнаружили, что иммунореактивность NF-kβ p65 значительно выше в группе пациенток с рецидивирующим течением ЭКЯ по сравнению с группой пациенток без рецидива ЭКЯ. A.R. Han и соавт. [4] в исследовании 2017 г. обнаружили достоверное снижение экспрессии NF-kβ p65 (p=0,036) в группе пациенток с рецидивирующим течением ЭКЯ по сравнению с группой пациенток без рецидива ЭКЯ. Авторы исследования считают [4], что иммунореактивность NF-kβ р65 должна быть исследована повторно другими исследователями с привлечением более репрезентативных выборок пациенток. Поскольку NF-kβ p65, как фактор транскрипции, участвует в регуляции экспрессии СОХ-2 и многих других генов, регулирующих пролиферацию, апоптоз, ангиогенез, производство цитокинов и инвазию, его иммунореактивность является биомаркером экспрессии СОХ-2.
В нашем исследовании обнаружено достоверное повышение экспрессии СОХ-2 в стромальном компоненте капсулы ЭКЯ по сравнению со стромальным компонентом эутопического эндометрия у пациенток без рецидива ЭКЯ из группы сравнения. Сообщалось, что эктопический эндометрий продуцирует простагландины, которые, в свою очередь, вовлечены в патофизиологию эндометриоза [32]. Некоторые исследователи сообщали о более высоких уровнях простагландинов в перитонеальных жидкостях от женщин с эндометриозом по сравнению с женщинами без этого заболевания [32].
Циклооксигеназа-2 (СОХ-2), индуцибельная изоформа фермента, отвечает за конверсию арахидоновой кислоты в простагландины и, как сообщалось, вовлечена в ингибирование апоптоза, индукцию ангиогенеза и иммуноупрессию. Экспрессия COX-2 может быть заметно увеличена некоторыми факторами роста, онкогенами и факторами роста опухоли [32].
COX-2 является ферментом, влияющим на скорость простагландинового синтеза, и играет важную роль в воспалении и пролиферации при эндометриозе [30, 33]. Естественно, что факторы, регулирующие простагландиновый синтез, становятся потенциальными кандидатами для предикции рецидивирования после хирургического лечения. Недавно было показано, что СОХ-2 регулирует выживаемость, миграцию и инвазию эндометриальных клеток через множество механизмов [34]. Не удивительно, что селективные ингибиторы СОХ-2, как было показано, препятствуют имплантации эутопического эндометрия в эктопических сайтах, подавляют рост ксенотрансплантатов эндометриоза, индуцируют регресс аутологичных эндометриоидных трансплантатов и эффективны при лечении боли, связанной с эндометриозом [33]. Однако A. Fagotti и соавт. [35] сообщили, что экспрессия COX-2 не коррелирует с клинико-патологическими характеристиками и симптомами у пациентов с эндометриозом. Данные литературы относительно экспрессии СОХ-2 у пациенток с рецидивирующим течением ЭКЯ неоднозначны. По данным L. Yuan и соавт. [33], уровень экспрессии COX-2 был достоверно более высоким в группе пациенток с рецидивом эндометриоза по сравнению с группой пациенток без рецидивирования этого заболевания и эутопическим эндометрием у пациенток без эндометриоза. По данным исследования F. Fanfani и соавт. [32], повышенная экспрессия СОХ-2 была характерна для подгруппы пациенток с более низким уровнем рецидивирования ЭКЯ и более длительным безрецидивным периодом.
NF-kb р65 и СОХ-2 могут являться потенциальным биомаркерами рецидивирования ЭКЯ, однако, иммунореактивность NF-kB р65 и СОХ-2 должна быть переоценена несколькими исследователями.
В нашем исследовании выявлено достоверное повышение экспрессии b-катенина в капсуле ЭКЯ по сравнению с эутопическим эндометрием у пациенток с рецидивирующим течением ЭКЯ (в стромальном компоненте). Экспрессия b-катенина в стромальном компоненте эутопического эндометрия от пациенток с рецидивирующим течением ЭКЯ имеет тенденцию к повышению по сравнению со стромальным компонентом эутопического эндометрия от пациенток без рецидива ЭКЯ. Также по нашим данным экспрессия b-катенина достоверно повышена в стромальном компоненте ЭКЯ у пациенток с рецидивирующим течением ЭКЯ по сравнению с пациентками из группы сравнения. Известно, что b-катенин – главный структурный компонент межклеточных адгезионных соединений (адгезионные контакты), которые очень важны для поддержания эпителиальных слоев. b-катенин действует как ключевой транскрипционный фактор в каноническом Wnt/b-катениновом сигнальном пути. Активация Wnt-пути приводит к дефосфорилированию b-катенина и его накоплению в ядре клетки с последующей активацией ряда генов. Показано, что гипоксия/HIF-1a активирует b-катениновый сигнальный путь, способствуя клеточной миграции и инвазии в процессе развития эндометриоза [2, 3, 36].
Заключение
По данным иммуногистохимического исследования эктопический эндометрий (капсула ЭКЯ) характеризуется изменением экспрессии ER-α, PR-α, ki-67, bcl-2, NF-kb p65, СОХ-2 и b-катенина, которые являются факторами, участвующими в патогенезе эндометриоза. У пациенток с рецидивирующим течением ЭКЯ повышена экспрессия PR-α в эпителиальном компоненте капсулы ЭКЯ (р=0,0277), понижена экспрессия ki-67 в эпителиальном компоненте капсулы ЭКЯ (р=0,044), понижена экспрессия NF-kb p65 и СОХ-2 в стромальном компоненте капсулы ЭКЯ (р=0,0082, р=0,00245 соответственно) и повышена экспрессия b-катенина в стромальном компоненте капсулы ЭКЯ (р=0,017). По данным иммуногистохимического исследования у пациенток с рецидивирующим течением ЭКЯ повышена экспрессия PR-α в секреторную фазу в эпителиальном компоненте эутопического эндометрия (р=0,0253) и экспрессия NF-kb p65 в пролиферативную фазу в стромальном компоненте эутопического эндометрия (р=0,0278).
Иммуногистохимическое исследование экспрессии PR-α, ki-67, NF-kb p65, СОХ-2 и b-катенина в капсуле ЭКЯ и экспрессии PR-α и NF-kb p65 в эутопическом эндометрии может помочь сразу после оперативного лечения выявлять пациенток с высоким риском рецидивирования ЭКЯ.
Дальнейшие исследования этих факторов позволят изучить молекулярные механизмы, лежащие в основе патогенеза рецидивирования ЭКЯ, что позволит воздействовать на эти механизмы для устранения фундаментальных причин рецидива эндометриоза.



