Миома матки (ММ) – моноклональная доброкачественная опухоль, которая развивается из мышечной ткани [1, 2]. Желание женщин сохранить репродуктивную функцию диктует хирургам необходимость расширения показаний к проведению органосохраняющих операций, усовершенствования и рационализации существующих методов оперативного лечения.
Частота рецидивов после проведенных органосохраняющих операций достаточно высока, а повторные хирургические вмешательства являются операциями высокого риска и сложности в связи с наличием спаечного процесса, инфильтрации тканей, реактивных изменений миометрия, нарушением анатомической структуры матки [3].
ММ обладает автономным ростом, обусловленным воздействием факторов роста, ингибиторов и активаторов апоптоза, пролиферации, усилением неоангиогенеза [4]. Рост и появление новых миоматозных узлов зависят от соотношения между процессами пролиферации и апоптоза (уменьшение скорости гибели клеток путем апоптоза, повышение пролиферации) [5, 6].
В соответствии с классификацией неэпителиальных опухолей тела матки (ВОЗ, 2014) различают следующие гистологические варианты ММ: клеточная, митотически активная, эпителиоидная, миксоидная, атипическая, липолейомиома и т.д. [7].
По данным различных авторов среди рецидивных миом преобладают митотически активные и клеточные миомы – в 70% [5, 8].
Цель исследования: выявление иммуногистохимических (ИГХ) маркеров рецидивирования ММ.
Материалы и методы
В исследовании включены 13 пациенток репродуктивного возраста с диагнозом ММ – 1-я группа (средний возраст 37,9±5,5 лет) и 18 пациенток репродуктивного возраста с рецидивом ММ (РММ) – 2-я группа (средний возраст 39,9±5,2 лет), которые были обследованы и оперированы в гинекологическом отделении (руководитель отделения – акад. РАН, проф., д.м.н. Адамян Л.В.) ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России (директор – акад. РАН, проф., д.м.н. Сухих Г.Т.).
Проводили морфологическое исследование операционного материала (тканей миометрия и миоматозных узлов) в 1-м патологоанатомическом отделении ФГБУ НМИЦ АГП им. В.И. Кулакова Минздрава России (руководитель отделения – д.м.н. Асатурова А.В.). Гистологические и ИГХ препараты готовили по стандартной методике: материал фиксировали в спирт-формоле и забуференном (фосфатном) 10% нейтральном формалине. В последующем препарат подвергали обработке на аппарате гистологической проводки тканей и заливали парафином. Суммарная продолжительность фиксации, проводки и заливки материала в парафин не превышала одних суток. Для морфологического исследования из каждого блока получали не менее 10 ступенчатых срезов. Депарафинизированные срезы толщиной 5 мкм окрашивали гематоксилином и эозином по общепринятым методикам [9].
ИГХ исследование проводили на полученных после микротомии срезах и подвергали дальнейшей окраске. ИГХ реакции проводились на парафиновых срезах толщиной 4 мкм, расположенных на стеклах, покрытых L-полизином. Демаскировка антигенов для ИГХ проводилась в ретривере с использованием цитратного буфера (рН 6,0) и при мощности 600 Вт. В исследовании использовались моноклональные и поликлональные антитела к маркеру пролиферации (Ki-67), рецепторам к прогестерону (PgR), эстрогену (ER), протоонкогену (p16), супрессору опухолевого роста (p53) (clone Ventana), сосудисто-эндотелиальному фактору роста (VEGF) (abcam 1:100) [10].
Экспрессия Ki-67, VEGF, p16, p53 оценивалась в процентном соотношении положительно окрашенных клеток к общему количеству гладкомышечных клеток. Экспрессия, PgR и ER оценивалась с использованием Histo-score, который рассчитывался по формуле:
HS=1а+1b+3c,
где а – процент слабо окрашенных клеток, b – процент умеренно окрашенных клеток, с – процент сильно окрашенных клеток; 1, 2, 3 – интенсивность окрашивания, выраженная в баллах. Оценку результатов проводили по следующей шкале: 0–10 баллов – отсутствие экспрессии, 11–100 баллов – слабая экспрессия, 101–200 баллов – умеренная экспрессия, 201–300 баллов – выраженная экспрессия. Результат p16, p53 оценивали в процентах (учитывалась умеренная и выраженная интенсивность окрашивания).
Статистический анализ
Статистический анализ проводился с использованием программы StatTech v. 2.6.3 (ООО «Статтех», Россия) и с помощью таблиц Microsoft Excel. Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Сравнение двух групп по количественному показателю, имеющему нормальное распределение, при условии равенства дисперсий выполнялось с помощью t-критерия Стьюдента. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Различия показателей считали статистически значимыми при уровне значимости р<0,05.
Результаты и обсуждение
ММ была диагностирована при влагалищном исследовании, данными ультразвукового исследования, подтверждена при лапароскопии, окончательно верифицирована при патологоанатомическом исследовании Среди гистологически подтвержденных лейомиом тела матки были верифицированы простые лейомиомы тела матки (n=11, 85%) и клеточные лейомиомы (n=2, 15%); среди рецидивирующих лейомиом тела матки верифицированы простые лейомиомы тела матки (n=12, 67%), клеточные лейомиомы тела матки (n=5, 27%) и митотически активная лейомиома (n=1, 10%).
Всем женщинам было проведено хирургическое лечение в объеме лапароскопии, миомэктомии. Показаниями к оперативному лечению были обильные менструации, приводящие к анемии, выраженный болевой синдром, отсутствие эффекта от ранее проведенной консервативной терапии, бесплодие.
При анализе 2-й группы пациенток выявлено, что повторная миомэктомия понадобилась в среднем через 5,6 (4,4) лет.
Отделенные результаты после проведенного лечения оценивались через 12, 18 и 24 месяца после оперативного вмешательства. В группе впервые выявленной ММ процент рецидивирования через 12 месяцев составил 7,9%, в группе исходного рецидива – 15,7%, через 24 месяца – 15,8 и 31,2%, соответственно.
Патогенез ММ остается неизвестным, и причины возникновения опухоли, а также ее рецидивирования до сих пор являются предметом дискуссии [3]. В настоящее время нет точных критериев оценки вероятности рецидива ММ, что затрудняет выбор индивидуальной программы реабилитации пациенток.
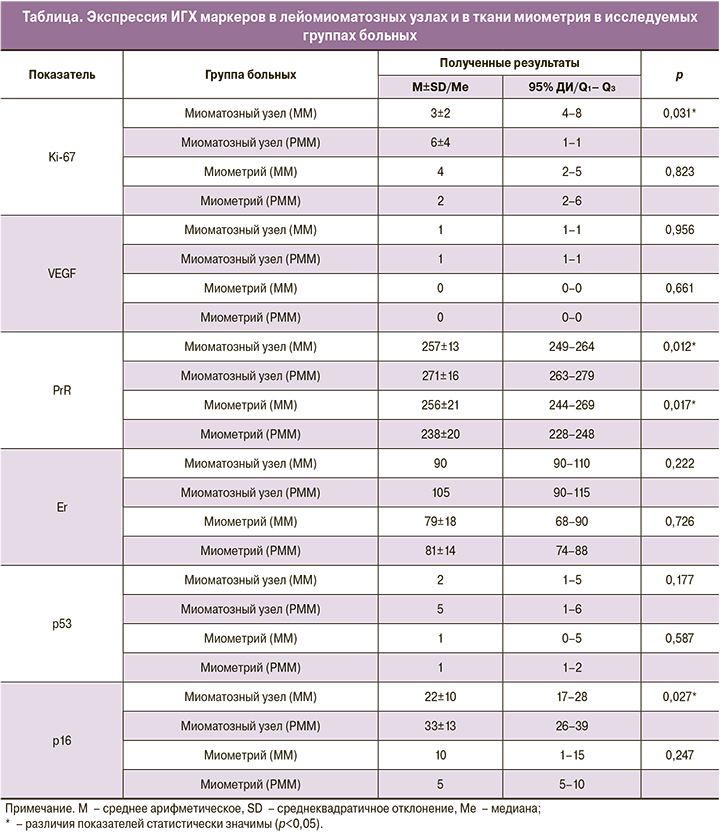
В данном исследовании проводилось патоморфологическое, а также ИГХ исследование миометрия и миоматозных узлов с маркерами Ki-67, VEGF, PgR, ER, p16, p53, которые являются взаимосвязанными компонентами сигнального пути (classical nuclear estrogen receptor pathway). Полученные результаты приведены в таблице 1 и на рисунках 1–3.

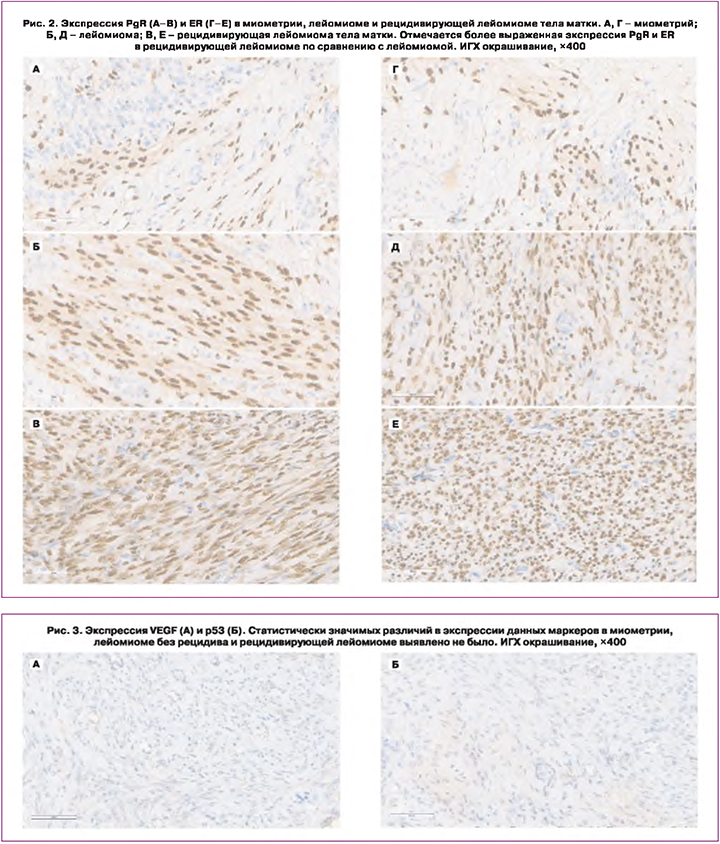
Некоторые из вышеуказанных маркеров были исследованы в единичных работах и показали свою диагностическую ценность в прогнозировании рецидивирования опухоли (Ki-67, VEGF и PgR) [5, 12]. В отношении Ki-67 и PgR результаты, полученные в этих работах, были схожи с полученными в нашем исследовании, однако ценность VEGF, как прогностического маркера нам подтвердить не удалось, как и в отношении маркера р53, который был изучен в рамках данной работы (рис. 3).
Нарушение соотношения между апоптозом и пролиферацией является основным механизмом, регулирующим темп и особенности рецидивирования патологического процесса [11].
По данным литературы белок Ki-67 отражает количество клеток, находящихся в активной фазе клеточного цикла, и используется для оценки пролиферативной клеточной активности [11, 12].
В результате проведенного исследования при оценке уровня экспрессии Кi-67 в первично диагностируемых и рецидивирующих лейомиомах нами были выявлены статистически значимые различия (p=0,031). Так, средний уровень пролиферативной активности в миоматозных узлах у пациенток 1-й группы составил 3±2%, 2-й группы – 6±4%, в то время как, в ткани миометрия у пациенток 1-й и 2-й групп не удалось установить статистически значимых различий (p=0,823). Выявленный повышенный уровень Ki-67 в образцах миомы у пациенток 2-й группы по сравнению с 1-й группой может отражать пролиферативный потенциал опухоли, наиболее подверженной рецидивированию. Ki-67 может являться косвенным маркером рецидива заболевания.
Xing-Hua Liao et al. установили высокую экспрессию Ki-67 в ММ в сравнении с гладкомышечными клетками миометрия [13]. По данным Сидоровой И.С., содержание Ki-67 увеличивалось в ряду «нормальный миометрий -> простая миома -> пролиферирующая миома -> лейомиосаркома», достигая в злокачественной опухоли уровня, во много раз превышающего уровень экспрессии в нормальном миометрии [14]. В исследовании M. Nisolle выявлено незначимое увеличение экспрессии Ki-67 в миоматозных узлах, по сравнению с тканью миометрия [15].
VEGF, влияющий на развитие новых кровеносных сосудов (ангиогенез), играет важную роль в процессе опухолевого ангиогенеза. При оценке уровня экспрессии VEGF, как в образцах лейомиом, так и в ткани миометрия, в зависимости от двух исследуемых групп больных нам не удалось установить статистически значимых различий (p=0,956 и р=0,661 соответственно). Уровень VEGF был выше в миоматозных узлах, по сравнению с образцами миометрия у пациенток как 1-й, так и 2-й групп. Аналогичные данные получены В.И. Кононенковым и соавт.: было установлено, что более выраженная экспрессия VEGF наблюдается в лейомиомах, по сравнению с прилежащим миометрием, а в лейомиосаркомах экспрессия VEGF выше, чем в лейомиомах [16].
В патогенезе роста ММ важную роль играют эстрогены и прогестерон, а также их рецепторы. Известно, что эстрогены увеличивают экспрессию РgR, а прогестерон увеличивает синтез одних факторов роста (например, эпидермального фактора роста, EGF) и ингибирует синтез других (напрмер, инсулиноподобный фактор роста I типа (IGF I), оказывая влияние на рост и пролиферацию гладкомышечных волокон лейомиомы в зависимости от микроокружения опухоли [17, 18].
Существуют две изоформы РgR, а именно PgR-А и PgR-В. Некоторые исследователи утверждают, что уровень экспрессии PgR в миоме не изменяется в течение менструального цикла, а также что в ткани миомы повышена экспрессия обеих изоформ рецептора, по сравнению с нормальным миометрием [19]. В нашем исследовании была изучена экспрессия изоформа PgR-А. Уровень экспрессии PgR-A у пациенток в 1-й группе был на 5,1% меньше по сравнению с пациентками 2-й группы (р=0,012). При этом экспрессия PgR-А в ткани миометрия у пациенток 1-ой группы составила 256±21, 2-й группы – 238256±20 (по H-score).
Экспрессия ER-α в образцах миоматозных узлов у пациенток 1-й группы составила 93 (90;110), 2-й группы – 101 (90;115), в ткани миометрия у пациенток 1-й группы – 79±18, 2-й группы – 81±14 (по H-score). Таким образом, выявленные повышенные уровни ER и PgR в ткани лейомиом у пациенток 2-й группы по сравнению с пациентками из 1-й группы, вероятно, отражают потенциал роста опухоли. По данным M. Nisolle, высокий уровень ER также был выше в миоме, но только в фазу пролиферации [15].
Одним из самых известных генов-супрессоров опухолевого роста является ген TP53. p53 – ДНК-связывающий белок, стимулирующий апоптоз. Мутации в гене TP53 в большинстве случаев обусловливают снижение опухолевой супрессорной функции данного гена, влияют на смежные сигнальные пути, приводя к потенциированию пролиферативной активности клеток, их миграции и инвазии [20].
При изучении экспрессии p53 в образцах миоматозных узлов и ткани миометрия у пациенток 1-й и 2-й групп статистически значимых различий обнаружено не было (р=0,177 и р=0,587, соответственно). Вышеописанные данные согласуются с опубликованными ранее результатами, которые свидетельствуют, что мутации в гене TP 53 и, соответственно, изменения экспрессии белка p53 не являются ведущими в патогенезе ММ [21, 22].
p16 является белком-супрессором опухолевого роста, играет важную роль в регуляции клеточного цикла, замедляя переход от фазы клеточного цикла G1 к фазе S. При мутации данного гена происходит потеря контроля над скоростью и порядком прохождения фаз деления клетки, изменяется чувствительность к сигналам, ингибирующим рост, клетка теряет способность вступать в состояние покоя и приобретает свойства неконтролируемой пролиферации. По данным Atkins et al., p16 преимущественно экспрессируется в лейомиосаркомах; данный маркер может быть полезен в дифференциальной диагностике STUMP (стромальная опухоль из гладкомышечных клеток с неясным потенциалом злокачественности) и лейомиосаркомы [23].
Исходя из полученных данных при анализе экспрессии р16 в образцах первичных и рецидивирующих лейомиом, нами были выявлены статистически значимые различия (p=0,027). Экспрессия p16 в образцах миоматозных узлов у пациенток 1-й группы была на 34% меньше, по сравнению со 2-й группой. Также необходимо отметить, что в ткани миометрия медиана исследуемого показателя у пациенток 1-й группы в два раза превышала медиану у больных 2-й группы, однако статистически значимых различий обнаружено не было (р=0,247).
По мнению Е.А. Коган, образование новых миоматозных узлов происходит в так называемых зонах роста, где сосредоточены пролиферирующие клетки, имеющие признаки стволовости, и способные продуцировать разнообразные ростовые факторы [12].
По данным Ю.Е. Караваева, рецидивирующие лейомиомы обладают более высокой пролиферативной активностью, и по гистологическому строению в этой группе выявляют большую долю митотически активных и клеточных миом, по сравнению с первичными лейомиомами. Также автор предполагает, что патогенетическими факторами рецидивирования лейомиомы являются высокие показатели Ki-67 и VEGF, как в самой лейомиоме, так и в окружающем миометрии. Высокий уровень TIMP-1 в лейомиоме препятствует ее росту и увеличивает период времени до возникновения рецидива лейомиомы [5].
При анализе различных молекулярно-генетических подтипов лейомиом матки (с мутациями MED12, гиперэкспрессией HMGA2, инактивацией FH) было выявлено, что ER и PgR были высоко экспрессированы во всех типах ММ, но в миомах с инактивацией FH выявлена более низкая экспрессия ER и более высокая экспрессия PgR. Миомы с гиперэкспрессией HMGA2 имели значительно более высокие уровни пролиферации (Ki-67) и значительно низкий уровень экспрессии p16; именно этот тип ММ обладает быстрым ростом и достигает больших размеров [24].
Заключение
Проведено морфологическое и ИГХ исследование тканей миометрия и миоматозных узлов у пациенток, оперированных по поводу впервые выявленной ММ и в связи с рецидивом заболевания.
Уровень Ki-67 выше в образцах миомы у пациенток с рецидивом ММ, что может отражать пролиферативный потенциал опухоли, наиболее подверженной рецидивированию. Ki-67 может являться косвенным маркером рецидива заболевания. Уровень VEGF выше в миоматозных узлах, по сравнению с тканью миометрия у пациенток, как с впервые выявленной ММ, так и с рецидивом миомы. Уровни ER и PgR выше в ткани миоматозных узлов у пациенток с рецидивом ММ, что отражает потенциал роста опухоли. Изменения экспрессии белка p53 не являются ведущими в патогенезе ММ. Уровень p 16 выше в миоматозных узлах у пациенток с рецидивом миомы.
При повышении пролиферации и снижении апоптоза наблюдаются высокие показатели рецидива ММ, что демонстрирует биологическую основу роста и одновременно дает обоснование таргетной терапии.
ИГХ фактором благоприятного прогноза по возникновению рецидива являются низкие показатели Ki-67, VEGF, ER, PgR, p16 в миоматозных узлах.
Необходимо продолжить дальнейшие исследования по изучению рецидивирования ММ. Проблема рецидивов ММ неразрывно связана с этиологическими факторами и не может быть решена только хирургически.



