Согласно современным представлениям, наружный генитальный эндометриоз (НГЭ) – это гормонозависимое заболевание с прогрессирующим, хроническим и рецидивирующим характером течения. НГЭ, несомненно, является мультифакторным заболеванием, важная роль в патогенезе которого также принадлежит генетическим, иммунологическим и экологическим факторам. Генитальный эндометриоз остается загадочным и многоликим в своих клинических проявлениях заболеванием, которое диагностировано более чем у 256 млн женщин в мире, ассоциировано с бесплодием у 35–50% пациенток и обуславливает развитие хронического болевого синдрома у 70–80% женщин [1, 2]. Среди гинекологических заболеваний генитальный эндометриоз прочно удерживает третье место, причем распространенность НГЭ имеет тенденцию к увеличению. Как уже отмечалось, эндометриоз поражает каждую десятую женщину репродуктивного возраста, однако описаны случаи заболевания в антенатальном, детском, подростковом, пери- и постменопаузальном периодах [3, 4].
Несмотря на современные возможности гормономодулирующей терапии, эндометриоз по-прежнему характеризуется высокой частотой рецидивов. Препараты, широко используемые в клинической практике для лечения НГЭ, имеют значительное количество побочных эффектов и являются неэффективными у части пациенток. Данные аспекты и широкая распространенность эндометриоза создают потребность в поиске и разработке новых методов медикаментозной терапии, которые могли бы повысить эффективность лечения.
По мнению ряда авторов, витамин D может играть определенную роль в патогенезе НГЭ благодаря своему антипролиферативному, противовоспалительному, антиангиогенному и иммуномодулирующему эффектам [5, 6].
Витамином D называют несколько химических соединений, близких по структуре (секостероиды) и свойствам в организме. При этом именно колекальциферол позиционируется как «истинный» витамин D, тогда как эргокальциферол, дигидротахистерол, ситокальциферол, сигма-кальциферол и другие рассматриваются лишь как модифицированные производные. Этапы образования кальцитриола хорошо известны: в эпидермисе кожи под воздействием коротковолнового ультрафиолетового излучения образуется превитамин D3 из 7-дегидрохолестерина. Далее в печени и почках соответственно осуществляются две последовательные реакции гидроксилирования, в результате которых колекальциферол превращается в кальцитриол, являющийся биологически высокоактивным метаболитом с механизмом действия, аналогичным классическому действию стероидных гормонов [7–9].
Активно обсуждается гормоноподобная роль витамина D, о которой свидетельствует способность кальцитриола связываться со специфическими рецепторами витамина D (VDR), расположенными во множестве тканей и органов, в том числе в иммунных клетках, поджелудочной железе, скелетной мускулатуре, репродуктивной системе [8]. Считается, что именно активная гормональная форма витамина D после связывания с рецепторами способна оказывать свои неклассические эффекты, которые могут воздействовать на такие звенья патогенеза НГЭ, как пролиферация, воспаление, неоангиогенез и иммунный ответ.
Цель исследования: оценить экспрессию VDR в эндометриоидных гетеротопиях и в эндометрии пациенток с НГЭ по сравнению с эндометрием контрольной группы.
Материалы и методы
В исследование были включены 52 пациентки в возрасте от 23 до 43 лет, среднее значение – 31,8 (4,3) года.
До вступления в исследование все пациентки подписали добровольное информированное согласие на участие в исследовании и забор биологического материала.
Основную группу составили 32 женщины с диагнозом НГЭ, установленным интраоперационно и подтвержденным морфологически. Распространенность заболевания оценивали согласно пересмотренной классификации Американского общества репродуктивной медицины (r-ASRM); при этом НГЭ I степени был установлен у 25% женщин, II степени – у 25%, III степени – у 37,5% пациенток, IV степени – у 12,5% больных. В исследование не включались женщины с сочетанной гинекологической патологией: синдромом поликистозных яичников, гиперплазией/полипом эндометрия или миомой матки; с тяжелыми соматическими заболеваниями, сахарным диабетом, принимающие гормональные препараты и/или препараты витамина D в течение 6 месяцев до оперативного вмешательства.
Забор материала для морфологического исследования проводился в пролиферативной фазе менструального цикла с 7-го по 11-й день, в секреторной – с 18-го по 22-й день.
Экспрессию VDR в основной группе определяли в эндометриоидных гетеротопиях и в эндометрии в секреторную (n=22) фазу и в пролиферативную фазу (n=10) менструального цикла.
В группу контроля вошли 20 женщин, проходивших обследование по поводу бесплодия, у которых при проведении диагностической лапароскопии не было выявлено гинекологических заболеваний. Из них у 50% пациенток (n=10) экспрессия VDR в эндометрии была оценена в пролиферативную фазу менструального цикла, а у других 10 женщин – в секреторную фазу менструального цикла.
Морфологическое исследование включало гистологическое и иммуногистохимическое (ИГХ) исследования эндометриоидных гетеротопий и эндометрия пациенток основной группы и группы контроля. При проведении гистологического исследования была использована стандартная методика с окрашиванием материала гематоксилином и эозином [10].
ИГХ-исследование
Для проведения ИГХ-исследования материал был подготовлен на парафиновых срезах толщиной 3 мкм. В качестве системы визуализации использовали abcam Rabbit Specific HRP Plus (ABC) Detection IHC Kit (RTU) [ab93697] (Abcam, Великобритания). Был проведен стандартный одноэтапный протокол с демаскировкой антигена в 0,01 М цитратном буфере, рН 6,0 [11]. ИГХ-метод исследования включал количественную и качественную оценку экспрессии рецепторов Anti Vitamin D Reсeptor (клон ab 3508) – реактивы производства Abcam (Великобритания) – в стандартном разведении 1:200. Морфометрия была выполнена в программе «Морфология 5.2».
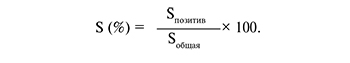
После окраски в 5 полях зрения проводилась оценка экспрессии VDR, которая была вычислена путем определения соотношения площади иммунопозитивных клеток и общей площади препарата [12]:
Статистический анализ
Для составления базы данных и статистического анализа использовали программы Excel, Statistica 10, Jamovi. Описание количественных переменных с нормальным распределением произведено через среднее значение и стандартное отклонение М (SD), а в случае распределения, отличного от нормального, – при помощи медианы, 25-го и 75-го квартилей Ме (Q1;Q3).
Для анализа ненормально распределенных данных в независимых выборках были использованы: ранговый анализ вариаций по Краскелу–Уоллису с последующим проведением множественных попарных сравнений методом Двасса–Стила–Кричлоу–Флигнера (DSCF). Все группы, представленные в данном исследовании, были независимыми, поскольку забор материала выполнялся один раз за цикл, то есть в группы, разделенные относительно фазы менструального цикла, вошли данные от разных выборок пациенток.
Различия расценивались как статистически значимые при p<0,05.
 Результаты
Результаты
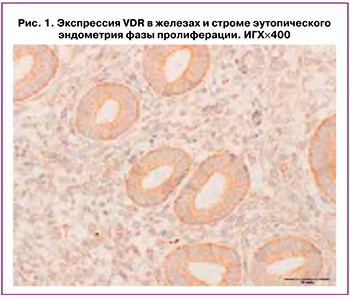
Экспрессия VDR верифицировалась в эпителии желез эутопического эндометрия и в эндометриоидных гетеротопиях (рис. 1–3), а также в эндометрии пациенток группы контроля.
Следует отметить, что по данным гистологического исследования у 5 пациенток из основной группы была выявлена гиперплазия эндометрия, и при анализе экспрессии VDR показатели данных пациенток не учитывались. У остальных обследованных строение эндометрия соответствовало пролиферативной (n=7) и секреторной (n=20) фазам цикла. Эндометриоидные гетеротопии были представлены фрагментами фиброзно-мышечной ткани с наличием желез и стромы эндометриоидного типа с хроническим воспалением и кровоизлияниями.
Оценка экспрессии VDR представлена в таблице.

При проведении сравнения методом Краскела–Уоллиса были выявлены статистически значимые различия между группами (p<0,001) как в пролиферативную, так и в секреторную фазу. Затем для проведения множественных попарных сравнений был использован метод DSCF.
Экспрессия VDR в эндометриоидных гетеротопиях была статистически значимо ниже по сравнению с экспрессией VDR в эутопическом эндометрии: в 1,6 раза в пролиферативную фазу и в 2,1 раза в секреторную фазу менструального цикла (критерий DSCF; р=0,01; р<0,0001). При сравнении экспрессии VDR в эндометриоидных гетеротопиях с эндометрием группы контроля в секреторную фазу менструального цикла также отмечалось значимое снижение уровня экспрессии – в 2,2 раза (критерий DSCF; р=0,007). Однако в пролиферативную фазу менструального цикла значимых различий между показателями экспрессии VDR в эндометриоидных гетеротопиях основной группы и эндометрии группы контроля обнаружено не было (критерий DSCF; р=0,413).
Статистически значимые отличия экспрессии VDR в эндометриоидных гетеротопиях в пролиферативную и секреторную фазы менструального цикла не выявлены (критерий Манна–Уитни; p=0,808).
Экспрессия VDR в эндометрии основной группы статистически не отличалась в разные фазы менструального цикла (критерий Манна–Уитни; р=0,314); при этом в контрольной группе в секреторную фазу менструального цикла наблюдалось повышение экспрессии VDR в 1,5 раза по сравнению с данными показателями в пролиферативную фазу (критерий Манна–Уитни; р=0,043).
Обсуждение
Результаты проведенного нами ИГХ-исследования позволили сделать вывод, что VDR экспрессируются как в гетеротопиях, так и в эндометрии больных НГЭ, а также в эндометрии женщин контрольной группы.
Ранее уже было представлено несколько работ, посвященных изучению экспрессии VDR в эндометрии женщин, однако экспрессия VDR в эндометриоидных гетеротопиях больных НГЭ не была исследована.
Zelenko Z. et al. обнаружили, что экспрессия VDR ниже в среднюю секреторную фазу по сравнению с ранней секреторной фазой менструального цикла как у женщин с НГЭ, так и в контрольной группе [13]. Bergadà L. et al. представили данные ИГХ-анализа, которые показали снижение уровня экспрессии VDR у больных с карциномой эндометрия (n=157) по сравнению с нормальным эндометрием (n=60) [14].
В свою очередь, Agic A. et al. продемонстрировали противоположные результаты. Авторы определяли экспрессию VDR в эндометрии и в яичниках у женщин, страдающих НГЭ либо раком эндометрия или яичников, и сравнивали с показателями пациенток, которым проводилось оперативное лечение по поводу доброкачественных образований яичников. При проведении ИГХ-исследования эндометрия была отмечена более выраженная экспрессия VDR в группе больных раком эндометрия, чем в группе сравнения. В эндометрии пациенток с НГЭ имелась тенденция к повышенной экспрессии VDR по сравнению с пациентками с доброкачественными образованиями яичников, хотя изменения не были статистически значимы. Кроме того, в эндометрии пациенток с НГЭ значительно более высокая экспрессия VDR была обнаружена в эпителиальном компоненте по сравнению со стромальным, чего не наблюдалось в группе сравнения [15].
Работ, посвященных изучению экспрессии VDR у больных эндометриозом, крайне мало. В доступных литературных источниках представлены неоднозначные результаты, что является основанием для продолжения исследований в данном направлении.
Результаты нашей работы продемонстрировали, что у женщин контрольной группы в эндометрии фазы секреции экспрессия VDR была в 1,5 раза выше по сравнению с уровнем экспрессии в эндометрии, находящемся в фазе пролиферации, у группы контроля, различие показателей было статистически значимым (критерий DSCF; р=0,047). Повышение экспрессии VDR в секреторную фазу, в период предполагаемого окна имплантации, вероятно, связано с прогестероноподобным действием витамина D, что может иметь значение для полноценной секреторной трансформации и успешной имплантации эмбриона.
В проспективном когортном исследовании Hormon Q.E. et al. (2020) было установлено, что у пациенток с недостаточностью и дефицитом витамина D в сыворотке крови были снижены уровни общего эстрадиола, свободного эстрадиола и прогестерона, что свидетельствует о способности витамина D напрямую влиять на продукцию стероидных гормонов и фолликулогенез [16]. В исследовании Monastra G. et al. витамин D рассматривается как стероидный гормон с прогестероноподобной активностью [17].
В нашем исследовании у больных НГЭ, напротив, не было выявлено циклических изменений экспрессии VDR, что, возможно, имеет важное значение в патогенезе заболевания и может свидетельствовать об изменении рецептивности эндометрия у больных НГЭ. Однако требуется проведение дальнейших исследований.
Согласно литературным данным, у больных НГЭ отмечено повышение частоты бесплодия в 3–4 раза по сравнению с общей популяцией [18]. Установлено, что кальцитриол способен активировать транскрипцию гена HOXA10, играющего важную роль в процессе имплантации, взаимодействии эмбриона со структурами эндометрия с помощью молекулярных и цитокиновых сигналов, улучшающих имплантацию бластоцисты. Половые стероидные гормоны (эстроген и прогестерон) оказывают воздействие на циклическую экспрессию HOXA10 в эндометрии, при этом к функциям данного гена относят регуляцию рецептивности эндометрия в период окна имплантации. Влияние 1,25(OH)2D на механизм связывания VDR с D-регулируемым элементом (VDRE) в области 5 гена HOXA10 способствует индукции транскрипции HOXA10. Витамин D в результате прямой активации транскрипции HOXA10 может индуцировать трансформацию различных тканей, в том числе эндометрия, до децидуальных клеток [19].
Таким образом, изменение метаболизма витамина D в эндометрии и отсутствие циклических изменений экспрессии VDR у больных НГЭ может привести к нарушениям имплантации и быть одной из причин эндометриоз-ассоциированного бесплодия.
Эндометриоидные гетеротопии характеризуются сниженным уровнем экспрессии VDR по сравнению с эндометрием больных НГЭ и эндометрием контрольной группы в секреторную фазу менструального цикла. При этом в эндометриоидных гетеротопиях уровень экспрессии VDR сопоставим со значениями в эндометрии контрольной группы в пролиферативную фазу менструального цикла.
Кроме представленных выше данных, для патогенетического обоснования использования колекальциферола в качестве возможной терапии НГЭ можно привести результаты работ на экспериментальных моделях хирургически индуцированного эндометриоза на мышах и крысах. В них были продемонстрированы значительное снижение площади эндометриоидных гетеротопий и в некоторых случаях – полная резорбция поражений на фоне проводимой терапии колекальциферолом и его селективным агонистом элокальцитолом [20–22]. Также в этих работах авторы продемонстрировали неклассические эффекты витамина D, среди которых: противовоспалительный эффект за счет снижения количества макрофагов и уровня провоспалительного цитокина интерлейкина-1 (IL-1) в перитонеальной жидкости [20]; антипролиферативный – развитие фиброза и апоптоза в стромальном компоненте имплантатов [21] и антиангиогенный за счет снижения уровней VEGF (васкулоэндотелиального фактора роста), матриксной металлопротеиназы-9 (MMP-9) и возможности повышать содержание TIMP-2 (тканевого ингибитора металлопротеиназ-2) [22].
В нашей предыдущей работе на основании хирургически индуцированной экспериментальной модели эндометриоза у крыс были продемонстрированы аналогичные результаты и обнаружен положительный дозозависимый эффект, характеризующийся резорбцией или регрессом очагов эндометриоза при пероральном введении колекальциферола [23].
Заключение
Таким образом, экспрессия VDR обнаружена как в эпителии желез и строме эндометрия, так и в эндометриоидных гетеротопиях. Однако экспрессия VDR в гетеротопиях оказалась статистически значимо снижена в сравнении с экспрессией VDR в эутопическом эндометрии больных НГЭ. В эндометрии основной группы не наблюдалось отличий при оценке уровня экспрессии VDR в зависимости от фазы менструального цикла; при этом в контрольной группе экспрессия VDR имела циклические изменения и была в 1,5 раза выше в секреторную фазу менструального цикла по сравнению с пролиферативной фазой.
Полученные результаты свидетельствуют о роли витамина D в патогенезе НГЭ и могут служить основанием для применения колекальциферола в качестве патогенетически обоснованной терапии НГЭ в клинической практике.



