Эндометриоз характеризуется формированием гетеротопий, включающих эпителиальные и стромальные клетки эндометрия, за пределами матки. Очаги эндометриоза демонстрируют разнообразную локализацию и обнаруживаются в ретроцервикальной клетчатке и ретровагинальной перегородке, на брюшине, матке, яичнике, мочевом пузыре, прямой кишке и аппендиксе [1]. Формированию эндометриозных очагов сопутствует развитие фиброза и спаечного процесса в брюшной полости, а также запуск каскада воспалительных процессов и манифестация болевого синдрома. При множественной локализации очагов эндометриоза и его инфильтративном характере наблюдается вовлечение в патологический процесс сразу нескольких органов, что приводит к тяжелым осложнениям, связанным с нарушением их физиологических функций. Распространенность эндометриоза в общей популяции может достигать 10%, а среди пациенток с бесплодием и/или болевым синдромом – до 50% [2].
Важно отметить, что эффективного медикаментозного лечения данного заболевания до сих пор не предложено. На данный момент существует несколько концепций этиологии и патогенеза эндометриоза [3]. Тем не менее, ключевые механизмы развития заболевания, позволяющие выявить молекулярные мишени для терапевтического воздействия, остаются недостаточно изученными.
В последнее время интенсивно изучается роль микроРНК (мкРНК) в регуляции экспрессии генов, как в норме, так и при патологии. Установлено, что мкРНК выполняют роль пост-транскрипционных репрессоров за счет взаимодействия с мРНК-мишенями, что приводит либо к деградации соответствующей мРНК, либо к остановке трансляции [4, 5]. Анализ участков связывания мкРНК-мРНК показал, что несколько мкРНК могут связываться с одной мРНК, а также одна мкРНК может взаимодействовать приблизительно с 200 мРНК [6]. Кроме этого, было установлено, что мкРНК регулируют активность факторов транскрипции, что в свою очередь может оказывать влияние на экспрессию огромного количества генов. По некоторым оценкам, до 30% генов человека являются потенциальными мишенями мкРНК [7]. Накапливающиеся данные позволяют утверждать, что мкРНК обеспечивают регуляцию процессов эмбрионального развития, клеточной дифференцировки, метаболизма, воспаления и апоптоза [8]. Изменение экспрессии мкРНК ассоциировано с опухолевым процессом, что подтверждается рядом исследований, выявившим существенные отличия экспрессии мкРНК в опухолях относительно нормальных тканей [9]. Поэтому вариация профиля экспрессии мкРНК в клетках, как в норме, так и при патологии может рассматриваться в качестве информативного параметра для оценки изменений клеточного гомеостаза. Таким образом, изучение регуляторных механизмов, реализуемых, в частности мкРНК, является актуальной задачей для понимания этапов патогенеза заболевания. В этой связи в данной работе было проведено профилирование мкРНК методом секвенирования нового поколения. При помощи данного подхода было проведено исследование экспрессии мкРНК в тканях эутопического эндометрия и эндометриозных очагов, локализованных на прямой кишке, а также проведен биоинформационный анализ сигнальных путей и процессов, регулируемых дифференциально экспрессируемыми мкРНК.
Материал и методы исследования
Ткани эутопического и эктопического эндометрия собирали в ходе хирургического вмешательства либо диагностических процедур. Ткани нормального эндометрия собирали в ходе диагностического выскабливания эндометрия. Были сформированы группы, в которые вошли пациентки с ретроцервиакльным эндометриозом и вовлечением толстой кишки. Также в исследование вошли пациентки, у которых данного заболевания выявлено не было.
У всех пациентов было получено информированное согласие на использование биоматериала для исследований. План и методика сбора биоматериала были утверждены этическим комитетом ФГБУ НМИЦ АГП им. В.И. Кулакова.
Полученные образцы тканей эндометрия разделяли на две части, одну из которых мгновенно замораживали в жидком азоте и хранили далее в биобанке при -80°С, оставшуюся часть забираемого образца отправляли в патоморфологическую лабораторию для гистологического исследования. Материал для дальнейших этапов работы отбирали на основании результатов клинических исследований (ультразвуковое исследование, магнитно-резонансная томография), протокола хирургического вмешательства и гистологического заключения, подтверждающего наличие эпителиального и стромального компонентов в очагах эктопического эндометрия.
Из образцов собранных тканей, были выделены фракции суммарной РНК, содержащие мкРНК, с использованием коммерческих наборов miRNeasy Micro Kit и RNeasy MinElute Cleanup Kit (Qiagen, США) по методике, рекомендуемой производителем. Полученные образцы использовались далее для создания библиотек кДНК и последующего секвенирования, а также для валидации дифференциально экспрессирующихся (д.э.) мкРНК методом полимеразной цепной реакции (ПЦР) в реальном времени. Качество выделенных фракций оценивали при помощи микроэлектрофореза на чипах на приборе Bioanalyser 21000 (Agilent).
Разделение образцов на группы для секвенирования микроРНК представлено в табл. 1. Библиотеки кДНК из выделенных образцов РНК готовили с использованием наборов NEBNext Multiplex Small RNA Library Prep Set for Illumina (New England Biolab, Germany), по методикам, рекомендованным производителем. Секвенирование проводили на платформе Illumina NextSeq с использованием реагентов и расходных материалов фирмы Illumina (NextSeq 500/550 High Output v2 kit). Качественный и количественный анализ библиотек проводили при помощи микроэлектрофореза (Agilent) и флуорометрии (Qubit, ThermoFisher Sci).
Качество секвенирования оценивали при помощи сервиса BaseSpace (Illumina) по следующим параметрам: плотность кластеров, интенсивность сигнала в каналах детекции, доля кластеров, прошедших фильтр, по выходу выровненных прочтений. Все параметры не выходили за пределы допустимых значений. Полученные в результате секвенирования последовательности нуклеотидов, проходили процедуру удаления адаптеров, с последующим выравниванием на базу данных мкРНК miRBase версии 21 (http://mirbase.org).
Выделенная из тканей РНК, включающая мкРНК, была преобразована в cDNA с использованием набора miScript II RT (Qiagen) по протоколу производителя. Для приготовления реакционной смеси и постановки ПЦР использовали набор miScript SYBR Green PCR Kit (Qiagen). Реакцию проводили в термоциклере StepOnePlus (Applied Biosystems, США) в следующей последовательности: вначале 15 мин при 95°С, затем 40 циклов по 15 сек при 94°C, по 30 сек при оптимизированной температуре отжига (52–60°С) и по 30 сек при 70°С. В качестве эндогенного контроля для образцов ткани использовали SNORD68.
Для оценки представленности каждой микроРНК проводили нормализацию на миллион прочтений в библиотеке. Анализ дифференциальной экспрессии выполнялся в среде R при помощи пакета DeSeq2. Для всех групп сравнения в модель включалась информация о принадлежности к группе и для парных образцов дополнительно информация о пациенте, от которого был забран материал.
Обогащение путей внутриклеточной сигнализации и биологических процессов по базе данных KEGG (http://www.genome.jp) было также проведено при помощи программы Cytoscape 3.4.09 и плагина JEPETTO10. Поиск мРНК-мишеней для мкРНК проводился при помощи базы валидированных взаимодействий miRWalk 2.0 (http://zmf.umm.uni-heidelberg.de).
Результаты исследования и обсуждение
По данным секвенирования было выявлено 429 мкРНК с разной представленностью в тканях эутопического и эктопического эндометрия. Из полученного списка мкРНК для дальнейшего анализа были отобраны представители с кратностью изменения экспрессии более двух и со средним количеством прочтений более ста в группах сравнения.
В результате обработки данных были получены наборы дифференциально экспрессированных мкРНК (д.э. мкРНК) для различных групп сравнения (табл. 1). Были выделены парные (образцы от одного пациента) и непарные группы (образцы от разных пациентов). Парные: эктопический/эутопический эндометрий в 1-ю и 2-ю фазы (Ec/Eu I, Ec/Eu II). Непарные: эутопический/нормальный (Eu/N I, Eu/N II), эктопический/нормальный (Ec/N I, Ec/N II).
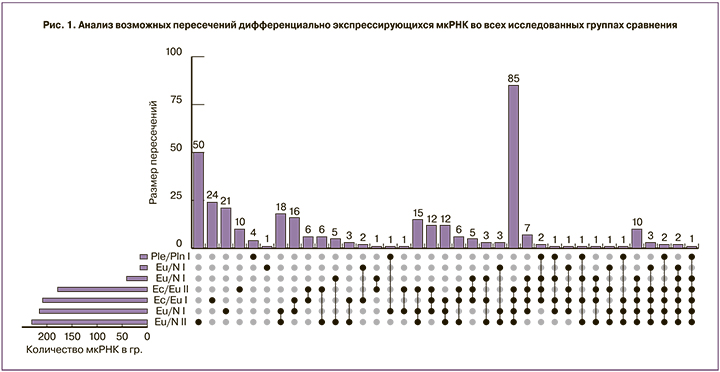
Анализ возможных пересечений д.э. мкРНК во всех перечисленных группах сравнения приведен на рис. 1. Под осью ординат приведены названия групп сравнения, слева от них показано количество д.э. мкРНК в каждом наборе, справа показаны возможные комбинации групп сравнения. Над столбиками указано количество уникальных пересечений для каждой комбинации групп сравнения. Обращает внимание комбинация групп парных и непарных образцов, включающих эктопический, эутопический и нормальный эндометрий образцов первой и второй фазы. В данной комбинации встречается наибольшее количество пересечений дифференциально экспрессирующихся мкРНК, равное 85, из которых 44 и 41 демонстрировали повышенный и пониженный уровни экспрессии, соответственно. Важно отметить, что экспрессия мкРНК во всех группах комбинации свидетельствует о независимости экспрессии от фазы цикла и малой чувствительности к источнику образца (парный, непарный).
Для валидации данных секвенирования методом ПЦР был отобран ряд д.э. мкРНК на основании количества прочтений, а также топологических параметров, полученных при анализе взаимодействий мкРНК при помощи программы Cytoscape (количество взаимодействий с мишенями, кластеризация, взаимодействие с кластерами). Был проведен анализ образцов, использованных для секвенирования, а также образцов из других парных и непарных комбинаций (табл. 2). В таблице указано среднее количество прочтений по всем образцам в качестве параметра представленности мкРНК по данным секвенирования, количество потенциальных генов-мишеней (из списка, полученного по базе miRWalk) и характер изменений, наблюдаемый при сравнении образцов эктопического эндометрия относительно эутопического. Для всех исследованных микроРНК наблюдался сходный характер изменений экспрессии при сравнении данных, полученных методами секвенирования (NGS) и ПЦР в реальном времени.
Также валидация полученных результатов проводилась при помощи оценки дифференциальной экспрессии мкРНК в тканях эндометрия по данным литературы. Нами было рассмотрено 9 исследований, в которых экспрессия мкРНК изучалась с помощью микрочиповой технологии [10–12], ПЦР [13–16], а также с использованием высокопроизводительного секвенирования [17, 18]. По данным этих работ в тканях эндометриоидных очагов наблюдалось сходное изменение направления экспрессии ряда мкРНК, обнаруженных в нашем исследовании: снижение miR-202-3p, miR-424-5p, miR-449-3p, miR-556-3p, miR-15, miR-17-5p, miR-20a, miR-200a, miR-200a, miR-200b, miR-200c, miR-182, miR-141, miR-34c, miR-451 и повышение miR-125a, miR-126, miR-143, miR-145, miR-29c, miR-21, miR-22, miR-24, miR-99a.
Поиск мишеней для д.э. мкРНК проводился при помощи базы валидированных микроРНК-мРНК взаимодействий miRWalk 2.0. В результате поиска было выявлено 5815 потенциальных генов-мишеней. Далее была проведена оценка взаимодействия отобранных мкРНК с одной и более мишенью. Обращало на себя внимание присутствие двух мкРНК (hsa-miR-20a-5p и hsa-miR-93-5p), у которых было выявлено более тысячи потенциальных мишеней и шести мкРНК (hsa-miR-574-5p, hsa-miR-24-3p hsa-miR-30c-5p hsa-miR-320a hsa-miR-375 hsa-miR-15b-5p), количество мишеней у которых находилось в диапазоне от 400 до 1000. Из оставшихся мкРНК, 8 представителей имели от 200 до 400 потенциальных мишеней и 28 от 20—200.
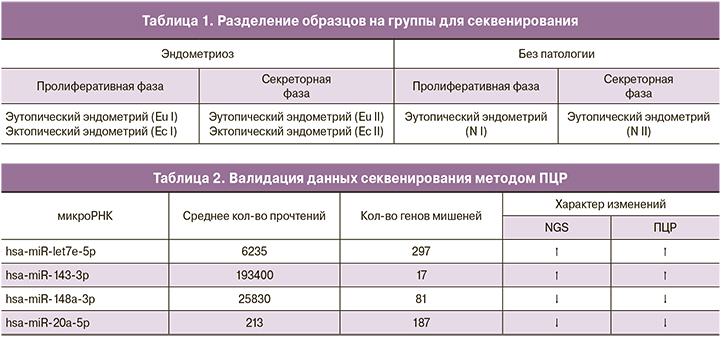
Также был проведен анализ количества мкРНК, взаимодействующих с каждым геном-мишенью. В результате было получено распределение генов-мишеней в зависимости от количества взаимодействий с ними (рис. 2). Из выявленного списка мишеней гены IGF1R и NUFIP имели максимальное количество возможных взаимодействий с выявленными дифференциально экспрессированными мкРНК (12). Гены-мишени, с которыми возможно 8 и более взаимодействий, представлены в таблице на рис. 2. Таким образом, можно предположить, что гены-мишени и мкРНК, способные формировать максимальное количество взаимодействий, являются потенциальными мастер-регуляторами клеточных процессов, изменение которых может влиять на развитие эндометриоза.
Важно отметить, что белки, кодируемые указанными генами-мишенями, являются ключевыми регуляторами базовых аспектов жизнедеятельности клетки. Среди данных генов-мишеней можно выделить представителей семейств рецепторов и факторов роста (IGF1R, VEGFA, FRS2), транскрипционных регуляторов (GATA6, MYC, E2F3, NRBP1, ZNF264, ZNF460), регуляторов апопотоза (BCL2, XIAP) и клеточного деления (CCND1, CCND2, CDKN1A, CDK6), белков-коэффекторов мкРНК (AGO1, TNRC6A). До сих пор остается открытым вопрос, участвуют ли д.э. мкРНК в регуляции экспрессии всех возможных мишеней или каждая мкРНК имеет преимущественную специфичность в отношении какой-то одной мишени. Тем не менее, наличие нескольких мкРНК, демонстрирующих разный уровень экспрессии, способных взаимодействовать с конкретной мишенью, может свидетельствовать о наличии гибкого механизма регуляции экспрессии соответствующих мастер-регуляторов в исследуемых тканях и клетках.
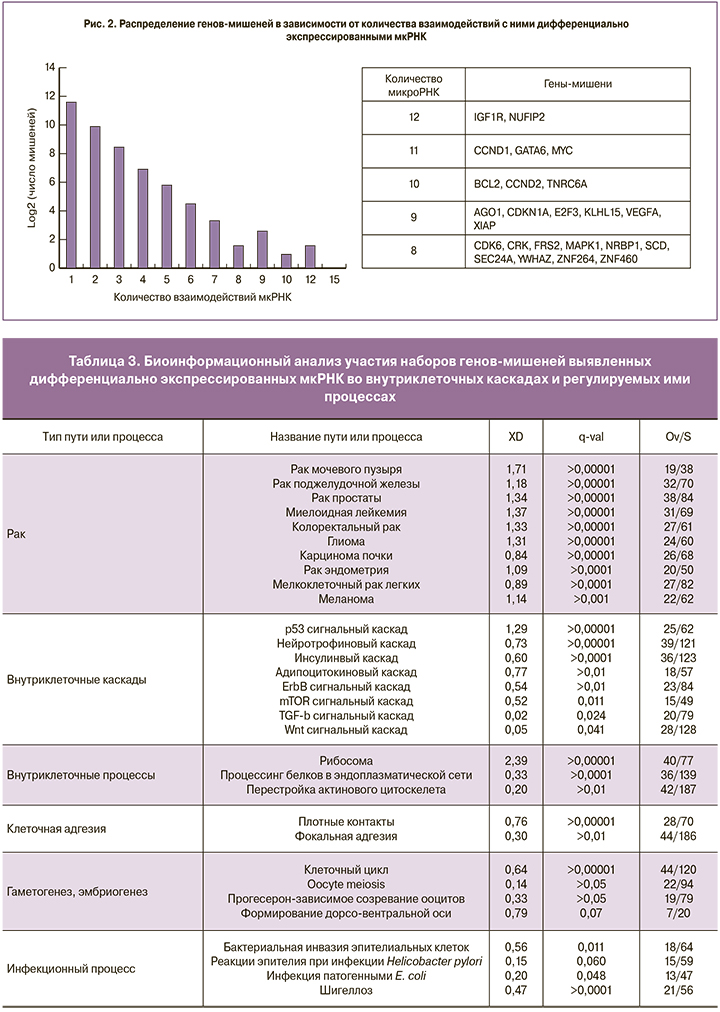
Для определения возможного участия наборов генов-мишеней во внутриклеточных каскадах и регулируемых ими процессах нами был проведен биоинформационный анализ с использованием обогащения путей и процессов по базе данных KEGG, для чего был отобран список генов-мишеней, с которыми могут взаимодействовать 2 и более мкРНК. Пути и процессы ранжировались по нескольким параметрам: XD-score (параметр оценивает насколько выражено участие списка генов в том или ином пути, находящемся в сети молекулярных взаимодействий). Положительные и более высокие значения свидетельствуют о более вероятной ассоциации найденных путей с выбранной группой генов), q-value (вероятность ошибки в расчете XD), overlap/size (отношение количества генов из списка к количеству аннотированных генов в пути). Всего было выявлено 177 путей и процессов из которых было отобрано 34 (табл. 3) на основании значений q (>0,1).
Обращает на себя внимание вовлеченность регулируемых генов в процессы пролиферации, миграции и инвазии (характерные для канцерогенеза), в ключевые каскады внутриклеточной сигнализации, воспалительные процессы (о чем свидетельствует обогащение по путям, характерным для инфекционных процессов). При этом максимально представленным по количеству задействованных генов (25) является пролиферативный процесс. С учетом комплексной и многоуровневой регуляции такого фундаментального процесса, как клеточное деление, представляется закономерным выявление при проведенном анализе групп генов, кодирующих белки клеточной адгезии, рецепторы и их лиганды, белки сигнальных каскадов и цитоскелета, ферменты и транскрипционные факторы. Ткань эндометрия является периодически обновляющейся, что обеспечивается за счет строгого контроля над ее пролиферативной активностью. Развитие эндометриоза во многом связано с нарушением процессов деления и программируемой гибели клеток эктопического эндометрия [3], о чем также свидетельствует выявленное в данной работе изменение экспрессии мкРНК, потенциально контролирующих синтез белков, регулирующих эти процессы.
Также необходимо отметить, что для большинства установленных в результате анализа потенциальных генов-мишеней мкРНК, отсутствует информация об экспрессии кодируемых ими белков в очагах эндометриоза. Основной массив данных о взаимосвязи между белковыми продуктами проанализированных генов и сигнальными путями, в которых они участвуют, получен при исследовании опухолевых или эмбриональных клеток.
Заключение
Таким образом, необходимы дальнейшие исследования с использованием «омиксных» и биоинформационных технологий, направленные на определение белковых продуктов генов, их участия в сигнальных путях и биологических процессах в клетках и тканях эктопического и эутопического эндометрия, для составления относительно полного интерактома сигнальных путей, участвующих в патогенезе эндометриоза и выявления возможных терапевтических мишеней для лечения этого заболевания.
Авторы выражают благодарность сотрудникам ФГБУ НМИЦ АГП им. В.И. Кулакова к.м.н. М.В. Мельникову, В.В. Чурсину, к.м.н. А.В. Вередченко, к.м.н. Г.Н. Хабасу, к.м.н. М.В. Санниковой.



