Нарушения цикла мочевины – группа врожденных метаболических нарушений с высоким риском летальных исходов. Цикл мочевины, или орнитиновый цикл (цикл Кребса-Хензелейта) представляет последовательность биохимических реакций, в результате которых азотсодержащие продукты распада белков, и в том числе аммиак, преобразуются в мочевину, выделяющуюся почками (рис. 1). Орнитиновый цикл является важнейшим путем обезвреживания аммиака в организме [1, 2].
Рисунок 1. Цикл мочевины [2].
Необходимость в данном цикле реакций возникает вследствие того, что высокие концентрации аммиака, образующиеся в больших количествах в результате деградации белков и нуклеотидов, оказывают повреждающее воздействие на нейроны. Мочевина, являясь нейтральным соединением с небольшими размерами и высокой растворяемостью в физиологических жидкостях, способна легко проникать через биологические мембраны, легко переноситься кровью и выделяться с мочой. Реакции цикла мочевины локализованы исключительно в клетках печени, протекают в митохондриях и цитоплазме.
Поскольку многие случаи нарушения цикла мочевины остаются не выявленными, дети, родившиеся с данными заболеваниями, часто умирают без окончательного диагноза, точная частота их встречаемости не установлена. Считается, что до 20% всех случаев синдрома внезапной смерти может быть связано с врожденными метаболическими нарушениями, и в том числе с нарушениями цикла мочевины [3]. Суммарная частота встречаемости составляет 1 случай на 10 000–20 000 живорожденных новорожденных [4]. Ведущее место в структуре занимает дефицит орнитин карбомоил трансферазы (орнитинтранскарбомилазы), составляющий 1:14 000 новорожденных (см. таблицу). Это заболевание относится к Х-сцепленным наследственным заболеваниям, при этом у мальчиков развива- ется тяжелая ранняя форма болезни, но также описано довольно большое число случаев мани- фестации заболевания у девочек-носительниц. У девочек болезнь манифестирует позднее – на первых месяцах/годах жизни и характеризуется преимущественным поражением печени [1, 3].
Патогенез патологических изменений связан с накоплением аммиака и других промежуточных продуктов метаболизма белков, обладающих ней ротоксическим эффектом.
Нарушения цикла мочевины могут манифестировать в любом возрасте, наиболее ранние случаи описаны в течение первых сут жизни, наиболее поздние – в возрасте 50–60 лет [2]. Неонатальная манифестация:
• Дети, как правило, рождаются доношенными в удовлетворительном состоянии, с нормальными показателями массы тела и роста.
• Характерен светлый промежуток в состоянии ребенка от нескольких часов до нескольких сут.
• Наиболее ранними клиническими симптомами являются вялость, отказ от еды, срыгивания, рвота, тахипное, повышенная возбудимость или синдром угнетения ЦНС.
• Постепенно состояние ухудшается за счет нарастания симптомов угнетения, могут появиться судороги, и в дальнейшем развивается кома.
• Характерно развитие респираторного алкалоза и низкий уровень мочевины в крови.
• При визуализации головного мозга (НСГ, МРТ) отмечаются неспецифические изменения в виде отека.
Диагностика
Исследование аминокислот крови и органических кислот мочи выявляет характерные изменения (табл. 1). В крови отмечают высокий уровень аммиака и низкий уровень мочевины. Молекулярно-генетическое исследование позволяет выявить характерные мутации и подтвердить диагноз.
Таблица. Нарушения цикла мочевины.
Лечение
В остром периоде необходимо полностью исключить из диеты белок, далее ребенка постепенно переводят на низкобелковую диету под контролем уровня аммиака и аминокислот в крови. Парентерально вводят растворы глюкозы и жировых эмульсий с целью обеспечения физиологической потребности ребенка в килокалориях. При развитии гипергликемии вводится инсулин.
При повышении уровня аммиака в крови назначают связывающие его препараты – бензоат и фенилбутират натрия по 250 мг/кг.
С заместительной целью вводят препараты амино- кислот: карнитин 100 мг/кг/сут, цитруллин и аргинин по 50 мг/кг/сут.
При развитии комы проводят гемофильтрацию. Необходимо избегать использования вальпроатов, т.к. при данных нарушениях существует высокий риск токсического поражения печени [1, 2].
Радикальным методом лечения является трансплантация гепатоцитов или печени, показанием к которой служит неэффективность консервативных методов [2, 5, 6].
Клиническое наблюдение
Семейный анамнез: два предыдущих ребенка (мальчики) умерли в возрасте 4 и 7 дней жизни соответственно. Оба ребенка родились в срок в удовлетворительном состоянии, с нормальными показателями массы и роста. В обоих случаях заболевание развивалось по одному сценарию. Первый ребенок родился на 40-й нед гестации с массой тела 3200 г, длиной 50 см в удовлетворительном состоянии с оценкой по шкале Апгар 7/8 баллов. Приложен к груди сразу, сосал активно. В возрасте 2 сут жизни состояние ребенка ухудшилось, появилась вялость, срыгивания, отказ от еды.
На 3-и сут стали нарастать симптомы угнетения ЦНС, мышечной гипотонии, участились срыгивания, появились признаки дыхательной недостаточности. Была заподозрена внутриутробная инфекция, в связи с чем проведено обследование, включающее общий анализ крови, общий анализ мочи, определение СРБ. Результаты были в пределах нормы. Получены также отрицательные результаты обследования на внутриутробные инфекции. При НСГ выявлены неспецифические изменения в виде умеренного повышения эхогенности перивентрикулярных зон. Результаты УЗИ органов брюшной полости, почек и сердца, рентгенологического исследования легких были в пределах нормы. К концу 3-х сут в связи с нарастанием респираторного алкалоза ребенок переведен на ИВЛ, проводилась посиндромная терапия. В возрасте 4-х сут жизни развилась кома. В связи с подозрением на нейроинфекцию выполнена люмбальная пункция, результаты которой были в пределах нормы. При повторной НСГ появились признаки отека головного мозга. Со стороны других органов патологических изменений выявлено не было, по газовому составу крови ребенок был компенсирован. В возрасте 4 сут и 20 ч была констатирована смерть. При патологоанатомическом исследовании установлен диагноз внутриутробной инфекции неуточненной этиологии.
Второй ребенок родился в срок с массой тела 3000 г, длиной 50 см, в удовлетворительном состоянии с оценкой по шкале Апгар 8/9 баллов. Приложен к груди сразу, сосал активно. В возрасте 2 сут жизни состояние ребенка ухудшилось, появилась вялость, срыгивания, отказ от еды. На 3-и сут стали нарастать симптомы угнетения ЦНС, мышечной гипотонии, усилились срыгивания, появились признаки дыхательной недостаточности. Заподозрена внутриутробная инфекция, в связи с чем было проведено обследование, включающее общий анализ крови, общий анализмочи, определение уровня СРБ. Результаты были в пределах нормы. Получены также отрицательные результаты обследования на внутриутробные инфекции. При НСГ выявлены неспецифические изменения в виде умеренного повышения эхо генности перивентрикулярных зон. Результаты УЗИ органов брюшной полости, почек и сердца, рентгенологического исследования легких были в пределах нормы. На 4-е сут в связи с развитием судорожного синдрома и нарастанием респираторного алкалоза ребенок переведен на ИВЛ, проводилась посиндромная терапия. При рентгенологическом исследовании выявлены признаки интерстициальной пневмонии, в анализе крови появились умеренные воспалительные изменения. В связи с нарастанием угнетения ЦНС и эпизодами судорожного синдрома (несмотря на проводимую терапию) заподозрена нейроинфекция и выполнена люмбальная пункция, результаты которой были в пределах нормы. При повторной НСГ появились признаки отека головного мозга. По газовому составу крови ребенок был компенсирован. В посевах крови и содержимого трахеи роста патогенной флоры выявлено не было. В возрасте 6 сут развилась кома. В возрасте 7 сут констатирована смерть. При патологоанатомическом исследовании установлен диагноз отека мозга и генерализованной инфекции, неуточненной этиологии.
Во время третьей беременности на сроке 38 нед при генетическом консультировании семьи в Медико-генетическом научном центре РАМН заподозрено наследственное нарушение обмена веществ и установлен высокий риск рождения ребенка с этим же заболеванием. Дифференциальный диагноз проводился между нарушением цикла мочевины, аминоацидопатиями и органическими ацидуриями. В первую очередь с учетом раннего начала, острого течения и пола погибших детей рассматривался вопрос о недостаточности орнитинтранскарбомилазы. От проведения молекулярно-генетического исследования до рождения ребенка семья отказалась. Было рекомендовано исследование аминокислотного спектра крови и мочи после рождения и превентивное назначение безбелковой диеты до получения результатов обследования. При обследовании женщины и плода в ФГБУ НЦ АГиП им. В.И. Кулакова патологических изменений не выявлено, рекомендовано родоразрешение в данном Центре.
Ребенок (мальчик) родился в срок в удовлетворительном состоянии с оценкой по шкале Апгар 8/9 баллов. Масса тела при рождении – 3620 г, рост – 52 см. В течение первых 10 дней жизни было назначено парентеральное питание, не содержащее белка. Вводили растворы глюкозы, жировых эмульсий, витаминов и микроэлементов, по показаниям – инсулин.
В возрасте 3 сут жизни после однократного энтерального кормления молочной смесью были сделаны анализы крови и мочи для исследования спектра аминокислот и органических кислот, а также биохимический анализ крови и кислотноосновного состояния крови. Выявлено снижение уровней цитруллина и мочевины в крови, повышение уровня оротовой кислоты в моче, что явилось основанием предположить нарушение цикла мочевины. При молекулярно генетическом исследовании обнаружена мутация Pro225Leu в 7 экзоне гена, характерная для дефицита орнитин карбамоил синтетазы – заболевания из группы нарушений цикла мочевины (рис. 1).
На фоне парентерального питания состояние ребенка оставалось удовлетворительным, кислотно-основное состояние крови и уровень аммиака были в пределах нормы.
С 10-х сут жизни начато энтеральное питание с использованием лечебной смеси, не содержащей белок (еnergyvit), на фоне приема которой появились признаки аллергического дерматита с постепенным распространением на всю поверхность тела, в связи с чем данную смесь пришлось отменить.
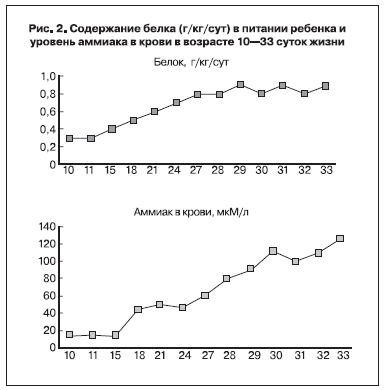
С 13-х сут жизни начато энтеральное питания в небольшом количестве из расчета по белку 0,3 г/кг/сут с постепенным увеличением до 0,8 г/кг/сут к концу первого мес жизни. Однако несмотря на достаточно низкий уровень белка, отме- чалось нарастание уровня аммиака в крови, кото- рый в течение 5 дней увеличился с 81 до 146 мкМ/л (рис. 2, см. на вклейке).
Полученные результаты явились основанием для перехода на безбелковую диету, на фоне которой уровень аммиака в крови снизился. В возрасте 37 дней жизни начато лечение бензоатом натрия, связывающим аммиак в крови, что позволило в возрасте 1,5 мес жизни в рацион питания вновь ввести белоксодержащую смесь из расчета 0,3 г/кг/сут с постепенным увеличением до 0,5 г/кг/сут под контролем уровня аммиака в крови. С заместительной целью ребенок получал препараты аминокислот: аргинин, цитруллин, а также карнитин.
В дальнейшем диета ребенка была несколько расширена, однако несмотря на соответствующую возрасту калорийность питания, отмечались низкие показатели физического развития, частые диспепсические нарушения, стойкие проявления атопического дерматита, а также эпизоды ухудшения состояния с повышением уровня аммиака в крови на фоне интеркурентных заболеваний.
В возрасте 2 лет жизни в связи с неэффективностью проводимой терапии, частыми эпизодами ухудшения состояния, выполнена родственная трансплантация печени. Послеоперационный период протекал без осложнений. К моменту написания данной статьи послеоперационный катамнез составил 2,5 года, функциональное состояние трансплантата печени в пределах нормы, метаболические нарушения полностью компенсированы, физическое и нервно-психическое развитие соответствует возрасту.
Заключение
Характерной особенностью нарушения цикла мочевины, так же как и большинства других врожденных метаболических нарушений, является ухудшение состояния ребенка после светлого промежутка, продолжительностью от нескольких часов до нескольких дней. В нашем наблюдении дети рождались доношенными, в удовлетворительном состоянии, которое ухудшалось на 2-е сут жизни. Клинические проявления при этом, как правило, неспецифические, протекающие под маской неврологических нарушений различной степени выраженности и инфекционных заболеваний. При отсутствии своевременно назначенной терапии, включающей безбелковую и в дальнейшем низкобелковую диету в сочетании с препаратами, связывающими аммиак, дети погибают от отека мозга. При патологоанатомическом исследовании какие- либо специфические изменения отсутствуют, что не позволяет верифицировать диагноз. Во многих странах в настоящее время отмечается тенденция к повышению частоты встречаемости нарушения цикла мочевины, так же как и других нарушений, в связи с включением спектра аминокислот, органических кислот и ацилкарнитинов, определяемых методом тандемной масс-спектрометрии, в неонатальный скрининг [3]. Таким образом, выявляются не только тяжелые неонатальные формы заболевания, но и более легкие, манифестирующие в более позднем возрасте, что позволяет предупредить развитие тяжелых неврологических кризов, нередко приводящих к серьезным последствиям.



