В настоящее время беременность у женщин с трансплантированными органами, онкологическими или аутоиммунными заболеваниями не считается абсолютным противопоказанием. Однако серьезную проблему представляет необходимость продолжения приема беременной женщиной лекарственных препаратов, большинство из которых обладают иммуносупрессивным действием, а некоторые и потенциальным тератогенным или токсическим воздействием на плод [1]. Поэтому при назначении иммунодепрессантов следует учитывать более высокие риски осложнений беременности и неблагоприятных исходов для матери и новорожденного.
Успешный исход беременности для матери и ребенка связан с тщательным планированием и ведением беременности, выбором химиопрепаратов, необходимых для лечения основного заболевания. Возможное тератогенное или токсическое действие химиотерапевтического агента, используемого во время беременности, зависит от суммарной дозы и от стадии развития плода. Химиотерапия в течение I триместра увеличивает риск спонтанных абортов, внутриутробной смерти и врожденных пороков [2–5]. Спектр применяемых во время беременности химиопрепаратов ограничен, что связано с возможностью многих из них пассивно проходить через плацентарный барьер. Тем не менее концентрация их в крови плода находится на более низком уровне, чем у матери, что обусловлено изменением фармакокинетики вследствие формирования особого гормонального фона, особенностями гемодинамики и наличием плацентарных белков, регулирующих содержание лекарственных веществ в крови плода [6]. После завершения основных этапов органогенеза во II и III триместре риск развития пороков у плода минимален, но некоторые органы и системы остаются уязвимыми к химиотерапии. К их числу может относиться иммунная система плода, подвергающаяся длительному воздействию иммунодепрессантов.
Вопрос о влиянии иммуносупрессивных лекарственных средств на иммунную систему плода и новорожденного изучен недостаточно [7, 8]. Ранее нами были проведены исследования состояния иммунной системы у новорожденных, подвергавшихся внутриутробно иммуносупрессивному воздействию лекарственных препаратов, принимаемых беременными матерями в связи с наличием трансплантированного органа, онкологического или аутоиммунного заболевания [9–11]. Показано, что новорожденные в основном имели удовлетворительное состояние здоровья в течение раннего неонатального периода и менее выраженные изменения в иммунном статусе, по сравнению с наблюдаемыми у их матерей. Представляет несомненный интерес проведение сравнительного анализа изменений в состоянии иммунной системы матери и развитии иммунной системы плода на фоне иммуносупрессивной терапии матери при различных патологиях.
Цель данного исследования – провести сравнительный анализ результатов исследования состояния иммунной системы новорожденных у женщин, принимавших иммуносупрессивную химиотерапию во время беременности.
Материалы и методы
В проспективное исследование были включены 106 детей, рожденных и находившихся под наблюдением в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России в период с 2013 по 2017 гг. Иммунологическое исследование проведено у новорожденных (n=82) и их матерей (n=82).
1-ю группу составили дети (n=18), родившиеся у матерей с раком молочной железы (РМЖ, n=10) или с лимфомами Ходжкина и неходжкинскими лимфомами (n=8); 2-ю группу – дети (n=16), родившиеся у матерей с трансплантированным внутренним органом (у 14 – почка, у 2 – печень); 3-ю группу – дети (n=34), родившиеся у матерей с системной красной волчанкой (СКВ), 4-ю группу (контрольную) – дети (n=20), родившиеся у здоровых женщин с физиологическим течением беременности в отсутствие иммунодепрессантов.
Для оценки иммунного статуса матери и ребенка проводился забор периферической венозной крови у женщин перед родоразрешением и крови из вены пуповины.
Фенотипирование лимфоцитов периферической крови осуществляли методом проточной цитометрии на приборе FACSCanto II (Becton Dickinson, США) с использованием моноклональных антител к поверхностным маркерам CD3, CD16, CD95, меченных FITC, к CD4, CD8, CD19, CD56, HLA-DR, меченных PE (BD Biosciences, США). Для оценки позитивноокрашенных субпопуляций использовали соответствующие изотипические IgG. Лейкоцитарный гейт, позволяющий исключить из анализа другие клетки крови, выявляли с помощью моноклональных антител к CD45, меченных PerCP. Данные анализировали, используя программу FACSDiva (Becton Dickinson, США). Абсолютное содержание лимфоцитов исследуемых субпопуляций рассчитывали, исходя из результатов клинического анализа крови. Содержание иммуноглобулинов классов М, А и G в сыворотке крови определяли турбидиметрическим методом c использованием коммерческих наборов (Human, Германия).
Статистическую обработку данных проводили общепринятыми методами с использованием пакетов статистического анализа для Microsoft Office Excel 2010 и MedCalc12 для Windows 7. Соответствие расчетных выборок показателей нормальному распределению оценивали с помощью критерия Шапиро–Уилка. Результаты были представлены как среднее значение и стандартное отклонение M (SD) для данных с нормальным распределением. Для оценки различий в выборках с нормальным распределением использовали t-критерий Стьюдента, а в выборках, где распределение данных отличалось от нормального, применяли U-критерий Манна–Уитни. В этом случае результаты были представлены в виде медианы (Me) и квартилей Q1 и Q3 в формате Me (Q1;Q3). Сравнение между группами проводилось с помощью критерия Краскела–Уоллиса. Категориальные переменные представлены в виде частот (%). Различия между категориальными переменными анализировались с помощью χ2-теста.
Результаты и обсуждение
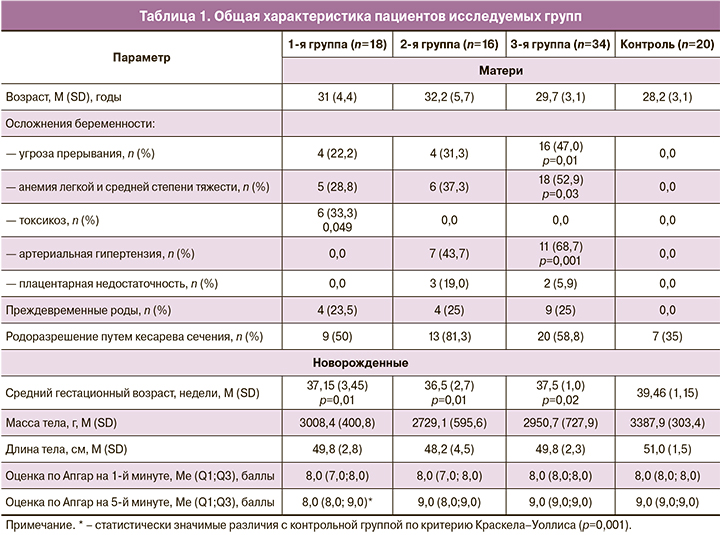
Включенные в исследование женщины были сопоставимы по возрасту (табл. 1).
Женщины с РМЖ во время беременности получали полихимиотерапию по схемам: АС (доксорубицин и циклофосфамид) и EC (эпирубицин и доксорубицин). Беременные с лимфомами принимали препараты по схемам: BEACOPP (блеомицин, этопозид, доксорубицин, винкристин, прокарбазин, преднизолон) и ABVD (доксорубицин, блеомицин, винбластин, дакарбазин). Женщины 2-й группы, с трансплантированным органом, во время беременности получали двух- или трехкомпонентную терапию: преднизолон, циклоспорин, азатиоприн, такролимус.
У женщин 3-й группы, со средней длительностью течения СКВ 9,4 (4,3) года, активность заболевания была у 29 (85,3%) пациенток – I степени, у 4 (11,8%) – II степени, у 1 (2,9%) – III степени. Во время беременности они находились на комбинированной двухкомпонентной терапии (глюкокортикостероиды и плаквенил), трехкомпонентной (глюкокортикостероиды, плаквенил и азатиоприн) или получали глюкокортикостероиды без применения цитостатиков.
В табл. 1 представлены наиболее часто встречавшиеся осложнения течения беременности: у женщин с онкологическими заболеваниями – угроза прерывания, анемия легкой и средней степени тяжести, токсикоз; у женщин с трансплантированным органом – угроза прерывания беременности и анемия, а также артериальная гипертензия; у женщин с СКВ, кроме угрозы прерывания беременности и анемии, наблюдалась активация внутрисосудистого свертывания крови и плацентарная недостаточность.
Родоразрешение у женщин с онкологическим заболеванием в 50% случаев проведено путем операции кесарева сечения (КС). Одним из ведущих показаний к оперативному родоразрешению являлась необходимость как можно раньше провести более агрессивную терапию онкологического заболевания у матери. Во 2-й группе родоразрешение оперативно выполнено у 13 матерей, естественным путем оно произошло только в 3 случаях. Беременность у женщин с СКВ также заканчивалась более чем в половине случаев КС. В группе контроля у ⅓ женщин физиологическое течение беременности завершилось КС в связи с наличием рубца на матке после предыдущего оперативного родоразрешения, у остальных – самопроизвольными родами.
Новорожденные у матерей с онкологическими заболеваниями имели явную тенденцию к снижению средних массо-ростовых показателей по сравнению с контрольной группой. Различия с контрольной группой в среднем гестационном возрасте и оценке по Апгар на 5-й минуте являются статистически значимыми. В этой группе недоношенными родились 4 (23,5%) детей, из них на сроке беременности менее 32 недель – 1 (6,5% от общего числа детей). В структуре заболеваемости новорожденных от матерей с РМЖ преобладали респираторные нарушения, что было связано с преждевременным родоразрешением: транзиторное тахипноэ, асфиксия легкой степени, рождение маловесным к сроку гестации. В группе новорожденных у матерей с гемобластозами чаще выявлялось апноэ недоношенных, внутрижелудочковое кровоизлияние 1 степени, стойкое фетальное кровообращение и рождение детей маловесными к сроку гестации. Основная патология новорожденных у матерей с РМЖ как с лечением иммунодепрессантами во время беременности, так и без него связана с досрочным родоразрешением, морфофункциональной незрелостью, недоношенностью, а не с противоопухолевой терапией [12].
Новорожденные у матерей с трансплантированным органом также имели тенденцию к снижению средних показателей массы и веса при рождении и статистически значимое различие с контрольной группой в гестационном возрасте. Недоношенными родились 4 (25%) детей, на сроке беременности менее 32 недель – 1 (6,25%). В структуре заболеваемости новорожденных у матерей с трансплантированными органами были отмечены следующие особенности: выявлена киста сосудистого сплетения у 3 (18,75%) новорожденных, на 3-и сутки жизни выявлено стойкое фетальное кровообращение у 4 (25,0%) новорожденных, врожденная пневмония – у 1 (8,12%), неонатальная желтуха – у 1 (8,12%), транзиторное тахипноэ – у 1 (8,12%) ребенка.
Средний срок гестации на момент родоразрешения детей 3-й группы был значимо ниже, чем в контрольной группе; по массо-ростовым показателям и оценке по Апгар на 1-й и 5-й минутах различий не выявлено. Недоношенными родились 9 (25%) детей, на сроке беременности менее 32 недель – 1 (3%) ребенок.
Сравнительный анализ результатов у новорожденных в исследуемых группах и у детей из контрольной группы показал, что более низкие средние значения ряда параметров у новорожденных исследуемых групп, по сравнению с детьми из контрольной группы, можно объяснить меньшим средним гестационным возрастом и наличием в этих группах недоношенных детей.
У беременных с онкологическими заболеваниями и у беременных с СКВ снижено количество лейкоцитов по сравнению с содержанием этих клеток у женщин в группе контроля, чем объясняется снижение абсолютного содержания лимфоцитов при отсутствии различий в процентном отношении (табл. 2).
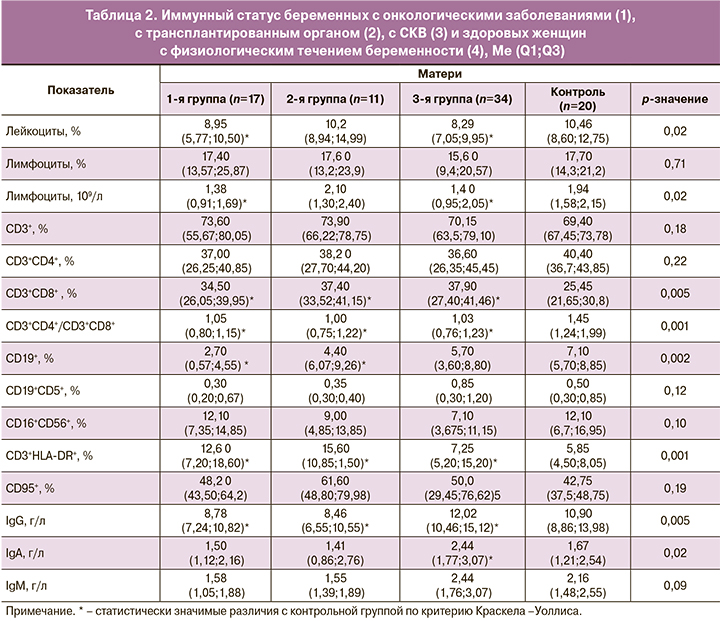
Во всех трех исследуемых группах беременных обнаружено снижение индекса соотношения CD3+CD4+- и CD3+CD8+-Т-лимфоцитов, обусловленное увеличением доли CD3+CD8+-Т-клеток. Кроме того, отмечено увеличение процентного содержания активированных Т-лимфоцитов (CD3+HLA-DR+) в периферической крови беременных исследуемых групп. В двух группах беременных, с онкологическими заболеваниями и с трансплантированными органами, значимо уменьшена доля β2-лимфоцитов (CD19+), наблюдается также снижение концентрации IgG в сравнении с контр ольной группой. Отмечено увеличение уровня IgG и IgA в группе беременных с СКВ.
Выявленные изменения в соотношениях иммунокомпетентных клеток не имеют однозначного объяснения. Нельзя исключить, что они могут зависеть не только от влияния иммунодепрессантов. Кроме различий в природе воздействия, схемах лечения и дозах препаратов, на состояние иммунной системы могут влиять многие факторы, в том числе характер и активность заболевания. Однако большие различия в этиологии и патогенезе заболеваний у беременных и однонаправленность выявленных изменений могут свидетельствовать о возможности отнесения этого дисбаланса к иммуносупрессивному влиянию принимаемых химиопрепаратов.
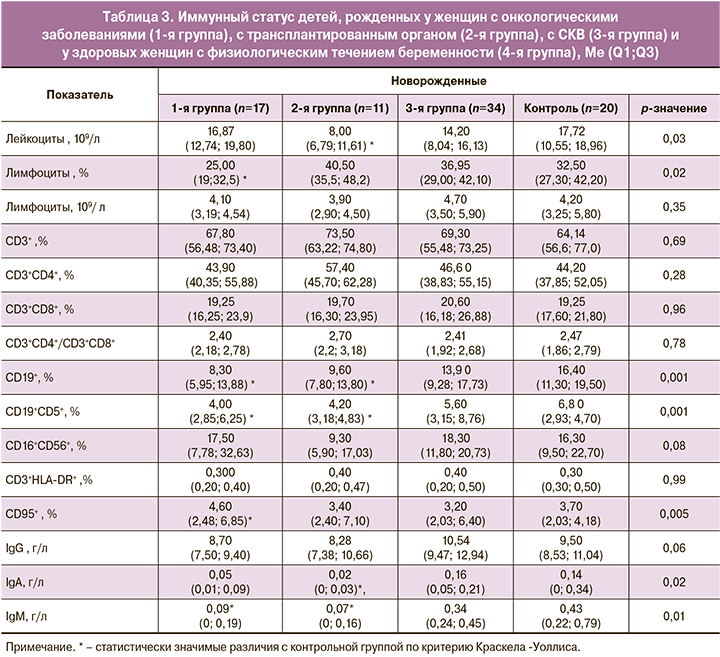
В группе детей от матерей с трансплантированным органом отмечено снижение средних показателей общего содержания лейкоцитов; у детей от матерей с онкологическими заболеваниями – снижение относительного количества лимфоцитов. Однако по абсолютному содержанию все три группы не отличались от контрольной (табл. 3). Данные других авторов неоднозначны. В одной работе не обнаружены существенные различия в количестве лейкоцитов, уровне гранулоцитов и лимфоцитов между группами новорожденных, матери которых получали иммуносупрессивную терапию во время беременности [13]. Однако, по данным Ono и соавт., у детей от матерей с трансплантированной почкой при рождении определялось меньше тромбоцитов, лейкоцитов, нейтрофилов и эозинофилов, чем у детей из контрольной группы [14].
Значимые изменения в содержании ряда субпопуляций Т-лимфоцитов в крови матерей, получавших иммуносупрессивную терапию во время беременности, не сопровождались подобными изменениями в пуповинной крови их новорожденных. Следует отметить, что соотношение CD3+CD4+- и CD3+CD8+-Т-лимфоцитов в пуповинной крови новорожденных было значимо выше, чем в периферической крови их матерей (рисунок, А, Б), что обусловлено более высокой долей CD3+CD4+- и низкой – CD3+CD8+-Т-лимфоцитов у новорожденных, чем у матерей.
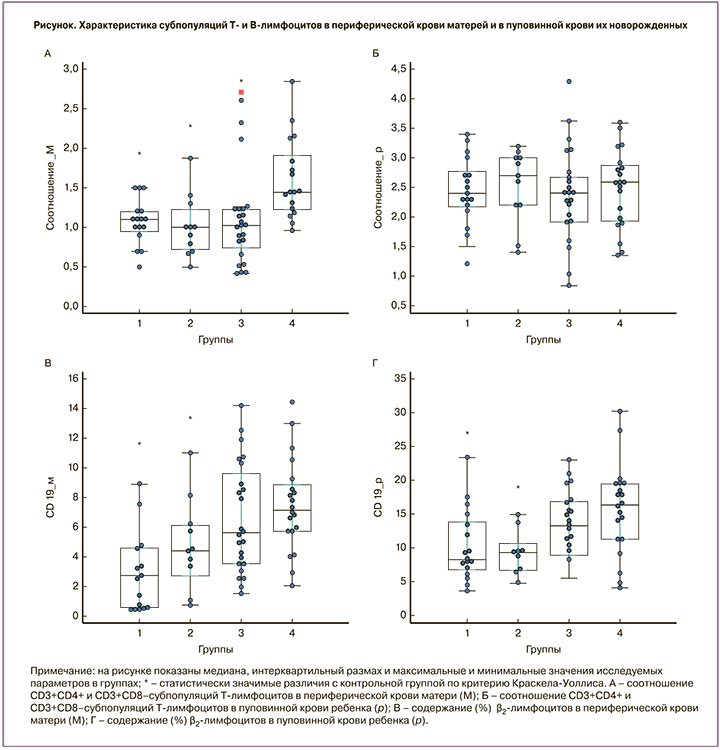
Обращает на себя внимание значительное снижение процентного содержания В-лимфоцитов (CD19+) в пуповинной крови новорожденных у матерей с онкологическими заболеваниями и новорожденных у матерей с трансплантированным органом, а также тенденция к снижению доли этих клеток у детей, рожденных женщинами с СКВ (рисунок, В, Г).
По содержанию иммуноглобулинов класса G в пуповинной крови новорожденных основные группы не отличались от контрольной. Статистически значимые различия выявлены в уровнях IgМ и IgА в пуповинной крови детей, рожденных женщинами с онкологическим заболеванием, и IgА у детей от матерей с трансплантированным органом. Более низкие уровни иммуноглобулинов ассоциируются со сниженным содержанием В-лимфоцитов. Однако следует отметить наличие малых выборок данных в этих группах и очень низкие концентрации IgМ и IgА в пуповинной крови новорожденных всех групп.
Таким образом, в пуповинной крови новорожденных исследуемых групп, у которых нельзя исключить влияния иммунодепрессантов на внутриутробное развитие, не обнаружено значимых изменений в содержании и соотношении субпопуляций Т-лимфоцитов, подобных наблюдаемым у их матерей. Это позволяет сделать вывод об отсутствии значительного влияния на становление иммунной системы плода иммуносупрессивной терапии матери во время беременности. Другая закономерность прослеживается в отношении β-лимфоцитов плода. В пуповинной крови новорожденных от матерей с онкологическим заболеванием или с трансплантированным органом выявлено значимое снижение содержания В-лимфоцитов. В группе матерей с СКВ и их новорожденных отмечалась тенденция к снижению содержания В-лимфоцитов. Наши данные согласуются с результатами исследований, в которых также показано значимое снижение количества В-клеток или уровня иммуноглобулинов в пуповинной крови детей у матерей с иммуносупрессивной терапией [14–16]. Предполагается, что снижение содержания В-клеток у новорожденных может изменить иммунный ответ на вакцину, и это следует учитывать при определении сроков вакцинации. Ранее предполагалось, что иммунные изменения, наблюдающиеся у новорожденных от матерей с иммуносупрессивной терапией, могут препятствовать нормальному ответу детей на вакцинирование. Опубликованы данные, подтверждающие, что младенцы, рожденные у этих матерей, имеют адекватный серологический ответ на вакцину без увеличения процента неблагоприятных результатов [17]. При этом высказывается мнение, что дети от матерей, получавших иммуносупрессивную терапию во время беременности, должны как можно скорее быть иммунизированы против болезней, предотвращаемых с помощью вакцин, поскольку они бывают в постоянном контакте с матерями, которые, находясь в иммунодефицитном состоянии, имеют повышенный риск инфекционных заболеваний.
В нашей работе обнаружены изменения в содержании и соотношении иммунокомпетентных клеток у беременных женщин на фоне иммуносупрессивной терапии, которые в большинстве случаев не носят ярко выраженных признаков угнетения иммунной системы. Существенных изменений в иммунном статусе новорожденных у этих матерей, по сравнению с новорожденными контрольной группы, не было обнаружено, что может свидетельствовать о минимальном воздействии на эмбрион и плод применяемой лекарственной терапии, необходимой для подавления активности заболевания и обеспечения успешного протекания беременности.
Заключение
Дети, рожденные женщинами, беременность которых проходила на фоне иммуносупрессивной терапии, чаще имели более низкие массо-ростовые показатели, более низкий гестационный возраст. Повышенная частота осложнений раннего неонатального периода, по-видимому, связана с меньшим гестационным возрастом, а не с влиянием химиотерапии, получаемой матерью.
Для матерей с различными видами заболеваний, получавшими иммуносупрессивную терапию, характерны признаки дисбаланса в клеточном звене иммунитета, проявляющиеся снижением соотношения CD3+CD4+- и CD3+CD8+-субпопуляций Т-лимфоцитов и количества В-лимфоцитов, увеличением содержания активированных Т-лимфоцитов.
У новорожденных, внутриутробное развитие которых происходит на фоне иммуносупрессивной терапии матери, наблюдаются менее выраженные различия с показателями контрольной группы, чем у их матерей. В пуповинной крови новорожденных выявлено снижение содержания В-лимфоцитов, но не обнаружено значимых изменений в содержании и соотношении субпопуляций Т-лимфоцитов. Это позволяет сделать заключение об отсутствии значительного влияния иммуносупрессивной терапии матери во время беременности на становление Т-клеточного звена у плода, однако в определенной степени эта терапия затрагивает развитие Вклеточного звена иммунитета.
Существенные различия в соотношениях Т-лимфоцитов разных фенотипов обнаруживаются между показателями периферической крови матерей и пуповинной крови их новорожденных. Соотношение CD4+- и CD8+-Т-лимфоцитов у новорожденных во всех группах было значимо выше, чем у матерей, доля активированных Т-лимфоцитов (CD3+HLA-DR+) – ниже.
При тщательном выборе препаратов и их дозировки, междисциплинарном характере лечения, целью которого является максимальная польза для матери без нанесения вреда ребенку, достигается успешный исход беременности при отсутствии выраженных нарушений в становлении и развитии клеточных основ адаптивного иммунитета у плода.



