В структуре гинекологической патологии значительная роль принадлежит гормонально-ассоциированным заболеваниям, среди которых в репродуктивном возрасте доминирует синдром поликистозных яичников (СПКЯ). Его частота по разным диагностическим критериям составляет 15–20% [1, 2]. СПКЯ характеризуется не только гиперандрогенией (ГА) и гиперпродукцией антимюллерова гормона (АМГ), которые ассоциированы с олиго-аменореей и бесплодием, но и целым рядом метаболических нарушений, являющихся факторами риска развития сахарного диабета (СД) 2 типа и сердечно-сосудистых заболеваний (ССЗ) [3, 4].
Следует отметить, что этиологические факторы и патогенетические механизмы формирования СПКЯ до конца не изучены и продолжают оставаться предметом научных исследований и дискуссий. Согласно современной точке зрения, наряду с генетической предрасположенностью в развитии СПКЯ важная роль принадлежит эпигенетическим нарушениям, к числу которых относят ожирение, инсулинорезистентность (ИР) и компенсаторную гиперинсулинемию (ГИ) [5]. ИР рассматривают как патологическое состояние, связанное с нарушениями способности инсулина стимулировать захват глюкозы клетками-мишенями, что повышает ее уровень в сыворотке крови. В ответ на это возникает компенсаторная ГИ, ассоциированная с ГА, возникающая как за счет центральных механизмов, синергичных с действием лютеинизирующего гормона (ЛГ), так и путем повышения экспрессии гена СYР-17 и синтеза андрогенов в тека-клетках яичников. Повышенный уровень инсулина сопряжен также со снижением продукции глобулина, связывающего половые стероиды (ПССГ), и увеличением активности 5α-редуктазы, в результате чего повышается биологическая активность андрогенов.
Полагают, что одними из ключевых нарушений действия инсулина, способствующих развитию ИР у больных с СПКЯ, являются пострецепторный дефект сигнальной трансдукции (дефект фосфатидилинозитола) и нарушение продукции GLUT-4 – мембранного транспортера глюкозы. Учитывая роль ИР в генезе СПКЯ, в течение многих лет для коррекции метаболических и гормональных нарушений применяют инсулиносенситайзеры, из которых наиболее изученным считается метформин (МФ) [6, 7]. Однако, несмотря на достаточно высокую эффективность, применение МФ может быть связано с нежелательными побочными эффектами (метеоризмом, диареей и тошнотой) [8, 9], а также с резистентностью к терапии.
Данные о важной роли дефекта инозитолфосфогликана (IPG) в нарушении передачи сигналов инсулина открыли новые перспективы лечения СПКЯ путем использования мио-инозитола (МИ) [10], дефицит которого характерен для больных с СПКЯ. Увеличивая продукцию и активность фосфоинозитол-3-киназы, МИ способствует повышению чувствительности тканей к инсулину. МИ опосредует не только сигналы инсулина, но и фолликулостимулирующего и тиреотропного гормонов (ФСГ и ТТГ), повышая чувствительность тканей к их действию. МИ также оптимизирует энергопотребление ооцитов за счет снижения ИР и увеличения потребления глюкозы, регулирует высвобождение внутриклеточного кальция из митохондрий, повышая мейотическую активность и созревание ооцитов. В связи с этим концентрация МИ в фолликулярной жидкости рассматривается как показатель качества ооцитов.
Имеется достаточно большое количество публикаций по применению МИ у больных с СПКЯ, однако в международные клинические рекомендации 2019 г. он был включен в качестве эмпирической терапии [11]. Это указывает на необходимость дальнейшего изучения эффективности и безопасности МИ для получения большей доказательной базы о целесообразности его применения при СПКЯ.
Целью настоящего исследования явилась оценка влияния МИ на эндокринно-метаболические параметры и композиционный состав тела пациенток с СПКЯ.
Материалы и методы
Исследование, одобренное этическим комитетом, проводилось на базе отделения гинекологической эндокринологии ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова» Минздрава России. Критериями включения явились: возраст женщин от 18 до 35 лет, наличие СПКЯ (Роттердамские критерии, 2003 г.) [12], отсутствие сопутствующей эндокринной и некомпенсированной экстрагенитальной патологии, отсутствие приема гормональной терапии и терапии инсулиносенситайзерами в течение 3 и более месяцев до вступления в исследование.
В исследование включены 140 женщин с СПКЯ, средний возраст составил 26,4 (4,6) года, средний индекс массы тела (ИМТ) – 23,2 (4,3) кг/м2. Всем пациенткам назначали комбинацию 1 г МИ и 100 мкг фолиевой кислоты (ФК) («Фертина», Orion Pharma, Финляндия) по 4 саше в сутки. Все участницы исследования были проинформированы о возможности проведения альтернативной терапии и перед проведением исследования подписали информированное согласие. К настоящему времени 3-месячный прием закончили 75 (53,6%) женщин, 6-месячный – 57 (40,7%). Результаты их клинико-лабораторного обследования были проанализированы и составили основу данной публикации.
Нарушения менструального цикла отмечены у всех больных: у 71 (94,7%) характеризовались олигоменореей (первичной – 68%, вторичной – 26,7%), у 4 (5,3%) – аменореей (первичной – 1,3%, вторичной – 4%). Клиническая ГА в виде гирсутизма выявлена у 48% (36/75), в виде акне – у 37,3% (28/75) пациенток. Первичное бесплодие выявлено у 7 (25%) из 28 женщин, заинтересованных в беременности. Нормальную массу тела имели 59 (78,7%) пациенток, избыточную – 12 (16%), ожирение 1 степени – 3 (4%), 2 степени – 1 (1,3%).
Исходно, через 3 и 6 месяцев наблюдения проводилось определение уровней ЛГ, ФСГ, общего и свободного тестостерона (Тобщ. и Тсв.), андростендиона (А), ПССГ, 17-ОН-прогестерона (17-ОП), лептина, пролактина, ТТГ в сыворотке крови иммунохемилюминесцентным методом (анализатор Immulite 2000, Siemens, США). Уровень АМГ в сыворотке крови определяли методом ELISA (тест-система AMHGenIIELISA, Beckman Coulter, США). Индекс свободных андрогенов (ИСА) рассчитывался по формуле: ИСА = общий тестостерон (нмоль/л)/ПССГ (нмоль/л) × 100. Всем пациенткам исходно и через 6 месяцев наблюдения проводили 2-часовой глюкозотолерантный тест (ГТТ) с 75 г глюкозы с определением уровней глюкозы и инсулина натощак, через 1 и 2 ч после нагрузки. До начала приема и через 6 месяцев проводили ультразвуковое исследование (УЗИ) органов малого таза на аппарате Toshiba SSA-240 (Япония) трансвагинальным датчиком с частотой 7,5 Мгц с определением объема яичников и подсчетом числа антральных фолликулов (ЧАФ) в объеме яичника. Контроль овуляции осуществлялся с помощью определения уровня прогестерона и/или УЗИ на 20–24-й день менструального цикла (д.м.ц.).
Исходно и через 6 месяцев наблюдения рассчитывали ИМТ по формуле: масса тела (кг)/рост2 (м2). Для оценки количества и характера распределения жировой ткани 51 пациентке проводилась двухэнергетическая рентгеновская абсорбциометрия (DXA) по программе Total Body Tissue Quantitation на аппарате Prodigy (Lunar, США). Для диагностики избыточного количества жировой ткани был использован наиболее информативный показатель – % total fat. Кроме этого, проанализированы такие параметры, как количество андроидного и гиноидного жиров (%), объем и масса внутренней (висцеральной) жировой ткани (ВЖТ) (см3, г).
Статистический анализ проводили с использованием программы SPSS (IBM Statistical Package for the Social Sciences, 21 версия), Microsoft Exсel 2007. С помощью теста Колмогорова–Смирнова установлено нормальное распределение данных. Количественные показатели представлены как среднее арифметическое и стандартное отклонение М (SD). Для сравнения групп по множеству качественных бинарных (дихотомических) признаков применяли критерий Мак-Немара. Для сравнения групп по непрерывным количественным признакам применялся критерий Вилкоксона. Cтатистически значимыми считались результаты при достижении уровня p<0,05.
Результаты
Результаты исследования показали, что исходный уровень АМГ варьировал от 6,6 до 48,4 нг/мл и составил в среднем 14,8 (7,2) нг/мл. Его значения у всех больных были выше пороговых, определенных согласно возрасту [13]. Повышение уровня ЛГ (>10 мМЕ/мл) отмечено у 33,3% (25/75) пациенток, уровни ФСГ, пролактина и ТТГ не превышали референсных значений. Согласно комплексной оценке андрогенного профиля, повышение уровня Тобщ. дало возможность диагностировать биохимическую ГА у 38,7% (29/75) больных, повышение Тсв. – у 32% (24/75), А – у 44% (33/75). Содержание ПССГ в сыворотке крови варьировало от 26,6 до 163,3 нмоль/л, его снижение (<50 нмоль/мл) наблюдалось у 58,7% (44/75) женщин.
Прием комбинации МИ и ФК оказал существенное влияние на гормональные и метаболические показатели больных с СПКЯ (таблица).
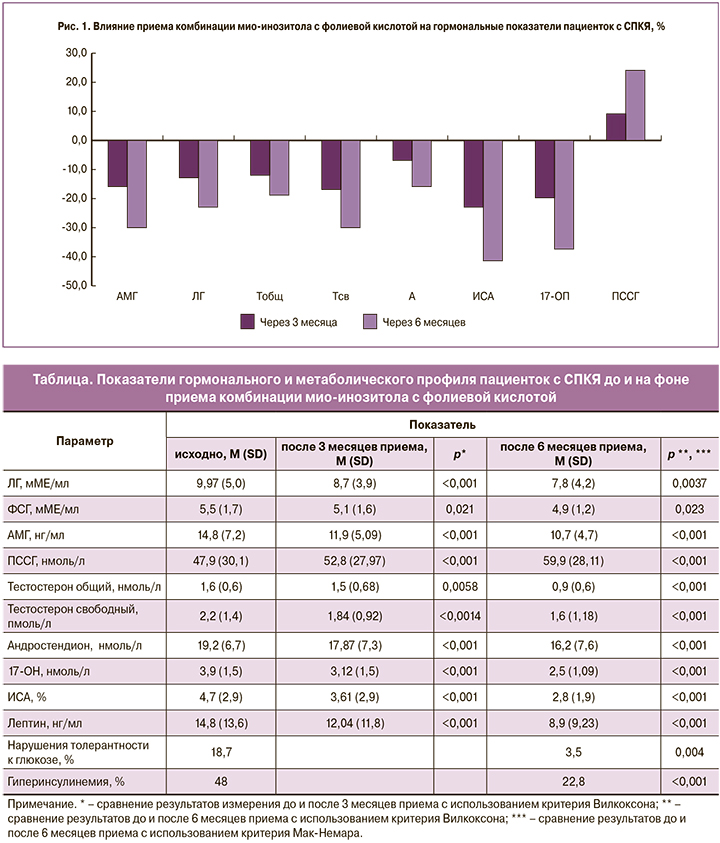
Динамика основных гормональных параметров на фоне приема комбинации МИ и ФК представлена на рис. 1. Снижение среднего уровня ЛГ достигло 22% к 6-му месяцу приема. Несмотря на значимое снижение среднего уровня АМГ (27,7%), он по-прежнему превышал пороговое значение у 84,2% (48/57) женщин в конце 6-месячного курса приема. Коррекция биохимической ГА заключалась в прогрессирующем снижении уровней всех исследуемых андрогенов (р<0,001). После 6 месяцев приема комбинации МИ и ФК уровень Тобщ. не превышал нормативных значений у 75,4% (43/57), Тсв. – у 85,9% (49/57), А – у 84,2% (48/57). Воздействие МИ на ПССГ проявилось повышением его уровня к 6-му месяцу приема на 25%.
Коррекция гормональных показателей сопровождалась значительным уменьшением средних объемов яичников: правого – с 13,99 (0,56) см3 до 11,72 (0,4) см3 (р<0,001) и левого – с 12,98 (0,38) до 11,82 (0,47) см3 (р<0,023); снижением ЧАФ – с 39,93 (1,51) до 28,93 (1,1) в правом яичнике, с 37,21 (1,39) до 29,08 (1,1) – в левом) (р<0,001). У 71,9% (41/57) больных пороговые значения объемов яичников и ЧАФ превышали нормативные значения, установленные в качестве диагностических для СПКЯ.
Частота ГИ, выявленная в ходе ГТТ, исходно составила 48% (36/75), а нарушений толерантности к глюкозе (НТГ) – 18,7% (14/75). К концу 6-го месяца приема комбинации МИ и ФК частота ГИ снизилась до 22,8% (13/57) (р=0,004), а НТГ – до 3,5% (2/57) (р<0,001) соответственно.
Функциональная оценка жировой ткани проводилась по уровню лептина в сыворотке крови, который составил в среднем 14,8 (13,6) нг/мл. При этом превышение референсных значений выявлено у 50,7% (38/75). После 3 месяцев приема отмечено снижение частоты гиперлептинемии (ГЛ) до 40% (30/75) (р=0,034), после 6 месяцев – до 22% (13/57) (р<0,001).
Масса тела пациенток после 3 месяцев наблюдения снизилась в среднем на 2,2 (0,9) кг, после 6 – на 4,8 (1,3) кг, средний показатель ИМТ уменьшился с 23,1 (4,3) до 21,1 (3,2) кг/м2 (р<0,001). К концу 6-месячного приема количество женщин с нормальным ИМТ увеличилось с 78,7 до 89,5% (р≤0,001). Закономерно уменьшалась частота ИМТ и ожирения 1-й степени. К концу курса приема случаев ожирения 2-й степени не наблюдалось.
На фоне приема комбинации МИ и ФК были выявлены существенные изменения композиционного состава тела. Исходно избыточное количество жировой ткани (total fat >30%) выявлено у 64,7% (33/51) женщин, имеющих нормальный ИМТ. Несмотря на то, что средний показатель total fat до и после курса оставался больше нормы (>30%) (рис. 2, а), содержание общей жировой ткани за 6 месяцев уменьшилось на 11,5%, андроидной и гиноидной составляющих – на 16 и 10% соответственно (р≤0,001) (рис. 2, а). В целом после 6 месяцев приема МИ частота «скрытого» ожирения снизилась с 64,7 до 39% (р≤0,001). Анализ содержания ВЖТ продемонстрировал снижение ее объема на 33,2% и массы – на 38,4% после 6 месяцев приема (р<0,001) (рис. 2, б).

Клиническая эффективность оценивалась по регуляции ритма менструации. Как видно на рис. 3, применение комбинации МИ и ФК без сопутствующей гормонотерапии способствовало восстановлению регулярного ритма менструаций у 21,3% (16/75) женщин после 3 месяцев приема и у 38,6% (22/57) – после 6 месяцев. Следует отметить, что у 2 пациенток с аменореей II наблюдалось отсутствие эффекта, тогда как у одной пациентки с аменореей I отмечено появление регулярных менструаций.
Оценка овуляции, проведенная у 28 женщин, заинтересованных в беременности, путем мониторинга уровня прогестерона и УЗИ показала ее наличие в 78,6% (22/28) случаев, беременность наступила у 6 (21,4%) из них, при этом в каждом втором случае – в первые 3 месяца наблюдения.
Нежелательные эффекты проявлялись в виде эпизодической головной боли у 4 (5,3%) и метеоризма незначительной степени выраженности у 11 (14,7%) пациенток и не послужили поводом для отказа от дальнейшего приема комбинации МИ и ФК.
Обсуждение
СПКЯ относят к числу наиболее частых причин нарушений менструального цикла (МЦ), которые традиционно корригируют путем назначения комбинированных оральных контрацептивов (КОК). Однако приверженность к длительной терапии пациенток молодого возраста, не нуждающихся в контрацепции, достаточно низкая. Кроме того, СПКЯ в настоящее время рассматривают как метаболический репродуктивный синдром, при котором частота дислипидемий достигает 70%, ГИ – 60%, НТГ – 30% [14]. Результаты проведенного исследования свидетельствуют об относительно невысокой частоте ГИ (48%) и НТГ (17,7%) у пациенток с СПКЯ. Это, возможно, обусловлено тем, что 78,7% женщин не имели избыточной массы тела или ожирения, провоцирующих или усугубляющих метаболические нарушения. Вместе с тем оценка композиционного состава тела, проведенная методом ДХА, позволила выявить избыток жировой ткани у ⅔ больных с нормальными показателями ИМТ. Это свидетельствует как о недостаточной информативности ИМТ, так и о наличии «скрытого» ожирения. Результаты ранее проведенного нами исследования показали, что «скрытое» ожирение характерно для подавляющего числа больных СПКЯ и ассоциируется с более неблагоприятным метаболическим профилем, включая нарушения углеводного обмена и липидного спектра крови [15]. Важно отметить также значительное повышение показателей содержания и объема ВЖТ, которая считается метаболически более активной и наиболее неблагоприятной. Экспериментальные данные указывают на возможную роль дефекта инозитолфосфогликанов, который наблюдается при СПКЯ, в генезе висцерального ожирения за счет активации ацетил-СоА-карбоксилазы и подавления аденилатциклазы, приводящих к усилению липогенеза в адипоцитах ВЖТ [16]. Многочисленными исследованиями доказана ассоциация висцерального ожирения с формированием метаболического синдрома, что обусловлено нарушением обменных процессов в ВЖТ, ее патологической гормональной активностью, выраженной васкуляризацией, повышенной экспрессией провоспалительных медиаторов, а также более высокой, в сравнении с подкожной жировой тканью, плотностью липолитических бета-адренорецепторов, глюкокортикоидных и андрогенных рецепторов [17–19]. Повышенная функциональная активность жировой ткани при СПКЯ также подтверждена данными настоящего исследования о высоких уровнях лептина у каждой второй больной. Причинно-следственная связь между ГЛ и ГИ точно не установлена, однако вполне очевидна. Существуют данные как о влиянии ГЛ на формирование ИР, так и о повышении продукции лептина в ответ на увеличение уровня инсулина [20].
В качестве альтернативного и патогенетически обоснованного варианта лечения метаболических нарушений и овуляторной дисфункции при СПКЯ с успехом применяют инсулиносенситайзеры. В последние годы в клинической практике для коррекции эндокринно-метаболических нарушений и улучшения качества ооцитов все шире используют МИ. Экспериментальными работами и рядом клинических исследований доказано, что МИ, улучшая передачу инсулинового сигнала, повышает чувствительность тканей к инсулину, тем самым снижает ИР, являющуюся одним из основных факторов, участвующих в формировании СПКЯ. При этом добавление ФК к МИ не только обеспечивает дотацию этого нутриента для профилактики пороков развития на прегравидарном этапе, но и потенцирует эффекты инозитола. Согласно полученным результатам, 6-месячный прием комбинации МИ и ФК способствовал снижению частоты ГИ на 52,5%, НТГ – на 81,3%. Таким образом, к концу периода наблюдения частота ГИ составила 22,8%, НТГ – 3,5%. Можно полагать, что более длительный прием может сопровождаться дальнейшей нормализацией показателей углеводного обмена.
Ранее проведенные исследования отражают участие МИ в расщеплении жиров, регуляции липидного обмена, снижении ИМТ [21]. Полученные данные также свидетельствуют о снижении массы тела после 6 месяцев приема в среднем на 4,8 (1,3) кг, что примерно в 2 раза ниже, чем на фоне терапии сибутрамином и орлистатом [22]. Это вполне закономерно, так как комбинация МИ с ФК не относится к числу средств, зарегистрированных для фармакотерапии ожирения. Наиболее интересные данные, с нашей точки зрения, получены в отношении влияния комбинации МИ с ФК на композиционный состав тела больных без «истинного» ожирения. После 6 месяцев приема частота «скрытого» ожирения, диагностированного на основании увеличенного процентного содержания жировой ткани >30%, снизилась почти в 2 раза (с 64,7 до 39%). Важно подчеркнуть, что снижение общей жировой массы составило только 11,5%, тогда как ВЖТ – 38%. Преимущества доминирующего снижения висцерального жира очевидны, поскольку он рассматривается в качестве одного из ведущих триггеров формирования ИР и депо для синтеза и метаболизма половых стероидов. Количественное снижение жировой ткани сопровождалось закономерным снижением ее функциональной активности в виде подавления секреции лептина. Частота ГЛ после 6 месяцев приема комбинации МИ с ФК снизилась вдвое (с 50 до 22%). Можно полагать, что МИ способен повышать чувствительность тканей к инсулину за счет как повышения активности и продукции фосфоинозитол-3-киназы, так и снижения количества и функциональной активности жировой ткани.
Подобно ряду других исследований [23, 24], была отмечена коррекция андрогенного профиля, которая заключалась не только в уменьшении секреции Тобщ. на 18%, Тсв. на 29% и А на 15%, но и в подавлении биодоступности андрогенов за счет повышения синтеза ПССГ в среднем на 25%. Это может быть связано со снижением количества ВЖТ, уменьшением уровня инсулина – ключевых факторов, ингибирующих секрецию ПССГ. Прием МИ способствовал также существенному снижению уровня АМГ (в среднем на 25%), что может быть результатом ингибирующего действия МИ на активность клеток гранулезы, опосредованного снижением продукции провоспалительных факторов через АМФК-зависимые пути, как это наблюдается на фоне приема МФ [25].
Важными с практической точки зрения представляются данные о возможности восстановления регулярного ритма менструации на фоне применения МИ без гормональных препаратов. Регуляция МЦ через 6 месяцев была достигнута у каждой третьей пациентки, беременность наступила у каждой пятой из числа в ней заинтересованных. По данным метаанализа, комбинация МИ с ФК способствовала 6-кратному увеличению частоты восстановления менструаций и 3-кратному увеличению частоты наступления беременности [26]. Восстановление функции репродуктивной системы происходит за счет нормализации функциональной активности гипоталамо-гипофизарно-яичниковой системы, опосредованной не только коррекцией ИР, ГИ и ГА, но и снижением высоких уровней АМГ, о чем свидетельствуют полученные результаты. Не исключено также положительное влияние МИ на процесс созревания ооцитов и качество яйцеклеток за счет восполнения локального дефицита МИ, обусловленного, согласно ряду исследований, повышенной активностью NAD-зависимой эпимеразы в тека-клетках яичников у больных с СПКЯ [27, 28].
Заключение
Результаты проведенного исследования подтверждают высокую частоту метаболических нарушений у пациенток с СПКЯ, включая «скрытое» ожирение, и позволяют сделать заключение о достаточно высокой эффективности негормонального нутриентного комплекса «Фертина» в коррекции гормонально-метаболических параметров, композиционного состава тела с преимущественным снижением ВЖТ. Ее можно рассматривать в качестве эффективного альтернативного метода коррекции нарушений МЦ и овуляторной дисфункции. Для повышения эффективности и разработки дифференцированных подходов к терапии, наряду с увеличением ее длительности, представляется перспективным поиск возможных клинико-лабораторных и молекулярно-генетических предикторов ответа на комплексную терапию уже на этапе ее планирования.



