В настоящее время общепринятые методы обследования супружеских пар с бесплодием не позволяют установить его причину в 20–30% случаев, а при повторных эпизодах репродуктивных неудач данный показатель возрастает до 50% [1, 2]. В этой связи большой научно-практический интерес представляет изучение иммунологических причин репродуктивных потерь, играющих значимую роль в отсутствии наступления, а также в прерывании беременности в данной когорте пациентов.
Для оценки иммунологических отклонений при репродуктивных нарушениях используются различные методы исследования. Наиболее доступным материалом для проведения анализа является периферическая кровь, в которой определяются субпопуляционный состав лимфоцитов, уровень регуляторных Т-лимфоцитов (Тreg), аутоантител, цитокинов, количества и активности естественных клеток-киллеров периферической крови (pbNK-клеток) и другие показатели.
На основании оценки поверхностного рецепторного профиля pbNK-клеток могут определяться их субпопуляционная принадлежность и функциональная активность [3]. Основная субпопуляция pbNK-клеток, обладающая фенотипом CD56dimCD16bright (≈90% общего количества pbNK-клеток), описывается как цитотоксическая. Минорная субпопуляция pbNK-клеток с фенотипом CD56brightCD16dim (≈10% общего количества pbNK-клеток) обладает регуляторной функцией. Цитотоксическая активность субпопуляции CD56dimCD16bright pbNK-клеток обусловлена содержанием большого количества гранул с перфорином, гранзимами и другими цитолитическими веществами, быстрым контактом с клетками-мишенями [4]. CD56brightCD16dim pbNK-клетки экспрессируют хемокиновые и адгезионные рецепторы, способствующие их трансэндотелиальной миграции из кровотока в ткани, в том числе в органы репродуктивной системы – эндометрий и децидуальную оболочку [5]. Клетки «регуляторной» субпопуляции активно продуцируют цитокины, такие как интерферон-γ (IFN-γ), фактор некроза опухоли-α (TNF-α), гранулоцитарный колониестимулирующий фактор роста (G-CSF), интерлейкины-10 и -13 (IL-10, IL-13), влияют на функции иммунных клеток, способствуют формированию адаптивного иммунного ответа [6]. Хотя CD56bright pbNK-клетки обладают невысокой цитотоксичностью, этот эффект усиливается в условиях воспаления, после их активации [7].
Остается дискуссионной и недостаточно изученной роль NK-клеток при бесплодии и привычном невынашивании беременности (НБ) [8–10]. Согласно результатам метаанализа, количество pbNK-клеток при указанных состояниях выше, чем у здоровых женщин [11], однако в ряде работ обнаружено как снижение, так и отсутствие различий в их уровне [12, 13]. Некоторые авторы сообщают о прогностической значимости количества и активности pbNK-клеток для оценки исходов беременностей, наступивших как после экстракорпорального оплодотворения (ЭКО), так и при самостоятельном планировании, но данные остаются противоречивыми [14, 15].
Показано изменение экспрессии различных групп рецепторов pbNK-клеток при привычном НБ, самопроизвольных выкидышах, бесплодии [16, 17]. Одним из основных рецепторов, характеризующих активацию NK-клеток, является трансмембранный лектиноподобный рецептор NKG2D. Другим маркером, отражающим цитотоксическую активность pbNK-клеток, является экспрессия гликопротеина CD107а, появляющаяся на плазматической мембране при слиянии лизосомальной и цитоплазматической мембран клетки в процессе дегрануляции [18].
В последние годы особую значимость приобретает оценка не только количества, но и функциональной активности pbNK-клеток. Показаны вариативные изменения рецепторного профиля и цитотоксичности pbNK-клеток при репродуктивных потерях. Так, при привычном НБ показано изменение субпопуляционного состава в сторону преобладания цитотоксического фенотипа [14]. По данным ряда авторов, у пациенток с бесплодием экспрессия активирующих рецепторов на поверхности pbNK-клеток ниже, чем у здоровых женщин; в других исследованиях подобных различий не обнаружено [15, 16]. При этом комплексные данные о субпопуляционном составе лимфоцитов и pbNK-клеток, их функциональной активности у пациенток с бесплодием и неудачами ЭКО малочисленны.
Недостаточно данных относительно роли Treg при повторных неудачах имплантации в протоколах вспомогательных репродуктивных технологий (ВРТ). К одной из иммунорегуляторных функций Тreg относится регуляция фенотипа и активности эндометриальных NK-клеток [19, 20]. Снижение количества Treg ассоциировано с НБ и рядом акушерских осложнений, таких как преэклампсия и синдром задержки роста плода [21].
Целью настоящего исследования явилось изучение количества, субпопуляционного состава и фенотипических маркеров активации pbNK-клеток, а также субпопуляционного состава лимфоцитов периферической крови у пациенток с неэффективными протоколами ВРТ в анамнезе.
Материалы и методы
В основную группу исследования были включены 60 пациенток, имеющих в анамнезе неэффективные протоколы ВРТ, соответствующих следующим критериям включения: один неэффективный протокол ВРТ и более с переносом эмбрионов хорошего качества (≥3ВВ по классификации Gardner D.K. 1999 г.) в анамнезе, нормальный кариотип супругов. Пациентки основной группы были разделены на подгруппы с первичным (Бесплодие I, n=25) и вторичным бесплодием (Бесплодие II, n=35). Среди пациенток с вторичным бесплодием выделили подгруппы с НБ в анамнезе и без (НБ(+) и НБ (-)). 15 здоровых фертильных женщин составили группу контроля.
Критериями включения в группу контроля являлись: одни срочные роды и более в анамнезе, отсутствие репродуктивных потерь, регулярный менструальный цикл. Критериями исключения для всех групп были: возраст менее 20 или более 40 лет, индекс массы тела (ИМТ)≥30 кг/м2, аномалии развития половых органов, миома матки (тип 0–3, FIGO 2011 г., диаметр узла ≥3 см), наружный генитальный эндометриоз II–IV степени гиперплазия, полип эндометрия, «тонкий» эндометрий (М-эхо≤7 мм), сахарный диабет, инфекционные заболевания, прием антибактериальных, противовирусных препаратов, а также гормональной контрацепции менее чем за 3 месяца до исследования. Исследование одобрено локальным этическим комитетом ФГБНУ «НИИ АГиР им. Д.О. Отта» (протокол № 100 от 19.12.2019 г.). Получено информированное согласие пациенток на исследование, включающее согласие на обезличенный анализ полученных данных и их публикацию в общедоступных изданиях.
Образцы периферической крови пациенток были получены во II фазу менструального цикла (19–22-й день), натощак, в пробирки с антикоагулянтом Na2ЭДТА.
Определение субпопуляционного состава лимфоцитов периферической крови
Для определения субпопуляционного состава лимфоцитов периферической крови использовали коммерческий набор Multitest 6-Color TBNK (BD, США). Определяли процентное и абсолютное содержание Т-лимфоцитов (CD3+), В-лимфоцитов (CD3+CD19+), Т-хелперов (CD3+CD4+), цитотоксических Т-лимфоцитов (Т-киллеров, CD3+CD8+), pbNK-клеток (CD56+CD16+). Исследование было проведено методом проточной цитофлуориметрии (FacsCanto II, BD, США).
Определение экспрессии маркера активации CD107a pbNK-клетками
Мононуклеары периферической крови выделяли на градиенте плотности фиколла (ρ=1,077 г/мкл, Sigma, США) стандартным методом. Далее часть клеток инкубировали в культуральной среде RPMI-1640 (Sigma, США) с добавлением стандартного реагента для активации лейкоцитов, содержащего смесь форбол-миристат ацетата и иономицина (BD, США) в течение 3 ч при 37˚С с 5% содержанием СО2, вторую часть клеток инкубировали без добавления активатора. После инкубации клетки отмывали раствором Хэнкса («Биолот», Россия) и обрабатывали моноклональными антителами к CD16, CD56, CD3, CD45, CD107a (BD, США) в соответствии с рекомендациями производителя. Исследование было проведено методом проточной цитофлуориметрии (FacsCanto II, BD, США). Определяли следующие показатели: количество спонтанно и индуцированно активированных pbNK-клеток, количество CD16+CD107a+ и CD16-CD107a+ pbNK-клеток.
Определение субпопуляций pbNK-клеток и экспрессии ими рецептора NKG2D
Для детального разделения pbNK-клеток на отдельные субпопуляции была проведена оценка экспрессии поверхностных рецепторов CD56 и CD16 в полученных образцах крови. После выделения мононуклеаров периферической крови стандартным методом на градиенте плотности фиколла (ρ=1,077 г/мкл, Sigma, США) клетки отмывали раствором CellWash (BD, США) с помощью центрифугирования при 200g, 22˚C в течение 10 минут. Далее клетки обрабатывали реагентом, блокирующим Fc-рецепторы (MACS, Германия) для предотвращения неспецифического связывания антител в соответствии с указаниями производителя. Затем клетки обрабатывали моноклональными антителами к CD45, CD3, CD14, CD16, CD56, NKG2D в соответствии с рекомендациями производителя. В качестве контроля неспецифического связывания антител использовали изотипические антитела (BD, США). Среди CD45+CD3-CD14-CD56+CD16+ pbNK-клеток выделяли субпопуляции CD56dimCD16bright, CD56dimCD16dim, CD56brightCD16dim и оценивали экспрессию ими рецептора NKG2D. Исследование проводили методом проточной цитофлуориметрии (FacsCanto II, BD, США).
Оценка количества Treg в периферической крови
Количество Тreg (CD3+CD4+CD25+CD127low/-) в периферической крови определяли с помощью коммерческого набора Human Regulatory T Cell Cocktail (BD, США) в соответствии с указаниями производителя с использованием проточного цитофлуориметра FacsCanto II, BD, США.
Статистический анализ
Статистическую обработку результатов осуществляли при помощи программы Statistica 10 (StatSoft, Inc.). Данные были проверены на нормальность распределения с помощью критерия Шапиро–Уилка. Для парного сравнения исследованных показателей был применен непараметрический U-критерий Манна–Уитни. Для множественного сравнения использовались H-критерий Крускала–Уоллиса и поправка Бонферрони. В данном случае максимальное число сопоставляемых выборок равнялось 3, в связи с чем статистически значимым являлся критический уровень, рассчитанный по формуле m=n(n-1)/2, где n – количество выборок. Непрерывные переменные представлены как медианы и интерквартильный размах Me (Q1;Q3). Корреляционный анализ был выполнен с помощью оценки ранговой корреляции Спирмена (rs). Для анализа связи между переменными использовали линейную регрессию, проверка базовых предположений (анализ дисперсии и нормальности распределения остатков) выполнена в программах Statistica 10 и SPSS. Анализ нормальности распределения остатков выполнен с помощью оценки критерия Шапиро–Уилка стандартизованных остатков. Анализ выбросов выполнен с помощью оценки стандартизованных предсказанных значений, стандартизованных остатков и расстояния Кука. Значимость коэффициента детерминации проверена с помощью F-критерия. При сопоставлении показателей, измеренных в номинальной шкале, применяли показатель Хи-квадрат Пирсона (χ2). Значение р<0,05 было принято как статистически значимое.
Результаты
Пациентки исследуемых групп были сопоставимы по возрасту и индексу массы тела (ИМТ). Длительность бесплодия у женщин основной группы варьировалась от 1 до 13 лет (медиана 4,0 (2,5;6,0)), не различалась между подгруппами с первичным и вторичным бесплодием, но была меньше при наличии НБ в анамнезе по сравнению с ее отсутствием (p<0,05, табл. 1).
Количества проведенных протоколов ВРТ, а также переносов эмбрионов в протоколе ЭКО или в криопротоколе были сопоставимы между подгруппами исследуемых пациенток (табл. 1). При этом однократный перенос эмбрионов наблюдался у 21,7% (n=13) пациенток, двукратный – у 33,3% (n=20) и более трех попыток переноса эмбрионов встречалось в 45% (n=27) случаев. Количество беременностей в анамнезе было статистически значимо выше в группе контроля при сравнении с пациентками основной группы (р<0,05), а также при наличии НБ в анамнезе по сравнению с ее отсутствием (p<0,05).
Cреди пациенток основной группы частота встречаемости различных факторов бесплодия распределялась следующим образом: трубно-перитонеальный – 28,3% (n=17), ановуляция – 18,3% (n=11), мужской фактор – 13,3% (n=8), сочетанные формы бесплодия – 18,3% (n=11), бесплодие идиопатического генеза –15% (n=9) случаев, эндометриоз-ассоциированное бесплодие – 6,7% (n=4) пациенток. Структура бесплодия не различалась между подгруппами исследуемых пациенток.
При оценке структуры сопутствующих гинекологических заболеваний у пациенток основной группы была выявлена более высокая частота воспалительных заболеваний органов малого таза, наружного генитального эндометриоза и миомы матки, по сравнению с группой контроля (70, 15, 18% и 0, 0, 6,6%, соответственно; p<0,05). При сравнении подгрупп женщин с первичным и вторичным бесплодием, а также пациенток с вторичным бесплодием и НБ в анамнезе и отсутствием НБ, статистически значимых отличий установлено не было.
Частота перенесенных оперативных вмешательств на органах малого таза была статистически значимо ниже в группе контроля, по сравнению с пациентками основной группы и составила 20% и 75%, соответственно (p<0,05). В группе контроля оперативные вмешательства были представлены операцией кесарева сечения в анамнезе у троих пациенток. У пациенток основной группы частота лапаротомических операций на органах малого таза составила 13,3%, лапароскопических операций – 51,6%, гистероскопия была выполнена у 58,3% женщин. Между подгруппами пациенток с первичным и вторичным бесплодием, а также подгруппами с вторичным бесплодием и НБ в анамнезе в сравнении с отсутствием НБ, частота оперативных вмешательств не различалась. Выскабливание полости матки было выполнено в 2,7 раз чаще у пациенток с вторичным бесплодием, по сравнению с первичным (75 и 27% соответственно; p<0,01).Частота данной операции также была выше у пациенток с вторичным бесплодием и НБ в анамнезе, по сравнению с ее отсутствием (82 и 60% соответственно; p<0,05).
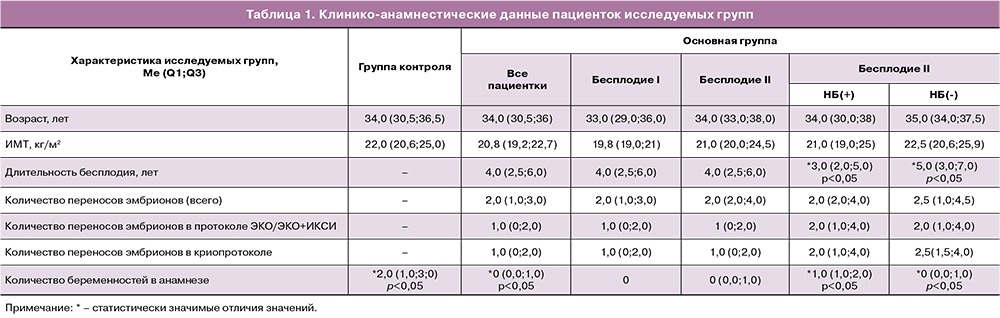
При оценке субпопуляционного состава лимфоцитов периферической крови, у пациенток основной группы по сравнению с группой контроля было снижено относительное количество B-лимфоцитов (CD19%) (9,2 (7,7;11,4) и 11,7 (10,2;14); p<0,05) (рис. 1А). Статистически значимых отличий в субпопуляционном составе pbNK-клеток и экспрессии ими рецептора NKG2D между вышеуказанными группами выявлено не было.
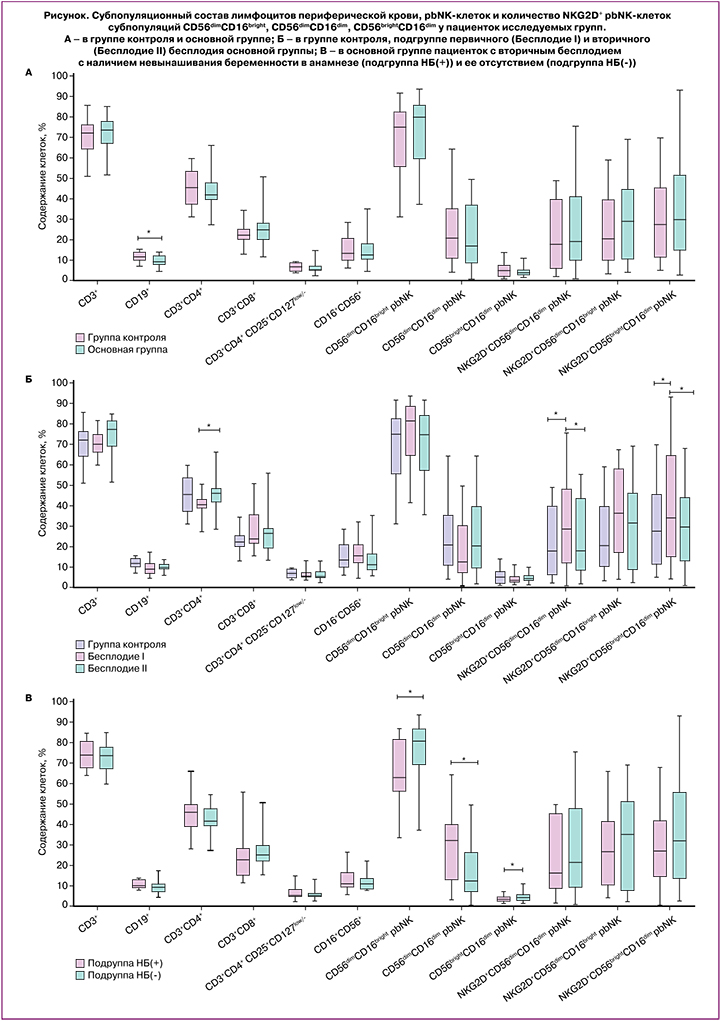
При проведении анализа множественного сравнения данных женщин контрольной группы с пациентками основной группы с первичным и вторичным бесплодием (рис. 1Б), было установлено, что относительное количество Т-хелперов (CD4%) снижено у пациенток с первичным бесплодием по сравнению с вторичным (40,0 (38,1;44,2) и 45,5 (41,1;48,8) соответственно; p<0,05), но не отличалось от пациенток группы контроля. Относительное количество pbNK-клеток было выше при первичном бесплодии по сравнению с вторичным (16,0 (12,7;20,1) и 11,7 (10,1;16,8)), но без статистической значимости. Однако данные в отношении абсолютного количества pbNK-клеток статистически различались и составили 0,40 (0,18;0,47) при первичном бесплодии и 0,19 (0,14;0,24) при вторичном; p<0,01. Других отличий в субпопуляционном составе лимфоцитов периферический крови, pbNK-клеток и количестве Тreg обнаружено не было (табл. 2). Также нами установлено, что у пациенток основной группы с первичным бесплодием по сравнению с вторичным бесплодием и группой контроля было повышено количество pbNK-клеток с фенотипом NKG2D+CD56dimCD16bright (37,0 (19,4;48,1), 17,1 (4,2;39,7) и 17,3 (5,3;39,9) соответственно; p<0,01) и NKG2D+CD56brightCD16dim (42,4 (23,0;64,7), 29,4 (11,7;40,7) и 27,5 (11,4;45,1) соответственно; p<0,05), (рис. 1Б). Количество pbNK-клеток с фенотипом NKG2D+CD56dimCD16dim не имело отличий между сравниваемыми группами.
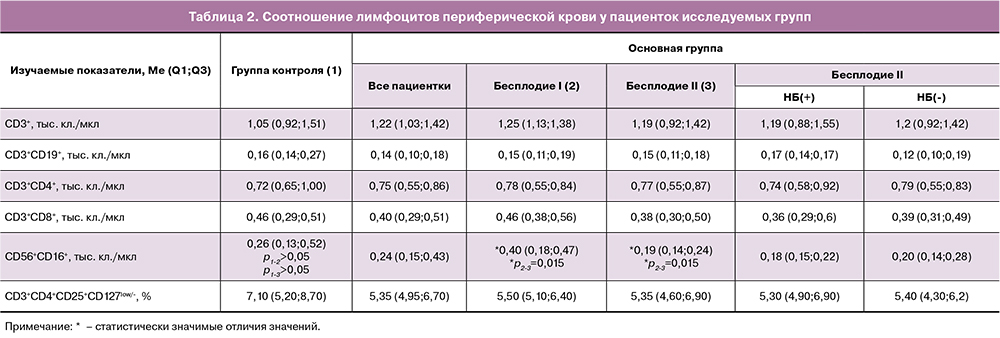
При наличии в анамнезе пациентки основной группы НБ по сравнению с отсутствием НБ были выявлены следующие изменения: уменьшение количества CD56dimCD16bright (62,8 (57,2;80,0) и 82,9 (74,1;87,9); p<0,05) и CD56brightCD16dim (3,4(2,7;4,3) и 5,1(3,4;6,0); p<0,05) pbNK-клеток, увеличение количества CD56dimCD16dim (33,4 (16,4;39,6) и 10,1 (8,2;20,3); p<0,05) pbNK-клеток (рис. 1В).
При оценке экспрессии рецептора CD107а общее количество CD107а+pbNK-клеток не различалось между пациентками контрольной и основной групп. Однако при оценке количества CD16+CD107а+pbNK-клеток, а также интенсивности экспрессии (MFI) ими рецептора CD107а установлено, что у пациенток основной группы, а также при делении ее на подгруппы первичного и вторичного бесплодия данные показатели были ниже по сравнению с группой контроля (табл. 3). MFI CD16-CD107а+ pbNK-клеток также был ниже у пациенток основной группы по сравнению с контролем (р<0,05).
У пациенток основной группы была установлена обратная корреляция количества беременностей в анамнезе с абсолютным содержанием pbNK-клеток (rs=-0,55; p<0,01) и прямая корреляция с MFI CD16+CD107а+pbNK-клеток (rs=0,41; p<0,01). В связи с полученными данными был проведен расчет однофакторной линейной регрессии, в которой в качестве зависимой переменной использовались абсолютные значения pbNK-клеток, а в качестве предиктора – количество беременностей в анамнезе (табл. 4). На основании расчета коэффициентов линейной регрессии получено уравнение предсказанного абсолютного содержания pbNK-клеток: pbNK-клетки = 0,312-0,048×КБ, где КБ – количество беременностей в анамнезе.
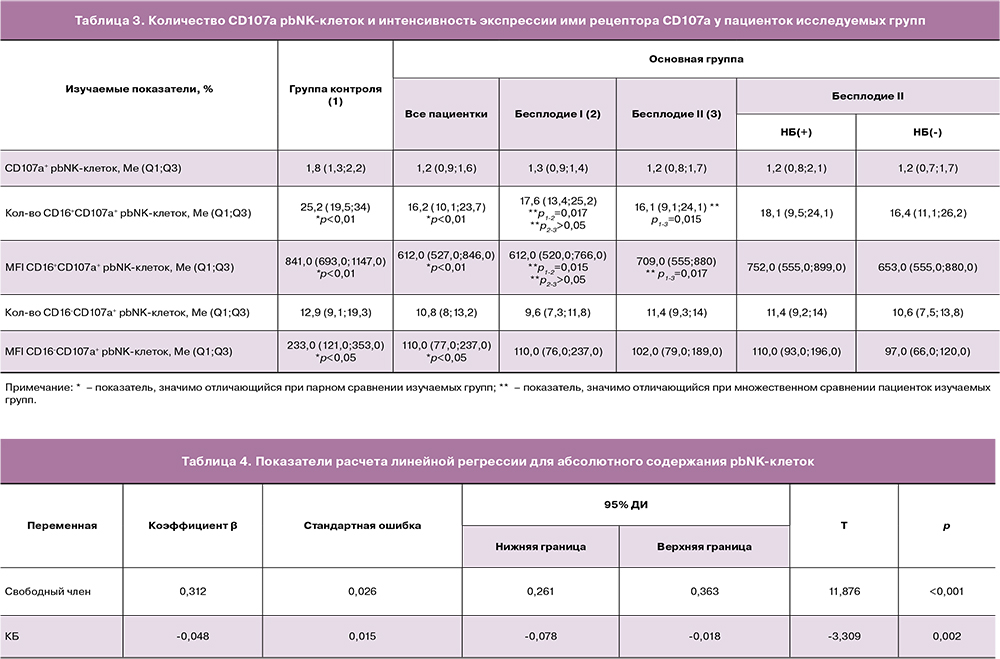
Стандартная ошибка оценки модели = 0,11 тыс./мкл, r2= 0,26 (F=9,39; p<0,01).
Выбросов не обнаружено, остатки распределены нормально.
На основании полученного уравнения можно предположить, что при отсутствии наступлении беременности предполагается вероятность наличия абсолютного содержания pbNK-клеток более 0,312 тыс./мкл.
Обсуждение
В ходе данного исследования была проведена оценка фенотипических характеристик лимфоидных клеток у пациенток с бесплодием и неэффективными протоколами ЭКО. Нами установлено, что относительное количество B-лимфоцитов было ниже в основной группе пациенток по сравнению с группой контроля. В-лимфоциты являются важным компонентом иммунной системы, к функциям которых относятся презентация антигенов, синтез антител, секреция цитокинов, а также иммунорегуляция [22]. B-лимфоциты и их отдельные субпопуляции (регуляторные В-лимфоциты) способствуют наступлению и развитию беременности за счет индукции иммунологической толерантности к полуаллогенному плоду [23]. Снижение количества В-лимфоцитов отражает недостаточную функцию адаптивного иммунитета при репродуктивных заболеваниях. Так, установлено, что у пациенток с повторными неудачами имплантации в протоколах ЭКО, по сравнению со здоровыми фертильными женщинами, снижено количество IL-10-продуцирующих В-лимфоцитов периферической крови [24]. Показано, что уровень В-лимфоцитов крови может иметь прогностическую ценность в отношении исходов беременности. Tu W. et al. (2020) при оценке содержания B-лимфоцитов периферической крови в группе пациенток с повторными неудачами ВРТ до и после проведения протокола показали снижение их количества у женщин, беременность которых завершилась выкидышем, по сравнению с живорождением. При этом уровень B-лимфоцитов крови до беременности менее 15% повышал риск НБ на 39% [25]. Таким образом, полученные нами результаты о более низком количестве B-лимфоцитов у пациенток с неэффективными протоколами ВРТ в анамнезе согласуются с данными литературы.
Нами получены данные об изменении иммунологических показателей крови в зависимости от наличия клинической беременности в анамнезе. У пациенток основной группы с первичным бесплодием по сравнению с пациентками с вторичным установлено повышение абсолютного количества pbNK-клеток в 2,1 раза. Также нами обнаружена обратная зависимость между количеством беременностей у пациенток основной группы и абсолютным содержанием pbNK-клеток, предполагающая негативное влияние увеличения количества pbNK-клеток на процессы имплантации и плацентации. Пороговое значение абсолютного содержания pbNK-клеток, ассоциированное с отсутствием беременности в анамнезе, составило более 0,312 тыс./мкл. Данных литературы относительно сравнения количества pbNK-клеток при первичном и вторичном бесплодии недостаточно. В большинстве работ проведено сопоставление групп с репродуктивными неудачами со здоровыми фертильными женщинами. Так, по результатам метаанализа, у пациенток с бесплодием количество pbNK-клеток значительно выше, чем у здоровых женщин [11]. В работе Triggianese P. et al. (2015) продемонстрировано повышенное количество pbNK-клеток у пациенток с первичным бесплодием по сравнению с группой контроля, однако не было получено достоверных различий с группой привычного НБ [26]. Azargoon A. et al. (2019) показали увеличение количества pbNK-клеток при первичном идиопатическом бесплодии и привычном НБ по сравнению с группой контроля [9].
В проведенном нами исследовании у пациенток основной группы как с первичным, так и вторичным бесплодием по сравнению с группой контроля изменялась функциональная активность pbNK-клеток: снижалось количество CD16+CD107а+ pbNK-клеток в 1,36 и 1,58 раза соответственно, а интенсивность экспрессии рецептора CD107а была снижена в 1,37 и 1,2 раза соответственно. Рядом авторов высказана гипотеза относительно миграции NK-клеток из периферической крови в эндометрий, в результате чего дисфункциональное состояние pbNK-клеток может определять состояние эндометриальных NK-клеток [27]. Полученные данные могут свидетельствовать об избыточном рекрутировании функционально измененных pbNK-клеток в эндометрий у пациенток с бесплодием и неудачами ВРТ, что может обуславливать их недостаточность в процессах имплантации и плацентации. Подобный вывод также подтверждает проведенный нами корреляционный анализ взаимосвязи количества беременностей от выраженности показателя MFI CD107а pbNK-клеток. Эти данные согласуются с результатами исследований ряда авторов, продемонстрировавших низкий цитотоксический потенциал NK-клеток у пациенток с репродуктивными потерями [16, 28].
У пациенток основной группы с первичным бесплодием по сравнению с группой со вторичным также обнаружено увеличение количества NKG2D+ CD56dimCD16bright и NKG2D+CD56brightCD16dim pbNK-клеток. Баланс сигналов активирующих и ингибирующих рецепторов на поверхности NK-клетки имеет фундаментальное значение для ее функционирования. В ряде работ продемонстрировано изменение рецепторного профиля NK-клеток при репродуктивных потерях [17, 29, 30]. Трансмембранный активирующий рецептор NKG2D играет важную роль в развитии различных аутоиммунных заболеваний, вирусных и бактериальных инфекций, осложнениях и исходах трансплантации. Однако данные о его значении в наступлении и течении беременности только накапливаются [31].
При связывании рецептора NKG2D с его лигандом происходят активация NK-клетки и повышение ее цитотоксической активности [32]. К лигандам данного рецептора у человека относятся молекулы MICA, MICB и UL1-6-связывающих белков (ULBP1-6), сверхэкспрессия которых характерна для трансформированных, инфицированных и подвергнутых воздействию других стрессовых факторов клеток, что делает их мишенями для NK-клетки. Неадекватное взаимодействие рецептор-лиганд может привести к нарушению иммунного взаимодействия [31]. Одним из механизмов поддержания иммунологической толерантности в отношении полуаллогенного плода является секреция растворимой формы лигандов NKG2D клетками синцитиотрофобласта [33, 34]. Кроме того, продемонстрирована экспрессия молекул MICA и MICB клетками эндометрия человека [35]. Также показано наличие растворимых форм молекул MICA, MICB и ULBP1 в пуповинной крови доношенного плода, влияющих на снижение функциональной активности NK-клеток матери [36]. На функциональный статус NK-клетки также влияют полиморфизмы гена KLRK1, кодирующего белок NKG2D, которые могут приводить к аутоиммунным нарушениям, потерям беременности и отторжению трансплантата [37]. Установлена связь полиморфизмов rs1049174 G/C и rs2617170 TT гена NKG2D с риском привычного НБ [38, 39].
Таким образом, изменение связывания NKG2D с лигандами в сторону как увеличения, так и снижения рецептивности может приводить к дисфункциональному состоянию NK-клетки и оказывать неблагоприятное влияние на процессы имплантации и плацентации. Возможны как аномальная экспрессия растворимых форм лигандов NKG2D клетками трофобласта при беременности, так и изменение уровня экспрессии самого рецептора NKG2D на NK-клетках за счет связывания с лигандами в эндометрии еще на преимплантационных этапах. Полученные нами данные подтверждают роль рецептора NKG2D pbNK-клеток в репродуктивной функции и требуют дальнейшего изучения.
При оценке субпопуляционного состава pbNK-клеток нами были выделены фенотипы CD56dimCD16bright, CD56dimCD16dim, CD56brightCD16dim. Считается, что pbNK-клетки проходят последовательные стадии дифференцировки [40]. Ряд авторов выделяют субпопуляцию CD56dimCD16dim pbNK-клеток, которая по количеству клеток сравнима или даже превышает CD56brightCD16dim [41]. Клетки CD56dimCD16dim демонстрируют более зрелый фенотип по сравнению с CD56brightCD16dim, в связи с чем предположено, что они являются непосредственными предшественниками клеток CD56dimCD16bright [41]. С другой стороны, клетки CD56dimCD16dim также могут представлять собой промежуточную стадию между подмножествами CD56dimCD16bright и CD56dimCD16- NK-клеток, так как при дегрануляции клетки CD56dimCD16bright способны приобретать фенотип CD56dimCD16- [42]. При этом CD56dimCD16bright pbNK-клетки имеют меньший цитотоксический потенциал, чем CD56dimCD16dim клетки, но сравнительно больший, чем CD56brightCD16dim субпопуляция.
В ходе исследования установлено, что у пациенток группы вторичного бесплодия с НБ в анамнезе изменялся субпопуляционный состав pbNK-клеток. При этом снижалось как количество клеток «регуляторной» субпопуляции CD56brightCD16dim , так и «цитотоксической» CD56dimCD16bright при одновременном увеличении количества CD56dimCD16dim субпопуляции pbNK-клеток средней функциональной активности. Вероятно, не только уменьшение количества клеток «регуляторной» субпопуляции, но и недостаточное количество «активных» pbNK-клеток может являться звеном патогенеза НБ и приводить к прерыванию беременности, наступившей как в результате ЭКО, так и в естественном цикле.
Полученные данные об изменении показателей pbNK-клеток у пациенток, никогда не имевших беременности в анамнезе, в отличие от пациенток с установленным фактом перенесенной клинической беременности требуют дальнейшего изучения, в том числе в отношении популяции эндометриальных NK-клеток. Одними из возможных объяснений могут быть явление фетоматеринского микрохимеризма и развитие концепции так называемой «иммунологической памяти» NK-клеток [43]. Под «иммунологической памятью» последних подразумевается наличие в организме женщины специфических NK-клеток, индуцированных предшествующей беременностью, находящихся в предактивированном состоянии и способных к активному синтезу цитокинов и факторов роста, облегчающих процессы имплантации и плацентации [44]. При этом предположено, что «память» NK-клеток может индуцировать любая беременность, не обязательно завершившаяся родами [45].
Заключение
У пациенток с бесплодием и неэффективными протоколами ВРТ в анамнезе обнаружены изменения иммунологических показателей крови, которые могут быть вовлечены в нарушение механизмов взаимодействия с эмбрионом или плодом на различных этапах, как до, так и после имплантации. Установленные изменения количества и функциональной активности NK-клеток у пациенток с неэффективными протоколами ВРТ при первичном и вторичном бесплодии, а также НБ в анамнезе могут отражать иммунологические отличия патогенеза этих заболеваний. Стоит отметить, что наиболее выраженные изменения количественных и функциональных показателей NK-клеток периферической крови выявлены у пациенток с первичным бесплодием и неэффективными протоколами ВРТ в анамнезе. Таким образом, у пациенток с репродуктивными потерями целесообразна оценка не только количества, но и функционального статуса pbNK-клеток. Необходимы дальнейшие исследования, в том числе оценка показателей эндометриальных NK-клеток и их соотношения с изменениями в периферической крови.



