Эндометриоз – очаг гетеротопии как железистого, так и стромального компонента эндометрия, расположенного за пределами полости матки. Высокая распространенность этого заболевания обнаружена среди женщин репродуктивного возраста, а частота встречаемости варьирует от 6 до 12% [1, 2].
В настоящее время эндометриоз подразделяют на генитальный (наружный и внутренний), поражающий женские половые органы, а также экстрагенитальный, вовлекающий в процесс толстую и тонкую кишку, мочевой пузырь, легкие и т.д. [3]. Отдельный интерес представляет глубокий инфильтративный эндометриоз (ГИЭ), характеризующийся субсерозным поражением любой локализации глубиной более 5 мм [4, 5], одним из вариантов которого является колоректальный эндометриоз с преимущественной локализацией поражения в мышечной оболочке кишки. Частота его встречаемости среди всех больных эндометриозом составляет от 5 до 12%, по одним данным, и от 3,8 до 37% – по другим [6]. Такая вариабельность полученных результатов может являться следствием диагностических трудностей, так как симптомы колоректального эндометриоза не являются патогномоничными, а окончательная верификация диагноза возможна лишь при использовании инвазивного метода – лапароскопии с биопсией [7]. Наиболее часто (около 90% всех случаев колоректального эндометриоза) поражаются прямая и сигмовидная кишка, что может быть обусловлено топографическими особенностями, а именно непосредственной близостью расположения вышеописанных отделов толстой кишки к внутренним половым органам женщины – матке и придаткам. Реже поражается слепая кишка и червеобразный отросток, достаточно редко – тонкая кишка [4, 6–8].
Колоректальный эндометриоз ассоциирован с неспецифическими и специфическими симптомами, связанными с кишечной локализацией. К неспецифическим симптомам относят дисменорею и глубокую диспареунию, к специфическим – периодическую иррадиирующую в промежность боль, симптомы расстройства дефекации (диарею, обстипацию, дисхезию), гематохезию, тошноту и рвоту [9]. Следует отметить, что колоректальный эндометриоз часто является причиной бесплодия [7, 10], а в редких случаях очаги эндометриоидной гетеротопии могут подвергаться малигнизации [11]. Кроме всего вышеперечисленного, колоректальный эндометриоз может осложняться кишечной непроходимостью. Последняя является следствием спаечного процесса в брюшной полости в результате воспаления и фиброза в очагах эндометриоза и обструкции просвета кишки пролабирующими массами гетеротопий [6, 7].
На сегодняшний день принципы лечения колоректального эндометриоза включают консервативную гормональную терапию (комбинированные оральные контрацептивы, прогестины и др.) и хирургическое лечение. Несмотря на то что гормональная терапия достаточно эффективна, она не является радикальной – после ее прекращения возможно возникновение рецидива. Кроме того, консервативная тактика может быть связана с типичными для нее осложнениями, такими как коагулопатия, нарушение жирового и кальциевого обмена, головные боли, депрессивные состояния, снижение либидо. Радикальное же хирургическое лечение может быть ассоциировано с формированием стомы, несостоятельностью анастомозов, кровотечениями, образованием ректовагинальных свищей [6, 7].
Несмотря на большое количество данных о колоректальном эндометриозе, его этиопатогенез в современной литературе представлен неполно, а существующие теории во многом противоречивы. Так, за последние десятилетия возникло несколько гипотез о причинах колоректального эндометриоза. Одной из ранних была гипотеза ретроградной менструации, объясняющая ГИЭ адгезией и последующим проникновением сквозь серозную оболочку фрагментов эндометрия, попавших в брюшную полость через маточные трубы во время менструации [8, 12–14]. С этой теорией тесно связана гипотеза неонатальной менструации, согласно которой фрагменты эндометрия ретроградно попадают на поверхность брюшины во время такого редкого явления, как неонатальное маточное кровотечение [13]. В настоящее время также была выдвинута гипотеза о том, что в основе развития ГИЭ лежат либо стволовые эпителиальные клетки базального слоя эндометрия, либо стволовые клетки костного мозга: мезенхимальные стволовые клетки, гемопоэтические стволовые клетки, эндотелиальные прогениторные клетки, в физиологических условиях принимающие участие в регенерации эндометрия [14, 15]. Кроме того, существуют гипотезы возникновения ГИЭ из остатков парамезонефрального протока и из клеток мезотелия, подвергшихся целомической метаплазии [16, 17].
С учетом сложности клинических, патофизиологических и клеточных проявлений, наиболее универсальным представляется определение колоректального эндометриоза, как многофакторного процесса, а его проявления, снижающие качество жизни, трудности диагностики, осложнения, как самого заболевания, так и его терапии, рецидивирующее течение даже после хирургического лечения характеризуют колоректальный эндометриоз как доброкачественное, но прогностически неблагоприятное заболевание. Ввиду всего вышеперечисленного актуальным представляется изучение этиопатогенеза и морфологических проявлений колоректального эндометриоза с конечной целью установить фармацевтические мишени.
Гистологическая классификация эндометриоза
Макроскопически очаг колоректального эндометриоза представляет собой серо-белый солидный или кистозно-солидный плотный узел неправильной формы. Вышеописанная картина обусловлена возникновением на периферии эндометриоидной гетеротопии реактивных изменений в виде воспаления и фиброза [18, 19]. Очаги гетеротопий расположены в субсерозной основе и мышечной оболочке; реже они могут быть обнаружены в подслизистом слое, в то время как слизистая оболочка в превалирующем большинстве случаев остается интактной (рис. 1). Локализация фокусов эндометриоза в вышеописанных структурах стенки кишки может приводить к ее обструкции за счет склеротической деформации последней, а также формированию полиповидных образований, пролабирующих в ее просвет, или изъязвлений со стороны слизистой оболочки. При гистологическом исследовании очаги эндометриоидной гетеротопии состоят из желез и стромы эндометриального типа с отложением пигмента гемосидерина.

Первая гистологическая классификация эндометриоза была предложена в 1984 г. Schweppe K.W. et al. в контексте ответа того или иного типа эндометриоидных гетеротопий на терапию даназолом [20]. На основании этого было выделено 3 гистологических подтипа эндометриоза: высокодифференцированный – характеризующийся наличием эндометриальных желез и стромы, подвергающихся таким же циклическим изменениям, как и эндометрий типичной локализации; смешанный – характеризующийся наличием, как эндометриальных желез и стромы, так и кистозно-расширенных желез, выстланных эпителием трубного или эндоцервикального типа; низкодифференцированный – характеризующийся железами, выстланными уплощенным кубическим эпителием, не подвергающимся изменениям в соответствии с менструальным циклом.
В начале ХХ в. была предпринята попытка изучения корреляции между различными гистологическими подтипами эндометриоза и его локализацией, стадией по AFSc (American Fertility Society classification)/ASRMc (American Society for Reproductive Medicine classification), болевым синдромом, а также связью с бесплодием [18, 19, 21]. При этом за основу была взята модифицированная вышеупомянутая классификация Schweppe R.W. et al. с выделением 4 паттернов роста, характерных для эндометриоза:
1) высокодифференцированный железистый паттерн, характеризующийся наличием железистых структур, морфологически сходных с железами слизистой оболочки матки (рис. 2А);
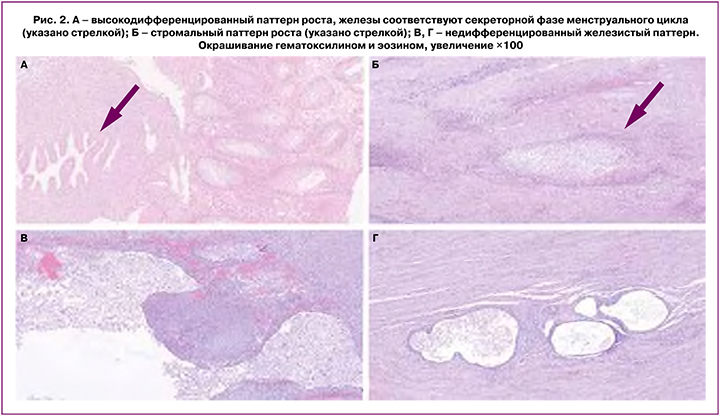
2) стромальный паттерн, характеризующийся наличием стромального компонента, морфологически идентичного эутопическому эндометрию (рис. 2Б);
3) железистый паттерн смешанной дифференцировки, характеризующийся наличием эпителиального компонента, представленного эпителием эндометриального типа с признаками муцинозной метаплазии;
4) недифференцированный железистый паттерн, характеризующийся железами, выстланными уплощенным кубическим эпителием (рис. 2В, Г).
В ряде исследований вышеописанную классификацию также применяли при изучении связи между гистологическим подтипом эндометриоза и его формой. Было продемонстрировано статистически значимое превалирование недифференцированного паттерна среди ГИЭ – от 33,5 до 52% и эндометриоза яичников – от 38 до 40,6%, в то время как при поверхностной форме эндометриоза чаще встречался высокодифференцированный паттерн [18, 21]. В свою очередь, в очагах эндометриоидной гетеротопии колоректальной локализации наиболее распространенным гистологическим паттерном роста являлся паттерн со смешанной дифференцировкой [21].
Кроме того, некоторые данные свидетельствуют о наличии зависимости между паттерном роста и стадией по AFSc. Так, высокодифференцированный железистый и стромальный паттерны были ассоциированы с I (легкой) и II (умеренной) стадиями эндометриоза, в то время как низкодифференцированный паттерн и паттерн со смешанной дифференцировкой ассоциировались с более тяжелыми стадиями болезни – III и IV [18, 19, 21].
При анализе результатов проведенных исследований была подтверждена корреляция и с клиническими проявлениями эндометриоза, такими как боль и бесплодие: пациентки с обнаруженными низкодифференцированным паттерном и паттерном со смешанной дифференцировкой в 2,8 раза чаще испытывали сильную и невыносимую боль по сравнению с другими. Аналогичная тенденция наблюдается и в отношении бесплодия – у женщин с эндометриозом, характеризующимся высокодифференцированным железистым, а также стромальным паттерном, в 2,5 раза чаще возникает беременность по сравнению с женщинами с гистологически верифицированными низкодифференцированным и смешанным паттернами [18].
Приведенные статистические данные позволяют сделать вывод о том, что для колоректального эндометриоза прогностически неблагоприятными являются низкодифференцированный и смешанный гистологические паттерны.
Патогенез колоректального эндометриоза
По мере усовершенствования методов исследования в клеточной и молекулярной биологии, а также развития других фундаментальных дисциплин сформировалось большое количество теорий возникновения эндометриоза, часть из которых рассматривает эндометриоидные гетеротопии разных локализаций как различные проявления одного и того же типового патологического процесса. Так, к колоректальному эндометриозу в той или иной мере применимы все существующие теории его возникновения и развития [8].
Наиболее ранней является теория ретроградной менструации, согласно которой, при возникновении препятствия току менструальных выделений фрагменты эндометрия попадают через фаллопиеву трубу в брюшную полость и проникают через брюшину посредством раздражающего действия на клетки мезотелия с их последующей ретракцией [8, 12–14].
С вышеописанной гипотезой частично согласуется гипотеза неонатального маточного кровотечения, которая объясняет развитие раннего эндометриоза у подростков. У 5–10% новорожденных наблюдается феномен маточного кровотечения, возникающий в результате сочетания повышенной концентрации материнского прогестерона в крови ребенка и повышенной чувствительности ткани эндометрия новорожденного. В таком случае фрагменты отторгающегося эндометрия через фаллопиевы трубы приобретают способность проникать в брюшную полость и имплантироваться в брюшину. На этом процесс затихает до наступления менархе [13].
Вышеописанные теории возникновения ГИЭ в определенной мере объясняют преимущественную локализацию поражений в дистальных отделах кишечника. Фрагменты эндометрия, попадая из фаллопиевых труб в брюшную полость, начинают циркулировать в соответствии с током перитонеальной жидкости, адгезируясь на наиболее близко расположенной прямой и сигмовидной кишке, расположенных на пути тока слева [8].
Другой теорией возникновения эндометриоза является метапластическая теория, объясняющая развитие эндометриоидных гетеротопий у женщин с аплазией матки, а также у мужчин. В ее основе лежит механизм целомической метаплазии – возникновения эндометриальноподобных клеток из мезотелия брюшины. Однако метаплазия является неустойчивым адаптивным процессом, поэтому для ее персистенции необходимы либо постоянно существующие повреждающие факторы, либо возникающие в ее процессе стойкие эпигенетические и генетические перестройки [16, 17].
Кроме того, рядом исследователей была предложена теория возникновения эндометриоза из стволовых клеток. Предполагается, что в регенерации эндометрия после отторжения функционального слоя принимают участие стволовые клетки костного мозга: мезенхимальные стволовые клетки, гемопоэтические стволовые клетки и эндометриальные клетки-предшественники [2, 15]. Во время фазы пролиферации повышается их циркуляция в крови с возможностью формирования гетеротопий. Эти клетки могут становиться предшественниками как эпителиального, так и стромального компонента эндометриоза [22, 23]. Другими возможными источниками регенерации эндометрия в норме могут являться мультипотентные эндометриальные стволовые клетки эндометрия, имеющие как мезенхимальное, так и эпителиальное происхождение. Так же, как и в случае со стволовыми клетками костного мозга, предполагается их экстрагенитальный отсев [22, 24].
В развитии ГИЭ важную роль играет хроническое воспаление с персистенцией в очаге поражения макрофагов и тромбоцитов, экспрессирующих такие факторы, как трансформирующий фактор роста (TGF)-β1, сосудисто-эндотелиальный фактор роста (VEGF)-A, интерлейкины (IL) -6 и -8, и модулирующих активность матриксных металлопротеиназ (ММР). Это стимулирует ангиогенез, эпителиально-мезенхимальный переход, трансдифференцировку фибробластов в миофибробласты, а также стромальных клеток в гладкомышечные клетки, в результате чего возникает фиброз вокруг эндометриоидных гетеротопий и происходит распространение очага вглубь стенки органа (рис. 3) [25–28].
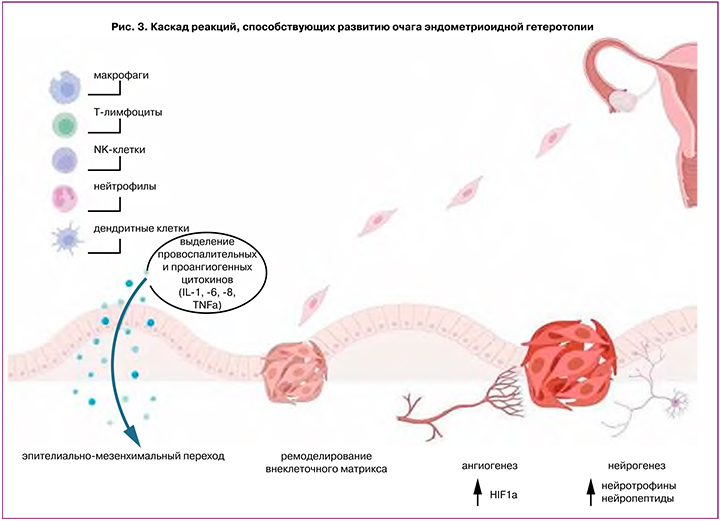
Кроме того, одним из перспективных направлений в изучении механизмов развития ГИЭ, включая и колоректальный эндометриоз, является исследование проэндометриоидной ниши, представляющей собой микроокружение эндометриальной стволовой клетки [28]. Проэндометриоидная ниша может формироваться под влиянием предсуществующих эндометриоидных гетеротопий в брюшной полости, либо непосредственно под влиянием фрагментов эндометрия, попадающих в брюшную полость во время ретроградной менструации.
Проэндометриоидная ниша характеризуется развитием в ней иммунотолерантной среды и наличием факторов, стимулирующих пролиферацию эктопических эндометриальных клеток [26, 28, 29]. Отсутствие адекватного иммунного ответа на наличие в брюшной полости чужеродных для нее клеток достигается за счет модуляции активности клеток врожденного и приобретенного иммунитета, а именно:
- приобретения перитонеальными макрофагами иммуносупрессивного фенотипа М2;
- дифференцировки моноцитов в дендритные клетки, секретирующие IL-1β и IL-6. При этом для колоректального эндометриоза характерно повышение сывороточной концентрации IL-1β;
- снижения цитотоксичности NK-клеток и активации их апоптоза посредством хемокина C-X-C motif chemokine ligand 12 (CXCL12), IL-15 и TGF-β;
- изменения соотношения различных популяций Т-лимфоцитов в нише: привлечения регуляторных Т-клеток, секретирующих IL-10 и TGF-β, которые под воздействием IL-27 теряют способность к дифференцировке в зрелые формы; изменения соотношения хелперных Т1/Т2 лимфоцитов с превалированием Т2-лимфоцитов, ответственных за синтез IL-4 and IL-10. В частности, при колоректальном эндометриозе были выявлены повышенные уровни forkhead box P3 (Foxp3) – маркера регуляторных T-клеток, способных подавлять рекрутирование других клеток иммунной системы [8, 30].
Прогрессия имплантированных на поверхности брюшины эндометриальных клеток в области проэндометриоидной ниши, согласно мнению ряда авторов [28–32], происходит в следующей последовательности.
1. Имплантация на поверхности брюшины, которая вызывает локальное развитие гипоксической среды с высвобождением эндометриоидными клетками фактора, индуцированного гипоксией,1α. Последний стимулирует выработку лептина, циклооксигеназы-2, активирует секрецию макрофагами IL-8, что способствует пролиферации стволовых клеток, ангиогенезу и иммуносупрессии в области эндометриоидных гетеротопий.
2. Эпителиально-мезенхимальный переход мезотелиальных клеток брюшины, запускаемый наличием хронического воспаления в очаге имплантации. Клетки, претерпевшие подобную трансформацию, приобретают возможность к распространению в субсерозные ткани и служат одними из источников фиброза в очагах эндометриоза. В самом начале развития гетеротопии эпителиально-мезенхимальный переход способствует усилению взаимодействия между эктопическими клетками и подлежащей тканью.
3. Адгезия к серозной поверхности за счет кадгериновых и интегриновых рецепторов и инвазия в подлежащие ткани посредством ремоделирования внеклеточного матрикса. Проэндометриоидные ниши, а также непосредственно сами участки гетеротопий стимулируют экспрессию матриксных ММР-1, -2, -3 и -9, подавляя активность ингибиторов тканевых металлопротеиназ. При этом преобладание в очагах эндометриоидных гетеротопий наблюдается за ММР-2. Металлопротеиназы в свою очередь участвуют в ремоделировании экстрацеллюлярного матрикса и инвазии эктопических эндометриальных клеток вглубь стенки органа.
4. Ангиогенез в очаге гетеротопии, который осуществляется посредством экспрессии VEGF-A и его рецепторов, прокинетоцина-1, проявляющих проангиогенные свойства. Кроме того, стимулируют ангиогенез такие цитокины проэндометриоидных ниш, как IL-1, -6, -8 и фактор некроза опухоли (TNF)-α. Наиболее высокие уровни VEGF-A, по сравнению с другими формами эндометриоза, наблюдаются в случаях ректального ГИЭ.
Кроме вышеописанных механизмов, важную роль при колоректальном эндометриозе играют процессы нейрогенеза. Все больше данных указывают на то, что эндометриоидные гетеротопии демонстрируют нейромодулирующие свойства, оказывая непосредственное влияние на рост нервных волокон за счет нейротрофинов, таких как фактор роста нервов, нейротрофический фактор мозга и нейротрофин-3 [33–36]. Фактор роста нервов является ключевым нейротрофином, значения базального уровня которого, в глубоких инфильтративных поражениях значительно выше, чем при других типах эндометриоза, что коррелирует с большей плотностью нервных волокон и более выраженным болевым синдромом при колоректальном эндометриозе [37–39]. Так, в очагах глубоких эндометриоидных гетеротопий отмечено большое количество симпатических, парасимпатических и чувствительных нервных волокон. При этом наиболее выраженная иннервация наблюдается в очагах гетеротопии с локализацией в прямой кишке. Также необходимо отметить, что результаты ряда исследований продемонстрировали дисбаланс в распределении симпатических и чувствительных нервных волокон в пользу последних при поражениях брюшины и колоректальном эндометриозе [37–39].
Формирование новых нервных волокон в очагах колоректального эндометриоза ассоциировано с сильными болевыми ощущениями как ноцицептивного, так и нейропатического характера. Возникновение ноцицептивной боли связано с постоянной стимуляцией чувствительных нервных волокон медиаторами воспаления, что приводит к деполяризации мембран окончаний этих нервных волокон и уменьшению порога восприятия ими болевых стимулов. Постоянное раздражение афферентных окончаний вызывает феномен центральной сенситизации с развитием постоянной невропатической боли [37, 40].
Процессы иннервации также влияют на развитие и прогрессию эндометриоидных очагов за счет продукции нейропептидов. Субстанция Р и CGRP, обнаруженные в чувствительных нервах, при взаимодействии со специфическими рецепторами NK1R, RAMP-1 и CRLR способствуют эпителиально-мезенхимальному переходу, трансдифференцировке фибробластов в миофибробласты, а также стромальных клеток в гладкомышечные клетки, что приводит к увеличению выработки коллагена и фиброзу. Кроме того, нейротрансмиттеры норадреналин, аденозин, нейропептид Y, вазоактивный кишечный пептид оказывают различное воздействие на воспалительные процессы, происходящие в очаге эндометриоза, связываясь со специфическими рецепторами иммунных клеток путем локального высвобождения нейромедиаторов [41].
Кроме всего вышеперечисленного, при колоректальном эндометриозе важную роль играет периневральное распространение поражения (рис. 4), а тропность очагов эндометриоидной гетеротопии к мышечному слою стенки толстой кишки может быть обусловлена расположенной в ней развитой сети метасимпатической нервной системы (Ауэрбахово сплетение) [42].

Заключение
На основании всего вышеперечисленного можно сделать вывод о том, что на настоящий момент не существует общепринятой концепции развития колоректального эндометриоза. Перспективным направлением является изучение пула эндометриальных стволовых клеток как источника возникновения эндометриоза. В совокупности с гипотезой ретроградной менструации и понятием проэндометриоидных ниш гипотеза стволовых клеток позволяет в большинстве случаев создать полную картину становления и развития колоректального эндометриоза. Однако в отличие от гипотезы целомической метаплазии, она не объясняет развитие эндометриоза у мужчин и у женщин с агенезией матки.
Кроме того, данные современной литературы подтверждают, что формирование эндометриоидных гетеротопий в стенке кишки обусловлено дискоординацией иммунных процессов, а также персистенцией в очаге поражения различных клеток воспаления, модулирующих активность матриксных металлопротеиназ и экспрессирующих цитокины, ангиогенные факторы, нейротрофины. Это стимулирует ангиогенез и нейрогенез, эпителиально-мезенхимальный переход, трансдифференцировку фибробластов в миофибробласты, а также стромальных клеток в гладкомышечные клетки, что обеспечивает выживаемость эндометриоидных гетеротопий. В свою очередь, дальнейшее изучение иммунного и медиаторного профиля в очаге эндометриоидной гетеротопии может внести вклад в разработку таргетного лечения вышеописанного заболевания.



