В настоящее время легочные и внелегочные формы туберкулеза у человека хорошо изучены и подробно описаны [1–3]. Экспериментальное моделирование туберкулеза легких у мышей проводилось многократно [4–11]. Изучение репродуктивных органов в эксперименте до недавнего времени проводили посредством моделирования генитального туберкулеза, используя внутривагинальный, внутриматочный, алиментарный и внутрибрюшинный пути введения Mycobacterium tuberculosis (Mtb) [12, 13]. Эти методики носят искусственный характер, далекий от реального механизма вовлечения половых органов в туберкулезный процесс у человека. В литературе имеется крайне малое количество экспериментальных работ, посвященных изменениям в репродуктивных органах при туберкулезе органов дыхания, в том числе с использованием самок мышей [14].
Примечательность лабораторной мыши для изучения репродуктивных проблем заключается в полной идентичности ее половой системы человеческому организму. У самки мыши имеются половые органы: яичники, маточные трубы (рога), матка, влагалище. Гистологическое строение половых органов мыши также аналогично эпителию человеческого организма [15]. Оценка влияния туберкулезной инфекции на органы половой системы представляет огромный научный интерес и внесет вклад в понимание патогенеза репродуктивных нарушений при активном туберкулезе органов дыхания.
Целью настоящего исследования явилось создание модели воспалительного процесса в репродуктивных органах самок мышей с различной генетически детерминированной восприимчивостью к туберкулезной инфекции при аэрозольном инфицировании Mtb.
Материалы и методы
Работа выполнена на самках мышей инбредных линий C57BL/6 и I/St, поддерживаемых в питомнике лабораторных животных ФГБНУ «ЦНИИТ». Мышей разводили в соответствии с методическими указаниями Министерства здравоохранения РФ № 755, INH Office of Laboratory Animal Welfare (OLAW). Все экспериментальные процедуры были одобрены Этическим комитетом ЦНИИТ по уходу за животными (протоколы IACUC № 4, 9, 14). Самки весом 20–22 г, которые не были в контакте с самцами, были заражены в аэрозольной камере Glas-Col (США) в дозе 100 КОЕ/легкое. Mtb вирулентного штамма H37Rv была любезно предоставлена Gilles Marchal (Институт Пастера, Париж) и сохранена в отделе иммунологии ФГБНУ «ЦНИИТ». Общее количество мышей (n=27) разделили на группы: 1-я – интактные мыши (n=3); 2-я – мыши линии C57BL/6 (n=12), которых последовательно выводили из эксперимента через 3 (n=3), 7 (n=3), 15 (n=3), 35 (n=3) дней от момента инфицирования; 3-я группа – мыши линии I/St (n=12), которых последовательно выводили из эксперимента через 3 (n=3), 7 (n=3), 15 (n=3), 35 (n=3) дней от момента инфицирования.
Вагинальную флору анализировали с помощью тест-системы «Фемофлор», основанной на методе полимеразной цепной реакции в режиме реального времени [14, 16]. Для этого до инфицирования (день 0), а также через 3, 7, 15, 35 дней после инфицирования у каждой мыши были взяты индивидуальные образцы вагинальных мазков и помещены в гуанидин тиоцианат-фенол-хлороформ (тризол). Для гистологического исследования один маточный рог помещали в 10% формалин. Из фиксированных образцов готовили срезы и окрашивали гематоксилин-эозином. Морфологическое исследование органов репродуктивной системы соотносили с фазой эстрального цикла. Наиболее объективные данные получали у мышей в фазе метаэструса и диэструса. Степень выраженности эндометрита при гистологическом исследовании определяли согласно методике Эллиниди В.Н. и соавт. [17] с учетом морфологических признаков: наличие воспалительных инфильтратов из лимфоцитов, макрофагов, эозинофилов с расположением вокруг желез и кровеносных сосудов, наличие в инфильтратах плазматических клеток, наличие очагового фиброзирования стромы эндометрия, наличие склеротических изменений стенок спиральных артерий эндометрия, формирование сосудов капиллярного и синусоидного типов.
Каждый морфологический признак оценивали в 1 балл. Поражение эндометрия оценивали в 10 полях зрения. По сумме баллов оценивали степень выраженности эндометрита: от 1 до 4 баллов – легкая степень, от 5 до 7 баллов – средняя степень, 8–10 баллов – тяжелая степень.
Для микробиологического и молекулярно-генетического исследования на наличие Mtb и ДНК Mtb другой маточный рог помещали в фосфатный буфер и гомогенизировали; в 1 мл тризола вносили по 100 мкл гомогената.
Статистическую обработку полученных результатов проводили с использованием лицензионной программы Microsoft Excel, статистического пакета IBM SPSS Statistics v.21 (2012 г.). В качестве меры центральной тенденции была выбрана медиана (Me), а в качестве интервальной оценки – верхний (Q3) и нижний квартили (Q1). Результаты представлены в виде Me (L–H). Для оценки значимости межгрупповых различий применялся U-критерий Манна-Уитни для несвязанных совокупностей. Статистически значимыми считались различия при р<0,05 (95-й уровень значимости).
Результаты и обсуждение
При исследовании животных 1-й (контрольной) группы было показано, что вагинальная флора характеризуется общей бактериальной массой (ОБМ) – 103–104 геном-эквивалента/мл, наличием единичных лактобацилл и аэробно-анаэробным типом биотопа. Микробиологическое и молекулярно-генетическое исследования вагинальных мазков, легких, маточных рогов выявили отсутствие Mtb, ДНК Mtb. Морфологическое исследование срезов легких и маточных рогов показало наличие нормального гистологического строения данных органов.
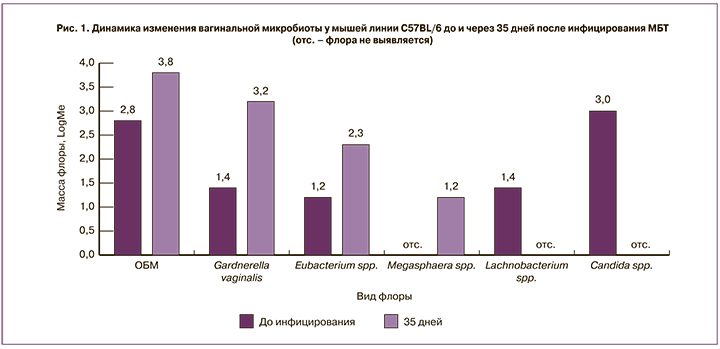
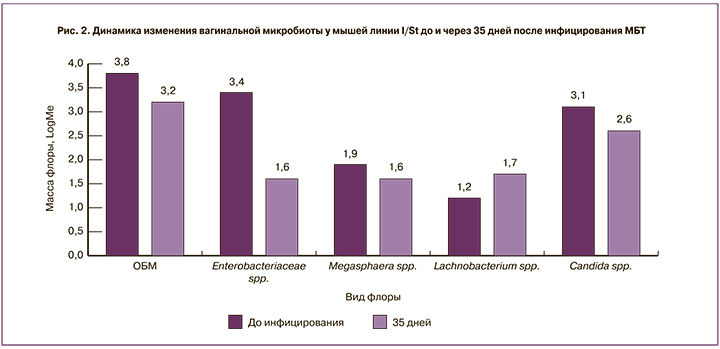
Анализ вагинальной микробиоты у мышей 2-й группы (C57BL/6) показал достоверное увеличение ОБМ уже на 3-е сутки инфицирования Mtb – с 2,8 (2,5;3,2) до 5,2 (4,6;6,0) (р=0,043), несколько снижаясь к 35-му дню после заражения Mtb до 3,8 (4,6;3,5). Среди мышей 3-й группы (I/St) ОБМ практически не менялась на протяжении всего периода наблюдения: до инфицирования – 3,8 (3,0;4,9), на 35-й день инфицирования Mtb – 3,2 (2,8;3,6). Вагинальный микробиоценоз у самок мышей 2-й группы (C57BL/6) через 3 дня после инфицирования Mtb характеризовался достоверным повышением Enterobacteriaceae spp. – с 2,2 (1,0;2,5) до 4,2 (3,3;4,9) (р=0,017) с последующим снижением через 35 дней после инфицирования Mtb до 2,3 (2,2;3,2). Отмечали также через 35 дней после инфицирования Mtb рост Eubacterium spp. – с 1,2 (0,0;2,6) до 2,3 (0,0;2,6); Megasphaera spp. – с 0,0 (0,0;0,0) до 1,2 (0;1,4); Gardnerella vaginalis – с 1,4 (0,0;2,8) до 3,2 (0;3,5), без статистически значимой разницы. Напротив, у мышей 3-й группы (I/St) через 35 дней после инфицирования по сравнению с данными до инфицирования наблюдали снижение Enterobacteriaceae spp. – с 3,4 (2,9;3,8) до 1,6 (0,0;2,4) и Candida spp. – с 3,0 (3,0;3,1) до 2,6 (0,0;3,0); незначительное повышение массы Lachnobacterium spp. /Clostridium spp. с 1,2 (0,3;2,3) до 1,7 (0,0;2,6), без статистически значимой разницы. У мышей обеих линий, независимо от сроков инфицирования, не выявляли Lactobacillus spp., Peptostreptococcus spp., Sneathia spp./Leptotrihia spp./Fusobacterium spp., Atopobium vaginae spp., Ureaplasma urealyticum.
Таким образом, у самок мышей обеих линий регистрируются разные изменения вагинальной микробиоты: статистически значимый дисбаланс с тенденцией к формированию умеренного дисбиоза на ранних сроках инфицирования Mtb у мышей линии C57BL/6 и отсутствие статистически значимых изменений у мышей линии I/St, независимо от сроков инфицирования Mtb (рис. 1–2).
Проведено морфологическое исследование репродуктивных органов на 3-е сутки после аэрозольного инфицирования Mtb у мышей 2-й и 3-й групп (C57BL/6, I/St). В обеих группах установлено нормальное строение эндометрия: слизистая оболочка покрыта высоким призматическим эпителием, имеются железы пролиферативного типа. Эпителиоциты расположены у основания клетки, с интенсивным окрашиванием и немногочисленными митозами. Цитоплазма базофильная. Апикальный край эпителиальных клеток ровный, четко очерченный. Строма состоит из веретенообразных клеток, отмечаются интерстициальный отек, полнокровные сосуды, умеренно выраженная периваскулярная и перигландулярная лимфоцитарно-плазмоцитарная инфильтрация.
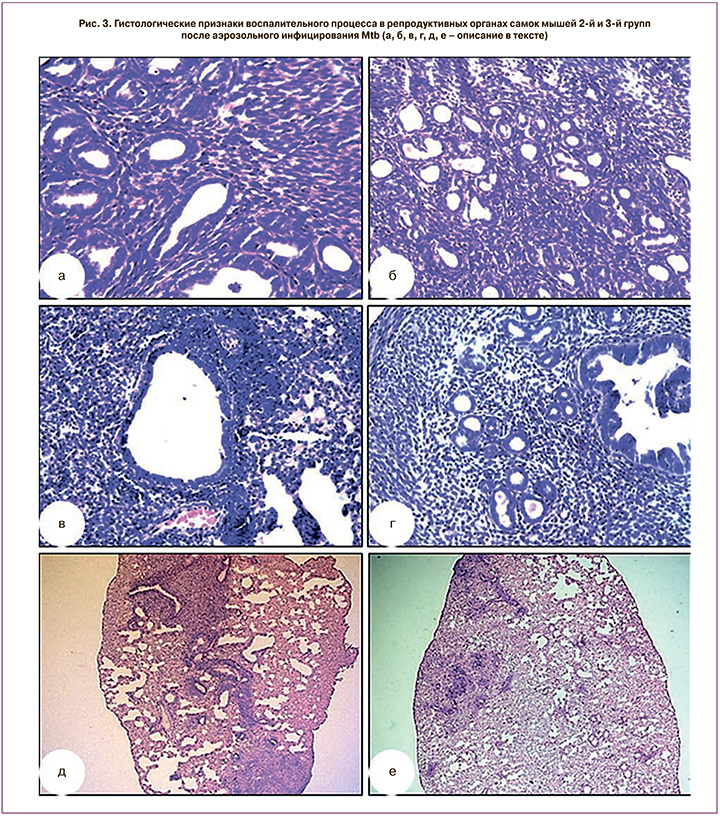
Через 7 дней после аэрозольного инфицирования Mtb у мышей 3-й группы (линии I/St) выявляли картину хронического неспецифического эндометрита в виде выраженной перигландулярной инфильтрации лимфоцитами, эозинофилами с примесью плазмоцитов (рис. 3, а), что позволяет говорить о хроническом эндометрите легкой степени выраженности (1+2). Имеет место очаговый воспалительный процесс, в большей части исследуемого материала воспалительные изменения выражены минимально. Во 2-й группе мышей (линии C57BL/6) подобных гистологических изменений в репродуктивных органах не наблюдали (рис. 3, б).
Через 15 дней после аэрозольного инфицирования Mtb у мышей 2-й и 3-й групп (C57BL/6 и I/St) в экссудате, расположенном перигландулярно, периваскулярно и очагово, среди интерстициального отека отмечаются увеличение эозинофилов и их гнездное расположение, преимущественно вокруг сосудов, местами контактируя с перицитами. Выраженность межлинейных изменений не существенная.
Через 35 дней после аэрозольного инфицирования Mtb у мышей 3-й группы (линии I/St) в эндометрии отмечается более выраженная и распространенная воспалительная реакция. Слизистая оболочка эндометрия покрыта высоким призматическим эпителием. В эпителии некоторых желез обнаруживаются субнуклеарные вакуоли. Строма сочная, разрыхлена, состоит из веретенообразных клеток; ядра клеток крупные, округлые; определяются фокусы фиброза и периваскулярная, перигландулярная лимфо-плазмоцитарная инфильтрация. Сосуды несколько извитые, расположены на поверхности эндометрия, перигландулярно и периваскулярно, с очаговым фиброзом. Местами отмечается очаговое скопление лимфоцитов в строме, по типу формирования лимфоидных фолликулов (рис. 3, в). В данной группе имеет место хронический эндометрит тяжелой степени выраженности (4+3), распространенный воспалительный процесс в эндометрии. У мышей 2-й группы (линии C57BL/6) гистологические признаки воспаления в репродуктивных органах были менее выраженными (рис. 3, г) – склеротические изменения стенок спиральных артерий эндометрия не определяли (3+3); хронический эндометрит средней степени выраженности. При исследовании легких мышей 2-й и 3-й групп через 35 дней после инфицирования Mtb обнаружены гистологические признаки туберкулезного поражения (рис 3, д, е).
При микробиологическом и молекулярно-генетическом исследованиях репродуктивных органов мышей 2-й и 3-й групп (C57BL/6 и I/St) Mtb и ДНК Mtb обнаружены не были. Микробиологическое исследование легочной ткани мышей 2-й и 3-й групп показало высокую бактериальную нагрузку через 35 дней после аэрозольного инфицирования Mtb – 5,12 (4,98;5,32) у C57BL/6 и 6,39 (6,21;6,47) у I/St.
Таким образом, нами установлены гистологические признаки воспалительного процесса в репродуктивных органах самок мышей 3-й группы (линии I/St) на фоне условного нормоценоза через 35 дней после аэрозольного инфицирования Mtb. У самок мышей 2-й группы (линии C57BL/6) в этот же период времени отмечали менее выраженный воспалительный процесс в репродуктивных органах на фоне дисбаланса вагинальной флоры с тенденцией к формированию умеренного дисбиоза. Воспалительные изменения в репродуктивных органах у мышей 2-й и 3-й групп нарастали по мере прогрессирования туберкулезной инфекции в легких.
Заключение
Туберкулез является системной инфекцией, характеризующейся развитием параспецифических реакций в различных системах макроорганизма, в том числе и в репродуктивных органах. Аэрозольный путь инфицирования Mtb максимально приближает экспериментальную модель развития легочного туберкулеза к реальному патогенетическому механизму у человека. При этом огромное значение имеет индивидуальная восприимчивость к туберкулезной инфекции, которая обусловлена генетической предрасположенностью. Использование двух оппозитных инбредных линий мышей – устойчивой и чувствительной к туберкулезу (C57BL/6 и I/St) дает понимание, почему скорость и интенсивность воспалительного процесса в репродуктивных органах бывают индивидуальными. При этом немаловажным фактором является последовательность процессов во взаимоотношениях макро- и микроорганизма: прогрессивное увеличение бактериальной нагрузки и формирование туберкулезного поражения в легких; изменения в микробиоте влагалища от условного нормоценоза к умеренному дисбиозу; последовательное развитие воспалительного процесса в репродуктивных органах (матке и маточных рогах). Следует отметить, что, по результатам исследования вагинальной микробиоты, пока трудно сделать окончательные выводы, но мыши линий C57BL/6 и I/St показали межлинейные различия по этому признаку на ранних сроках инфицирования Mtb. Многократные микробиологические, молекулярно-генетические и морфологические исследования репродуктивных органов самок мышей в проведенных нами ранее экспериментальных моделях туберкулеза убедительно демонстрируют последовательное развитие воспалительного процесса, независимо от способа инфицирования Mtb и выбора линии мышей.



