Сахарный диабет (СД) – это распространенное метаболическое заболевание с высоким риском развития хронических осложнений, одним из которых является диабетическая остеопатия [1]. Патофизиологические процессы, связывающие изменения в костной ткани с СД, могут быть вызваны непосредственным воздействием дефицита инсулина и/или гипергликемии на кость, конечными продуктами гликирования матричных белков костной ткани, нарушающих синтез костного коллагена, производством воспалительных цитокинов и адипокина и их повреждающим воздействием на клетки кости и нарушением нервно-мышечной регуляции [2, 3]. Как известно, наличие данного заболевания в анамнезе увеличивает вероятность переломов, с одной стороны предрасполагая к более высокой частоте падений и снижая минеральную плотность костной ткани (МПК) – с другой [4].
Постменопаузальное ремоделирование костной ткани у женщин старшей возрастной группы отягчается СД 1-го типа, приводя к повышению риска переломов шейки бедра в 12 раз в сравнении с общей популяцией [5].
Целью исследования была оценка влияния изменений, протекающих в организме у женщин при СД 1-го типа, на состояние МПК и показатели ее метаболизма; определение направленности изменений сывороточных маркеров костного ремоделирования и МПК в пери- и постменопаузальном периодах при данном заболевании.
Материал и методы исследования
Проведено поперечное рандомизированное исследование, в которое были включены 57 женщин с СД 1-го типа в период пери- и постменопаузы, у которых ранее не были диагностированы расстройства костного метаболизма и остеопороз. Возраст обследованных женщин – от 40 до 68 лет (56,3±0,9 года). Длительность СД составила 17,08±0,8 года, среднее значение гликозилированного гемоглобина (HbA1c) – 7,5±0,2%, нейропатия и ретинопатия выявлены у 23 и 52% пациенток соответственно. Всем больным назначался инсулин короткого и длительного действия в общей суточной дозе 48,7±4,3 Ед. Контрольную группу составили 43 женщины (55,4±1,2 года) без СД в анамнезе.
Критерии исключения: женщины, ранее лечившиеся по поводу остеопороза или имевшие в анамнезе перелом, а также пациентки с заболеваниями эндокринной системы, печени и почек недиабетической природы, диабетическая нефропатия 4–5-й стадии в анамнезе.
Собирался анамнез, измерялся вес (66,9±0,9 кг) и рост (161,1±0,7 см), вычислялся индекс массы тела (ИМТ) в кг/м2 (25,8±0,3 кг/м2). Менопаузальный статус обследуемых женщин оценивали с помощью индекса Куппермана. Длительность менопаузы в среднем составила 13,4±0,8 года. Всем пациенткам проводили двухэнергетическую рентгеновскую абсорбциометрию (Dual-energy X-ray Absorbtiometry – DXA) на денситометре (DXA HOLOGIC, модель Discovery QDR 4500А, USA) поясничного отдела позвоночника (L1-L4), области проксимального отдела и шейки бедренной кости. МПК по критериям ВОЗ, применяемым к диагностике, расценивалась как остеопороз (Т-критерий ≤2,5SD), остеопения (Т-критерий от -1 до -2,5 SD) и нормальная (Т-критерий > -1).
Параметры фосфорно-кальциевого обмена оценивались по концентрации общего (tCa) и ионизированного кальция (iCa) и неорганического фосфора (P) в сыворотке крови. Также проводили оценку уровня паратиреоидного гормона (РТН), кальцитонина (СТ) и витамина D3 (25(ОН)D). О состоянии формирования костной ткани судили по активности общей щелочной фосфатазы (ALP) и содержанию аминотерминального пропептида проколлагена I типа (PINP) в сыворотке крови. Об уровне резорбции костной ткани судили по содержанию С-терминального телопептида (b-CTх). Исследование костных маркеров проводили на автоматическом электрохемилюминисцентном анализаторе Cobas e41 с использованием реагентов «Roсhe Diagnostics» (Германия).
Анализ полученных данных проводили с использованием методов вариационно-математической статистики программы «BioStat Pro 6.2.2.0» с соблюдением общих рекомендаций для медицинских и биологических исследований. Статистическая значимость различий параметров определяли по критерию U Манна–Уитни. Полученные данные представлены в виде среднего арифметического и ошибки среднего (М±m) и 95% доверительного интервала для среднего (95% ДИ). Различия считали статистически значимыми при р<0,05. Для исследования зависимостей между параметрами применяли корреляционный анализ по Спирмену (г).
Результаты исследования
По результатам исследования, в группе женщин с СД 1-го типа среднее значение уровня tCa при некоторой тенденции к более низким в сравнении с группой контроля значениям, статистически значимо не отличалось (p>0,05) и в обеих группах соответствовало возрастному референсному диапазону (8,4–10,2 мг/дл), с направленностью к снижению в постменопаузе. Значения iCa в группе пациенток с СД 1-го типа были статистически значимо ниже контрольных значений (р<0,05), в постменопаузальной подгруппе пациенток с СД 1-го типа отмечалось максимальное снижение концентрации iCa до 1,05±0,01 ммоль/л (р<0,05). В группе контроля средние показатели Р в сыворотке крови в постменопаузе был статистически значимо ниже, чем у пациенток с СД 1-го типа (р<0,05). Результаты представлены в таблице.
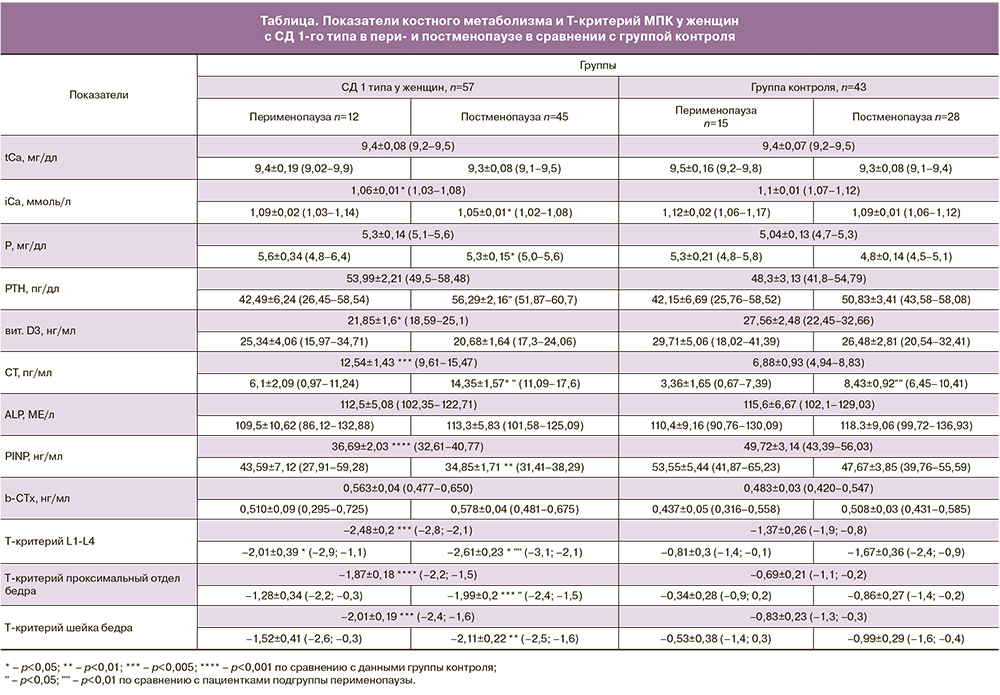
У женщин, длительно болеющих СД 1-го типа, уровень РТН статистически значимо отличался от аналогичного показателя у женщин с длительностью СД менее 10 лет (р<0,05). В результате исследования, в группе пациенток с СД 1-го типа выявлено более выраженное снижение ниже референсных значений среднего значения витамина D3, в сравнении с группой контроля (р<0,05), с тенденцией к снижению в постменопаузе в обеих группах. Из 57 больных СД 1-го типа у 19 (33%) был выявлен дефицит витамина D3 (концентрация ниже 10 нг/мл). С увеличением длительности СД наблюдалось понижение уровня витамина D3, с отрицательным коэффициентом ранговой корреляции по Спирмену: r=-0,397, р=0,01. Также, выявлены изменения содержания витамина D3 в зависимости от количества iСа в крови. Была определена положительная связь, с достаточным уровнем статистической значимости различий (r=0,391, р<0,05). У женщин из группы контроля в постменопаузе средний уровень СТ был статистически значимо ниже, чем у пациенток с СД 1 типа (р<0,05).
Полученные в результате исследования данные о повышении значения РТН и СТ наряду со снижением концентрации кальция позволяют утверждать о нарушении секреции кальцийрегулирующих гормонов и их связи с патологическим костным ремоделированием при СД 1-го типа. Необходимо отметить, что с увеличением длительности заболевания и в стадии декомпенсации выраженность данных изменений растет.
Пациентки с СД 1-го типа продемонстрировали снижение маркеров костеобразования ALP и PINP у 35,5%, с достаточным уровнем статистической значимости (p>0,05 и p<0,001) и повышение маркера костной резорбции b-CTх у 16,6% пациенток (p>0,05). Средние значения PINP в группе СД составило 36,69 нг/мл (32,61–40,77 нг/мл), и было ниже по сравнению с контрольной группой 49,72 нг/мл (43,39–56,03 нг/мл, p<0,001). Среднее значение показателя PINP в подгруппе постменопаузальных пациенток с СД 1-го типа было также ниже возрастного норматива (p<0,01). В то же время значения маркера резорбции кости b-CTх статистически значимо не отличались от значений пациенток из группы контроля (p>0,05). У постменопаузальных пациенток с СД 1-го типа среднее значение СТх было незначительно выше, чем у женщин в перименопаузе. Однако в соответствии с возрастной нормой, за референсные значения оно не выходило. У части женщин с СД 1-го типа выявлено снижение маркера костеобразования PINP на фоне неизмененной костной резорбции. Данные ряда авторов в исследованиях по оценке показателей костного ремоделирования при СД 1-го типа также указывают на снижение главным образом маркеров костеобразования [5, 6], в то время как значения маркеров костной резорбции в большинстве работ статистически не отличались от контрольных.
Была выявлена статистически значимая корреляция между уровнем CTX и P1NP с длительностью диабета (r=0,349, p=0,008) и (r=-0,210, p=0,03). Уровень P1NP отрицательно коррелировал с HbA1c (r=-0,328, p=0,03). Уровень b-CTх у лиц с СД 1-го типа отрицательно коррелировал со скоростью клубочковой фильтрации (eGFR: r=-0,207, p=0,04). Также была обнаружена корреляция между билирубином, альбумином, ИМТ и уровнем b-CTх (билирубин: r=0,284, p=0,03; альбумин: r=-0,542, p=0,003; ИМТ: r=0,219, p=0,03).
Женщины с СД 1-го типа имели выраженные и статистически значимые (р<0,005) в сравнении с группой контроля изменения показателя Т-критерия МПК в позвонках (L1-L4) и в области шейки бедренной кости. При СД 1-го типа количество случаев остеопороза в позвонках (L1-L4) у женщин составило 30%, в проксимальном отделе и в шейке бедренной кости – 20 и 32,5% случаев соответственно. Остеопения в позвонках у женщин при СД 1-го типа выявлена в 35%, а в области проксимального отдела бедренной кости – в 48,5% случаев. В области шейки бедренной кости остеопения у женщин с СД 1-го типа выявлена в 25% случаев. У 31 из 57 женщин с СД 1 типа были выявлены изменения T-критерия только в поясничном отделе позвоночника, у 13 женщин только в бедренной кости. В 10 случаях определялось сочетание изменений двух областей. Таким образом, часть женщин (n=44), у которых выявлены изменения только в одном из изучаемых участков, могли подвергнуться риску ошибочного диагноза, если бы были сделаны измерения МПК только одной зоны.
У пациенток группы контроля число случаев остеопороза в позвонках (L1-L4) составило 14%, в проксимальном отделе и в шейке бедренной кости – 2,3 и 7% случаев, соответственно. Остеопения в позвонках выявлена у 23% женщин. В области проксимального отдела бедренной кости остеопения у женщин группы контроля выявлена в 26%, а в области шейки бедренной кости – в 28% случаев.
Выявлена отрицательная корреляция между изменением Т-критерия области поясничного отдела позвоночника и длительностью диабета: r=-0,239, р=0,03. Определена отрицательная корреляция между изменением Т-критерия, измеренного в области прокимального отдела и шейки бедренной кости с длительностью диабета: r=-0,568, р=0,001 и r=-0,460, р=0,01. Средней силы отрицательная корреляция отмечена также в подгруппе постменопаузальных женщин: r=-0,515, р=0,01 и r=-0,416, р=0,04. У женщин с СД в постменопаузе снижение МПК в этой области происходит соответственно увеличению длительности заболевания с сопутствующими возрастными изменениями. Выявлена отрицательная корреляция между Т-критерием, измеренным в области поясничного отдела позвоночника и уровнем маркера костного метаболизма b-CTX: r=-0,452, р=0,002. Статистически значимая отрицательная корреляция отмечена также в подгруппе постменопаузальных женщин: r=-0,489, р=0,003. Это позволяет полагать, что наличие СД 1-го типа в анамнезе усугубляет нарушения костного гомеостаза, тем самым способствуя развитию остеопороза в поздние сроки постменопаузы.
Анализ данных в отношении маркеров метаболизма костной ткани у женщин показал статистически значимую связь между длительностью СД 1-го типа с уровнем b-CTX и Т-критерием, измеренным в области поясничного отдела позвоночника. Это свидетельствует о том, что и маркеры костного метаболизма, и DXA являются независимыми факторами, указывающими на наличие изменений в костной ткани, что может иметь большое значение для ранней диагностики и оценки эффективности проводимой терапии [6, 7].
Объяснить наличие нарушений костного ремоделирования только ранним дебютом СД 1-го типа, при котором, как правило, пациенты не успевают набрать пиковую костную массу, невозможно, так как у части пациентов с СД с дебютом заболевания после 30 лет все равно определяется снижение показателей МПК [1]. В связи с чем была выдвинута гипотеза об аутоиммунном генезе нарушения процессов ремоделирования кости при СД 1-го типа, основанная на выявлении значительного снижения МПК [7].
Заключение
Результаты данного исследования показывают, что изменения в костном метаболизме у большей части обследованных пациенток связаны с подавлением костеобразования и, в значительно меньшей степени, с резорбцией костной ткани, ускоряющейся в период поздней перименопаузы и продолжающейся аналогичными темпами в первые годы постменопаузы со снижением интенсивности потери костной массы в последующем.



