Всемирная организация здравоохранения и Организация Объединенных Наций объявили текущий период (2021–2030 гг.) десятилетием здорового старения [1, 2]. Повышение уровня оказания медицинской помощи, внедрение программ социальной поддержки и реабилитации привели к увеличению доли лиц пожилого и старческого возраста. Несомненно, с увеличением продолжительности жизни количество сопутствующих заболеваний повышается, поэтому многие пациентки «элегантного возраста» имеют заболевания сердечно-сосудистой и эндокринной систем, цереброваскулярные нарушения, респираторные заболевания, поражения суставов и др. В настоящее время женщины в возрасте ≥50 лет во многих странах являются самой быстрорастущей демографической группой [3]. Продолжительность жизни современных женщин больше, чем у мужчин, но они нередко вынуждены проживать значительную ее часть с комплексом вышеперечисленных коморбидных состояний, связанных со старением, особенно метаболических и сердечно-сосудистых заболеваний (ССЗ) [4].
Менопауза – это не только последняя менструация в жизни женщины, а более широкое понятие. К 2050 г. во всем мире более 1,6 млрд женщин достигнут менопаузы или будут находиться в постменопаузе по сравнению с 1 млрд в 2020 г. [3]. Стигматизация и ограниченная доступность к научно обоснованным методам профилактики и лечения, направленным на поддержание благополучия в этот непростой жизненный период, приводят к тому, что он может сопровождаться тяжелыми симптомами, снижением качества жизни и формированием факторов риска. Наиболее эффективное направление для предупреждения будущих проблем со здоровьем – выявление факторов риска и профилактика их реализации, а также диагностика заболеваний на начальной стадии у женщин в пери- и ранней постменопаузе и их адекватное лечение с привлечением междисциплинарного врачебного подхода [5, 6].
Назрела острая необходимость в объединении общественных и социальных усилий, расширении своевременных и эффективных медицинских вмешательств для скорейшего устранения разрыва между продолжительностью жизни и низкими показателями качества жизни стареющей женской популяции в целях достижения долголетия без болезней [7, 8]. Согласно поручению Президента России, планируется повышение ожидаемой продолжительности жизни в РФ до 78 лет к 2030 г. и до 81 года к 2036 г. [9]. Одной из важных задач государственной политики становится сохранение здоровья женщин всех возрастов, улучшение качества жизни и увеличение периода активного долголетия [10, 11].
В связи с вышесказанным значимость работы гинеколога трудно переоценить, поскольку в переходный период женщины чаще всего обращаются со своими проблемами, в том числе с вазомоторными менопаузальными симптомами (ВМС), именно к этому специалисту. Выбор в пользу назначения менопаузальной гормональной терапии (МГТ) для эффективного лечения менопаузальных расстройств вызывает особый интерес со стороны врачей и пациенток, однако здесь существует много «мифов» и ошибочных представлений. Необходимо устранение оставшихся пробелов в знаниях врачей для предоставления женщинам основанной на доказательствах медицинской помощи. Критическим заблуждением как врачей, так и пациенток является предположение, что все женщины представляют собой однородную группу, одинаково реагирующую на гормональную терапию независимо от типа эстрогена/прогестагена, дозы или пути введения, а также от индивидуальных факторов риска [3, 12].
Менопаузальный переход – начало достаточно продолжительного отрезка времени, когда появляется уникальная возможность определить текущие и потенциальные проблемы со здоровьем и повысить мотивацию женщин к ведению здорового образа жизни, обеспечению общего благополучия на будущее в целях активного долголетия [13]. Чтобы соответствовать вызовам времени, врач в своей клинической работе должен опираться на текущие руководящие документы по ведению пациенток в переходном периоде, а также в пери- и в постменопаузе [3, 14–16].
Менопауза и ее влияние на качество жизни
Менопауза является естественным жизненным событием, однако биологические изменения, которые происходят в этот период, могут оказывать крайне негативное влияние на качество жизни и здоровье женщин [17]. Во время пери- и постменопаузального периодов разнообразные проявления эстрогенного дефицита (приливы и ночная потливость, изменения настроения, когнитивные нарушения и фрагментация сна) могут повлиять на физическое и психическое благополучие женщин, межличностные отношения и результативность в любой сфере деятельности. К тому же у 15% женщин в перименопаузе и до 80% женщин в постменопаузе отмечаются симптомы генитоуринарного менопаузального синдрома (ГУМС), у 41% женщин в возрасте 50–79 лет имеется хотя бы один из симптомов вульвовагинальной атрофии (ВВА) [16].
Несомненно, большинство симптомов менопаузы непосредственно связаны с дефицитом эстрогенов. Снижение уровня эстрогенов затрагивает практически все органы и системы организма женщины. ВМС чаще возникают в поздней фазе менопаузального перехода и особенно выражены в первые годы постменопаузы [16]. До 80% женщин среднего возраста в период менопаузального перехода и в ранней постменопаузе предъявляют жалобы на ВМС, значительно ухудшающие качество жизни.
Наряду с ВМС, гормональные изменения, сопутствующие заболевания, ожирение и психосоциальные факторы тесно связаны с нарушениями сна [18]. Распространенность нарушений сна у женщин в перименопаузе колеблется от 39 до 47%, у пациенток в постменопаузе – от 35 до 60% [16]. Нарушения сна относят к тяжелым симптомам, так как они оказывают комплексное негативное влияние на качество жизни, благополучие женщин, социальную активность и работоспособность, их своевременная коррекция является профилактикой метаболических и когнитивных расстройств в последующем.
В марте 2024 г. в специальном выпуске журнала Lancet были опубликованы несколько статей, авторы которых выступают за новый подход, выходящий «за рамки лечения конкретных симптомов и представляющий широкую модель поддержки женщин в этот сложный жизненный период» [19]. Авторы полагают, что «гендерный эйджизм» может только усилить негативный опыт менопаузы и призывают к снижению стигматизации этого периода жизни и большему признанию ценности и вклада женщин старшего возраста. Действительно, незначительные ВМС, нарушения сна, перепады настроения могут через некоторое время прекратиться самостоятельно и не потребовать лечения [3]. Трудность заключается в том, что невозможно предсказать заранее время уменьшения выраженности этих симптомов и не следует позволять женщинам страдать бесконечно без активного вмешательства. Менопаузальные симптомы у некоторых женщин могут длиться ≥10 лет, например, медианная продолжительность приливов в многоэтнической когорте женщин в ходе Study of Women’s Health Across the Nation (SWAN) составила 7 лет [20].
В многочисленных исследованиях было доказано, что выраженные ВМС могут коррелировать со следующими факторами риска [21]:
- артериальная гипертензия (АГ);
- инсулинорезистентность (ИР) и сахарный диабет 2 типа;
- дислипидемия;
- эндотелиальная дисфункция;
- вегетативная дисфункция (снижение вагусного контроля и повышение активности симпатической нервной системы);
- усиление провоспалительного и/или прокоагулянтного профилей;
- повышение важнейших маркеров субклинических ССЗ (например, толщины интимы-медии сонной артерии).
Следует учитывать, что каждая пациентка отличается индивидуальными потребностями при выборе лечения менопаузальных расстройств. Главная цель – предоставление женщинам достоверной, основанной на фактических данных информации для индивидуального выбора в пользу лечения, которое больше подходит в каждом конкретном клиническом случае, то есть персонифицированный подход является приоритетным.
Менопауза, метаболические и сердечно-сосудистые нарушения
По сравнению с поздним репродуктивным периодом, период менопаузального перехода сопровождается повышением таких метаболических факторов риска как висцеральное ожирение, атерогенная дислипидемия, нарушение регуляции гомеостаза глюкозы, развитие неалкогольной жировой болезни печени, а также АГ [22–24].
Получены многочисленные доказательства, подчеркивающие значимость менопаузального перехода, как «критического окна» для мониторинга здоровья женщин и внедрения стратегий раннего вмешательства в целях снижения риска ССЗ в будущем. Существует острая необходимость в повышении осведомленности клиницистов о сопровождающих переходный период неблагоприятных кардиометаболических изменениях у женщин [25, 26].
АГ представляет основной фактор риска ССЗ, одну из ведущих причин заболеваемости и смертности у женщин в постменопаузе. После наступления менопаузы заболеваемость АГ у женщин возрастает, достигая уровня, равного или превышающего таковой у мужчин [10]. Резкое уменьшение уровня эстрогенов в постменопаузе сопровождается изменением сосудистой функции, в том числе, снижением эндотелий-зависимой вазодилятации. После наступления менопаузы значимое снижение уровня эстрогенов частично объясняет, почему уровень артериального давления (АД) и риск АГ увеличиваются. Также в связи с резким снижением уровня прогестерона (природный антагонист альдостерона, способствующий активации ренин-ангиотензин-альдостероновой системы (РААС) и связанной с этим задержке натрия и воды в сосудистом русле и выведению калия) происходит реактивация РААС с такими последствиями, как задержка жидкости, повышение АД [10].
Важно отметить, что обусловленная активацией РААС задержка жидкости при использовании эстрогенов в составе комбинированных оральных контрацептивов и МГТ может быть основной причиной «ложной» прибавки массы тела, обусловленной водным, а не жировым компонентом [27, 28].
Активация минералокортикоидных рецепторов в кардиомиоцитах и в сосудистой стенке в постменопаузальном периоде также вызывает функциональные и морфологические изменения, которые приводят к формированию эндотелиальной дисфункции [29].
Резкое повышение АД при увеличении потребления соли, известное как чувствительность к соли, является независимым фактором риска увеличения ССЗ и смертности. Было доказано, что женщины в постменопаузе более чувствительны к соли, чем в репродуктивном возрасте. В частности, исследование, проведенное у женщин в постменопаузе, показало, что снижение уровня половых гормонов и повышенная чувствительность к натрию являются важными факторами в развитии гипертензии в постменопаузе [30]. Подавление реактивации системы РААС в ранней постменопаузе при назначении комбинированной МГТ, обуславливающей сохранение протективного действия прогестерона (благодаря антиминералокортикоидному действию), представляет собой важный механизм увеличения экскреции натрия.
Установлено, что прогестерон участвует в регуляции выработки натрия почками и регуляции АД, модулируя активность и выработку оксида азота и ангиотензина II. Помимо возможных изменений в хорошо известных классических системах, регулирующих АД и чувствительность к соли (например, вазопрессин, натрийуретические пептиды, пептид, связанный с геном кальцитонина и т.д.), предполагается, что повышение чувствительности к соли после наступления менопаузы также может быть вызвано усиленной активацией минералокортикоидной системы. Следовательно, эти механизмы могут способствовать развитию гипертонии и других метаболических осложнений, включая нарушения дифференцировки и функции жировой ткани [10].
В отличие от быстрого снижения уровней эстрадиола и прогестерона, уровень циркулирующего тестостерона снижается более плавно, вследствие постепенного снижения секреции как надпочечниками, так и яичниками. Выработка тестостерона яичниками снижается линейно с возрастом; в ряде исследований показано, что факт наступления менопаузы напрямую не влияет на его уровень. Установлено, что тека-клетки яичников в постменопаузе продолжают вырабатывать тестостерон в ответ на повышение уровня гонадотропинов [31, 32].
У женщин в постменопаузе большая часть активных андрогенов синтезируется в периферических тканях из дегидроэпиандростерона (ДГЭА) внутри клетки. Прекращение выработки тестостерона тека-клетками яичников компенсируется усилением выработки тестостерона клетками стромы. Следовательно, выработка андрогенов яичниками существенно не меняется в постменопаузе. В то же время уровень глобулина, связывающего половые стероиды, снижается из-за уменьшения выработки эстрогенов яичниками, при этом индекс свободных андрогенов увеличивается. Так происходит физиологический сдвиг от доминирования эстрогенов к относительному преобладанию андрогенов во время менопаузального периода [31–33].
На фоне снижения уровней эстрогенов у некоторых женщин возможно развитие абдоминального ожирения и повышение рисков метаболических нарушений, сердечно-сосудистых осложнений, а также относительной гиперандрогении, которая сопровождается появлением андрогензависимой дерматопатии (поздних акне, алопеции, гирсутизма) [16].
Относительная гиперандрогения в постменопаузе связана с неблагоприятными сердечно-сосудистыми последствиями, такими как эндотелиальная вазоконстрикция за счет уменьшения доступности оксида азота, что ведет к развитию АГ, кальцификации коронарных артерий [34–36].
Гиперандрогенные расстройства, независимо от причины, ассоциированы с метаболическими нарушениями, включая резистентность к инсулину, висцеральное ожирение. Доказан адипогенный эффект тестостерона и его связь с висцеральным ожирением. У женщин с гиперандрогенией существует повышенный риск развития сахарного диабета 2 типа и метаболического синдрома (МС) (т.е. совокупности абдоминального ожирения, дислипидемии, гипергликемии и АГ) [31, 36–38].
Так как висцеральная жировая ткань является инсулинорезистентной, она отличается более высокой скоростью липолиза, что приводит к увеличению циркулирующих свободных жирных кислот и последующему перераспределению их в печени, что, в конечном итоге, способствует печеночной инсулинорезистентности, которая отрицательно влияет на метаболическое здоровье всего организма [39].
Хотя роль жировой ткани как основного места преобразования стероидов хорошо известна, было обнаружено, что она способна инициировать стероидогенез de novo [40, 41].
Ключевым ферментом для синтеза эстрогенов является фермент ароматаза, активность которой зависит от локальной доступности ее субстратов-андрогенов. У женщин в постменопаузе висцеральная жировая ткань характеризуется более высокой их концентрацией по сравнению с подкожно-жировой клетчаткой [41].
Менопаузальный период связан с изменением формы тела от гиноидной к андроидной, с увеличением частоты абдоминального и висцерального ожирения. Сложная взаимосвязь между возрастом, ожирением и менопаузой является предметом нескольких текущих исследований, таких как SWAN и WHI, доказывающих связь ожирения и менопаузы [42, 43].
C наступлением менопаузы у женщин абдоминальное ожирение встречается в 5 раз чаще по сравнению с женщинами репродуктивного возраста, и для этого есть по крайней мере две причины, обусловленные резким изменением гормонального баланса: развитие относительной гиперандрогении и активация минералокортикоидных рецепторов. После обнаружения связи минералокортикоидных рецепторов с дифференциацией жировой ткани установлена потенциальная роль прогестерона и прогестинов с антиминералокортикоидными свойствами в контроле массы тела и пролиферации жировой ткани [10].
Сигнальные пути минералокортикоидных рецепторов также вовлечены в физиологические механизмы дифференцировки жировой ткани. Благодаря наличию минералокортикоидного эффекта в жировой ткани альдостерон активно участвует в процессах формирования жировой ткани (преобразовании преадипоцитов в зрелые адипоциты), что может явиться одной из причин развития абдоминального/висцерального ожирения уже в пери- и в ранней постменопаузе и, наоборот, блокада этих рецепторов на фоне применения МГТ с дроспиреноном препятствует развитию жировой ткани [44].
Увеличение центрального/висцерального жира и уменьшение мышечной массы более выражены в постменопаузе. Наличие висцерального ожирения связано с повышенным риском смертности даже среди лиц с индексом массы тела (ИМТ) в пределах референсных значений [25, 44]. Установлено, что абдоминальное и висцеральное ожирение в постменопаузе не только увеличивают кардиометаболический риск и смертность, но и связаны с увеличением риска развития 13 видов различных онкологических заболеваний у женщин [37, 45, 46].
Как уже отмечалось ранее, во время менопаузального перехода снижение уровня эстрогенов и изменение соотношения уровня тестостерона к содержанию эстрогенов напрямую коррелирует с развитием МС [33]. Во многих исследованиях частота МС у женщин в постменопаузе примерно в 3 раза выше, чем в репродуктивном возрасте. Повышение распространенности МС может быть связано с появлением его ключевого признака – абдоминального ожирения, наряду с дополнительными компонентами (ИР, гипертриглицеридемия, снижение содержания липопротеинов высокой плотности холестерина и АГ) [47, 48].
Актуальность проблемы МС у женщин в постменопаузе высока, поскольку во многих исследованиях показано повышение вероятности развития сахарного диабета 2 типа, ССЗ и инсульта у таких пациенток. Получены данные, свидетельствующие о взаимосвязи между менопаузой и повышением риска диабета 2 типа, который является более значимым фактором риска сердечно-сосудистой смертности у женщин, чем у мужчин [25, 49]. Учитывая повышение заболеваемости и смертности у женщин, ассоциированных с МС, необходимо регулярно проводить диагностику этого симптомокомплекса для предотвращения негативных последствий.
Наиболее распространенные менопаузальные расстройства и факторы риска хронических заболеваний, хотя и зависят от многих генетических и эпигенетических факторов, в значительной степени определяются гормональными изменениями в пери- и в ранней постменопаузе. Наиболее эффективное решение для профилактики метаболических, ССЗ и других возраст-ассоциированных заболеваний – это выявление нарушений у женщин, начиная с периода менопаузального перехода и в ранней постменопаузе, что признается врачами различных специальностей [5]. В этой связи, при обращении пациентки в ранней постменопаузе, гинеколог должен решить следующие задачи:
- обсудить возможности долгосрочной профилактики связанных с возрастом заболеваний и сохранения здоровья в постменопаузе;
- обеспечить пациентке доступ к основанной на доказательствах информации;
- обеспечить совместное принятие решений;
- предложить персонализированные варианты использования МГТ, признанной наиболее эффективным методом лечения менопаузальных расстройств, коррелирующих с повышением кардиометаболических рисков [50].
Возможности менопаузальной гормональной терапии для коррекции менопаузальных нарушений
Согласно текущим рекомендациям, МГТ – самое эффективное и к тому же безопасное лечение ВМС и других менопаузальных симптомов, если она впервые назначается у женщин в окно «терапевтических возможностей» (в возрасте <60 лет или с длительностью постменопаузы ≤10 лет), у пациенток, не имеющих противопоказаний [3, 14, 16, 51, 52]. За последние годы накоплены многочисленные доказательства того, что МГТ может оказывать профилактические эффекты в отношении ряда хронических кардиометаболических заболеваний, хотя это не входит в число одобренных показаний, а также улучшает качество жизни женщин в долгосрочной перспективе. В совместном документе кардиологов и акушеров-гинекологов говорится, что решение в пользу назначения МГТ может оказать положительное пожизненное влияние на здоровье женщин [53].
Опубликовав в 2024 г. Белую книгу, эксперты Международного общества по менопаузе (IMS) представили текущее видение проблем менопаузы, в том числе обновленную сбалансированную информацию о МГТ [3]. В первую очередь четко указывается, что МГТ остается научно обоснованным вариантом лечения первой линии для женщин с менопаузальными симптомами [3, 14, 16, 51, 52]. Среди пяти принципов использования МГТ (для кого она предназначена; когда следует начинать и прекращать лечение; почему эта терапия важна; где можно получить к ней доступ) для клинициста большой интерес представляет принцип учета различных эффектов терапии в зависимости от состава (типа эстрогенного компонента и прогестагена), дозы и пути введения, что напрямую влияет на получение максимальных преимуществ и минимизацию рисков при применении отдельных препаратов [3].
Преимущества МГТ с дроспиреноном для сохранения качества жизни и здорового долголетия
Препараты комбинированной МГТ состоят из двух частей: эстрогенного и гестагенного компонентов, каждый из которых играет важную роль. Эстрогенный компонент в препаратах пероральной МГТ, представленных в РФ, идентичен 17β-эстрадиолу (Е2), эффективно устраняет симптомы дефицита эстрогенов. Прогестаген традиционно выполняет «базовую» функцию – защиту эндометрия от пролиферативного влияния эстрогенов, однако некоторые прогестины имеют дополнительные свойства, которые могут оказывать положительное влияние на сохранение метаболического и сердечно-сосудистого здоровья женщин.
Все прогестагены связываются с прогестероновыми рецепторами и оказывают ожидаемый эффект на эндометрий, но некоторые из них имеют свой профиль активности в других тканях-мишенях, который может быть уникален в зависимости от гестагенного компонента. За последние десятилетия были разработаны новые прогестины, обладающие дополнительными положительными эффектами, такие как антиандрогенный и антиминералокортикоидный эффекты дроспиренона (таблица).
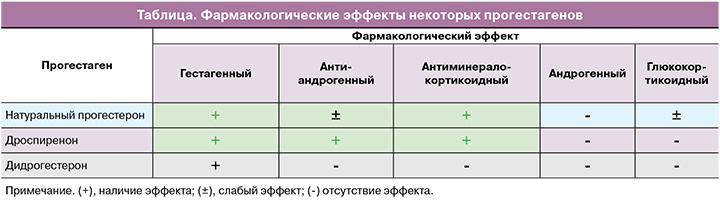
При сравнении гестагенов в составе МГТ, зарегистрированных в РФ, дроспиренон по фармакологическим эффектам наиболее близок к натуральному прогестерону, при этом является метаболически нейтральным, так как не имеет остаточной андрогенной и глюкокортикоидной активности [10, 16, 54].
Дроспиренон – гестаген 4-го поколения, 6β,7β,15β,16β-диметилен-3-оксо-17α-прегн-4-ен-21,17-карболактон является производным 17α-спиронолактона. Подобная биохимическая структура наделяет его уникальными свойствами, поскольку спиронолактон служит мощным антагонистом альдостероновых рецепторов. Сродство дроспиренона к минералокортикоидным рецепторам примерно в 5 раз выше, чем у альдостерона. Известно, что антиминералокортикоидная активность дроспиренона превышает таковую у спиронолактона в 8 раз. К тому же он обладает антиандрогенным воздействием, составляющим примерно 30% от активности ципротерона ацетата – наиболее мощного антиандрогенного прогестина [28, 55–57].
Дроспиренон, как и натуральный прогестерон, оказывает антиандрогенное действие за счет конкурентного связывания с рецепторами к андрогенам, а также косвенно за счет некоторого влияния на снижение выработки андрогенов яичниками и надпочечниками [57].
Комбинация антиминералокортикоидного и антиандрогенного эффектов в составе МГТ с дроспиреноном определяет его благоприятные метаболические свойства, что представляется особенно значимым у женщин в ранней постменопаузе [58].
Вазомоторные симптомы
В целом наличие ВМС в постменопаузе ассоциировано с повышением рисков развития ряда сердечно-сосудистых и метаболических нарушений. Женщины, испытывающие приливы в сочетании с другими симптомами, в том числе психоэмоциональными, подвергаются большему риску развития ССЗ в постменопаузе [59–63].
Как для каждой пациентки, так и для практического врача принципиально важной является информация о том, как быстро наступит терапевтический эффект в устранении приливов жара, ассоциированных с гипоэстрогенемией. На основании клинических исследований установлено, что прием низкой дозы 17-β-эстрадиола 1 мг в составе МГТ с дроспиреноном быстро восполняет дефицит эстрогенов, уже к 3-й неделе отмечается значимое снижение количества и выраженности приливов – на 90% по сравнению с плацебо [64]. При использовании ультранизкодозированного 17-β-эстрадиола (0,5 мг) в составе МГТ с дроспиреноном выраженный клинический эффект отмечается через 12 недель применения [65].
Нарушения сна
В настоящее время доказана связь дефицита эстрогенов с нарушениями сна и психоэмоциональными нарушениями. Наиболее типичная жалоба пациенток с нарушениями сна – частые пробуждения (или фрагментация сна), довольно распространены бессонница, трудности засыпания и ранние пробуждения. Нередко нарушения сна сочетаются с ВМС, а также с повышенной тревожностью и лабильностью настроения.
В исследовании значительное снижение числа и длительности приливов при приеме МГТ с дроспиреноном у пациенток в ранней постменопаузе улучшало качество и продолжительность сна, также было отмечено положительное влияние на психоэмоциональное состояние [64].
Симптомы ГУМС
Ввиду того, что системная МГТ с дроспиреноном может быть эффективна при проявлениях ГУМС в 75% случаев, целесообразно начинать лечение с нее, если у пациенток проявления ГУМС сочетаются с ВМС или существует необходимость в профилактике остеопороза (при наличии факторов риска).
На фоне приема системной МГТ зафиксированы увеличение поверхностных клеток влагалища, снижение рН влагалища и отмечена эффективность в лечении ВВА. Системная МГТ может обеспечить лечение ВВА, способствуя исчезновению сексуальных проблем за счет увеличения смазки, циркуляции крови, а также чувствительности тканей влагалища [14].
Отмечено, что прием МГТ с дроспиреноном не только способствует уменьшению сухости во влагалище, но и снижению выраженности никтурии (преобладание ночного диуреза над дневным). Установлено, что прием МГТ с дроспиреноном способствует улучшению показателей сексуальной функции у женщин в постменопаузе за счет улучшения показателей вагинального здоровья через 6 месяцев терапии [66].
Профилактика остеопороза
В постменопаузе у женщин происходит снижение минеральной плотности костной ткани, обусловленное дефицитом эстрогенов, что приводит к развитию остеопении и остеопороза. МГТ является эффективным методом предотвращения потери кости, которая начинается за 1–2 года до последней менструации и наиболее выражена в первые 3–5 лет постменопаузы, а также способствует сохранению качества кости и межпозвонковых дисков у женщин в постменопаузе. Назначение МГТ для профилактики остеопороза показано женщинам в перименопаузе, а также женщинам в постменопаузе моложе 60 лет и с длительностью менопаузы до 10 лет [16, 67].
МГТ с дроспиреноном имеет зарегистрированное показание к применению: «профилактика остеопороза у женщин в постменопаузе с высоким риском переломов, при непереносимости или противопоказании к применению других лекарственных препаратов для профилактики остеопороза» [68].
Дополнительные эффекты МГТ с дроспиреноном
Задержка жидкости
Известно, что дроспиренон уменьшает задержку жидкости и натрия, возникающую под влиянием эстрогенного компонента препарата, следовательно, снижает выраженность симптомов, связанных с этими процессами. Пациентки, которые в рамках клинического исследования получали 1 мг Е2/2 мг дроспиренона, реже отмечали периферические отеки, чем женщины, принимавшие только эстрадиол [68]. Эти свойства препарата особенно важны для женщин, которые беспокоятся о возможном увеличении веса на фоне приема МГТ, связанным с водным компонентом, что может снижать приверженность к терапии.
Артериальное давление и положительное влияние на сердечно-сосудистые риски
Антигипертензивное действие МГТ с дроспиреноном наиболее выражено у женщин с повышенным АД («мягкой гипертензией»). После 8 недель терапии у пациенток с повышенным АД показатели систолического/диастолического АД заметно снизились (на 12 и 9 мм рт. ст. соответственно по сравнению с исходными показателями по сравнению с плацебо – на 3 и 4 мм рт. ст). Однако следует помнить, что МГТ с дроспиреноном не рассматривается в качестве альтернативы при наличии у пациентки АГ и показаний для назначения базовой антигипертензивной терапии. Важно отметить, что у женщин с нормальным и пониженным АД на фоне приема МГТ с дроспиреноном не наблюдается снижения АД [68].
В крупном сравнительном исследовании реальной клинической практики EURAS-HRT (более 30 000 женщин) прием МГТ с дроспиреноном был ассоциирован с низкой частотой начала антигипертензивной терапии в сравнении с другой МГТ, таким образом были продемонстрированы профилактические возможности, благодаря антиминералокортикоидному действию дроспиренона [69]. Ранний старт МГТ имеет ключевое значение в профилактике заболеваний, ассоциированных с менопаузой.
Данное исследование подтвердило, что своевременно начатая и правильно подобранная МГТ может оказывать благоприятное влияние на показатели АД и снижать риски формирования ССЗ у женщин в постменопаузе. Так, в исследовании EURAS-HRT риск венозных тромбоэмболических осложнений на фоне приема МГТ с дроспиреноном был сопоставим, а риск серьезных артериальных тромбоэмболических событий (главным образом острого инфаркта миокарда и ишемического инсульта) был достоверно ниже, чем при приеме другой МГТ [69].
Это доказывает положительное воздействие МГТ с дроспиреноном на сохранение сердечно-сосудистого здоровья и напрямую влияет на качество и продолжительность жизни пациенток.
Контроль массы и композиционного состава тела
Согласно статистическим данным, в 2024 г. больше четверти россиян страдают ожирением [70]. В России за последние пять лет доля людей с избыточным весом выросла и составила 62,5% (на 2023 г.). В сочетании с глобальной эпидемией ожирения и старения населения назревает «метаболический шторм» [71]. Известно, что у женщин с повышенной массой тела и ожирением более выражены симптомы, связанные с менопаузой. Показатель интенсивности приливов прогрессивно повышался с увеличением массы тела и был наиболее высоким у женщин с ИМТ <25 кг/м2. Висцеральное ожирение связано с апноэ во сне и другими нарушениями сна в постменопаузе [72].
Вопреки распространенному мнению о том, что прием МГТ может быть ассоциирован с увеличением массы тела, на фоне применения МГТ с дроспиреноном в исследовании было отмечено снижение средней массы тела пациенток в постменопаузе в течение 12 месяцев лечения на 1,1–1,2 кг, тогда как у пациенток, получающих монотерапию эстрадиолом, отмечалось увеличение массы тела на 0,5 кг [68].
В рандомизированном, двойном, слепом, плацебо-контролируемом исследовании с участием 240 пациенток в постменопаузе в течение 2 лет наблюдения было отмечено статистически значимое уменьшение массы тела при применении комбинации 1 мг эстрадиола в сочетании с 2 мг дроспиренона. На основании результатов двухэнергетической рентгеновской абсорбциометрии зарегистрировано достоверное снижение соотношения центральной жировой массы к периферической жировой массе. По мнению исследователей, терапия МГТ с дроспиреноном, благодаря сочетанию антиминералокортикоидного и антиандрогенного эффектов, способствует снижению массы тела преимущественно за счет уменьшения висцерального жира, что помогает поддержанию композиционного состава тела в постменопаузе; эти эффекты также могут быть полезны с точки зрения противодействия атерогенным тенденциям и связанному с ними сердечно-сосудистому риску [73].
В проспективном исследовании с участием 172 женщин применение комбинации 1 мг эстрадиола/2 мг дроспиренона было ассоциировано с благоприятным влиянием на основные параметры углеводного и липидного обмена у женщин в ранней постменопаузе. На фоне терапии продемонстрировано достоверное снижение веса через 6 месяцев от начала приема (с 74,5 до 72,7 кг), а также статистически значимое снижение ИМТ (c 27,4 до 26,7 кг/м2), уменьшение окружности талии (с 90,2 до 88,51 см) и уровня триглицеридов (с 200 до 148 мг/дл), снижение как уровня гликемии натощак, так и показателей HOMA-IR (с 3,55 до 3,31) и MAGE (с 51 до 44).
При исследовании гормонального профиля после 6 месяцев применения МГТ с дроспиреноном уровень эстрадиола повысился, в то время как уровень свободного тестостерона снизился, при этом оставаясь в пределах физиологических значений (с 0,33 до 0,26 нг/мл). Согласно заключению авторов, на основании полученных результатов были продемонстрированы новые доказательства того, что МГТ с дроспиреноном у женщин в ранней постменопаузе улучшает показатели углеводного обмена, а также вызывает благоприятные изменения в липидном профиле и снижение в плазме уровней С-реактивного белка, ингибитора активации плазминогена 1 типа, интерлейкина 6, фактора некроза опухоли α [74].
Таким образом, использование комбинации эстрадиол/дроспиренон может обеспечить дополнительные преимущества для сохранения здоровья и высокого качества жизни женщин в постменопаузе:
- коррекция симптомов, связанных с дефицитом эстрогенов;
- сохранение защитного действия прогестерона вследствие наличия антиминералокортикоидного эффекта (поддержание стабильной массы тела и композиционного состава тела, нормального АД и уменьшение симптомов, связанных с задержкой жидкости);
- нормализация андрогенного статуса за счет коррекции относительной гиперандрогении в ранней постменопаузе позволяет предотвратить развитие метаболических и сердечно-сосудистых нарушений, что оказывает положительное влияние на сохранение здоровья и качества жизни женщин в постменопаузе.
Из согласительного документа «Российские критерии приемлемости назначения менопаузальной гормональной терапии пациенткам с сердечно-сосудистыми и метаболическими заболеваниями» следует, что МГТ в настоящее время не назначается с целью первичной и вторичной профилактики ССЗ. Несомненно, профилактика ССЗ не может служить основным показанием для назначения МГТ [10].
В то же время известно, что МГТ, назначенная женщинам в ранней постменопаузе, снижает риск развития ишемической болезни сердца на 32%, а также субклинического атеросклероза, и в целом может иметь кардиопротективный эффект [5, 33, 75, 76].
Согласно результатам многочисленных исследований установлено, что при использовании МГТ заболеваемость сахарным диабетом 2 типа может снижаться на 30% [10].
Таким образом, назначение МГТ с дроспиреноном в ранней постменопаузе (Анжелик) и продолжение ультранизкодозированной терапии в поздней постменопаузе (Анжелик Микро) могут быть фундаментом для сохранения здоровья и качества жизни женщин на длительный период, то есть способствовать реализации национальной стратегии активного и здорового долголетия.
Заключение
Назначение гормономодулирующей терапии, в том числе и МГТ, полностью соответствует принципам «5 П современной медицины». Первое П – предикция (выявление факторов риска) является принципиально важным этапом перед назначением МГТ. Второе «П» – превенция. С учетом факторов риска разрабатывается профилактика: несомненно, предотвращение любого заболевания – значительно более эффективный подход, чем его лечение. Менопаузальный переход можно считать ознаменованием начала второй половины жизни, когда появляется возможность пересмотреть образ жизни, признать текущие и потенциальные проблемы со здоровьем и мотивировать женщину к активному обеспечению ее благополучия (в том числе сердечно-сосудистого и метаболического) в будущем. Целостный подход в этот ключевой момент в жизни женщины включает первичную профилактику хронических возраст-ассоциированных заболеваний посредством модификации образа жизни и питания, регулярных физически нагрузок, отказа от курения, поддержания социальной активности и психического благополучия и, конечно, своевременное назначение МГТ.
Третье «П» – персонификация, персонализация. Выбор терапии менопаузальных расстройств зависит от симптомов, предпочтений пациентки и факторов риска. Согласно клиническим рекомендациям «Менопауза и климактерическое состояние у женщин» (2024), цель МГТ у женщин в перименопаузе и постменопаузе – частично восполнить дефицит половых гормонов, используя минимальные (оптимальные) дозы гормональных препаратов, способные улучшить общее состояние пациенток, купировать климактерические симптомы, обеспечить профилактику поздних обменных нарушений. При наличии других клинических симптомов, возникших на фоне дефицита эстрогенов (включая артралгии, мышечные боли, снижение памяти, нарушения сна и психоэмоциональные нарушения), существенно снижающих качество жизни, возможно назначение МГТ после дообследовании у профильных специалистов и исключения других причин для данных симптомов. Следует помнить, что назначение, коррекция или отмена МГТ, а также динамический контроль за эффективностью и переносимостью лечения, находятся в зоне ответственности врача акушера-гинеколога.
Классическим представлением является целесообразность снижения дозы как эстрогенного компонента, биоидентичного натуральному, так и прогестагенного, в составе МГТ по мере увеличения длительности постменопаузы. Это полностью соответствует составу компонентов МГТ, входящих в низкодозированный препарат с дроспиреноном для ранней постменопаузы, так и для ультранизкодозированной МГТ с дроспиреноном в поздней постменопаузе. Четвертое «П» – парситипативность – мотивированное участие пациентки в процессе профилактики заболеваний и лечения. Необходим новый стиль взаимоотношений врач – пациентка, при котором врач становится советчиком, а пациентка должна взять ответственность за свое собственное здоровье. Пациентка, имеющая полную информацию о показаниях к назначению МГТ и о дополнительных положительных эффектах в ее конкретном случае, необходимости ежегодного мониторинга ее состояния и эффекта лечения, будет более привержена к приему МГТ. И наконец, пятое «П» – позитивный настрой как со стороны лечащего врача, так и пациентки.



