Решение вопроса о целесообразности назначения менопаузальной гормональной терапии (МГТ) женщинам после перенесенного рака шейки матки (РШМ), находящимся в стойкой ремиссии, представляет сложную и противоречивую проблему. Ряд немногочисленных исследований предоставил информацию о том, что пациентки, принимающие МГТ в зависимости от гистологических вариантов РШМ, имеют различный риск развития рецидива, прогрессирования, а также показатели 5-летней выживаемости [1]. При назначении МГТ должны быть оценены соответствующие риски и польза для каждой женщины с учетом диагноза, степени распространенности опухолевого процесса, объема проведенного лечения.
Риски и преимущества МГТ
В настоящее время сохранению качества жизни женщины уделяется пристальное внимание. Коррекция гормональных изменений при эстрогендефицитных состояниях является патогенетически обоснованной и с доказанной эффективностью разнонаправленно профилактирует развитие ряда заболеваний у женщин с естественной или индуцированной менопаузой. Наиболее частыми показаниями для назначения МГТ являются вазомоторные симптомы с изменением настроения, нарушение сна, снижение качества жизни, связанное с климактерием, сексуальная дисфункция, профилактика потери минеральной плотности кости, профилактика и лечение генитоуринарного синдрома у женщин в возрасте моложе 60 лет. МГТ существенно улучшает качество жизни женщин и способствует нормализации психоэмоционального состояния. На сегодняшний день проведен ряд исследований, позволивших сформировать представления о возможных рисках МГТ. Согласно существующим клиническим рекомендациям, оценка соотношения польза/риск проводится индивидуально. Несмотря на то, что пероральная МГТ может способствовать повышению относительных рисков венозной тромбоэмболии, инсульта, абсолютные риски остаются низкими или крайне низкими, но и они должны оставаться в зоне повышенного внимания специалистов [2].
В качестве МГТ используются эстрогены, гестагены в виде монотерапии и их комбинаций, а также ткане-селективный модулятор эстрогенных рецепторов (STEAR) – тиболон. Для повышения эффективности и минимизации нежелательных явлений МГТ назначается по определенным принципам. Используются лишь «натуральные» эстрогены и их аналоги, которые метаболизируются в организме подобно эндогенным эстрогенам и обладают благоприятным профилем безопасности. Эстрогены назначают в минимально оптимальных дозах с учетом возраста женщины. Необходимо обязательно сочетать эстрогены с прогестагенами для защиты эндометрия от гиперпластических процессов у женщин с сохраненной маткой. Женщинам с удаленной маткой назначают монотерапию препаратами эстрогенов в непрерывном режиме. Возможность использования трансдермальных форм эстрогенов в виде накожных пластырей и гелей позволяет практически исключить риск развития венозной тромбоэмболии и назначать МГТ пациенткам с повышенными рисками (курящим, при наличии ожирения и др.). При преждевременной и ранней менопаузе рекомендуется проведение МГТ до возраста естественной менопаузы (50–51 года), в последующем длительность лечения определяется индивидуально. Для поддержания качества жизни, коррекции климактерических симптомов, профилактики поздних метаболических расстройств (остеопороза, ишемической болезни сердца, атеросклероза, болезни Альцгеймера и др.), профилактики и лечения генитоуринарного менопаузального синдрома МГТ должна быть длительной [3]. В настоящее время нет ограничений длительности использования МГТ. Всем пациенткам, получающим МГТ, показан ежегодный мониторинг эффективности лечения и оценка пользы/риска. Продолжительность терапии в каждом конкретном случае определяется индивидуально. Главный принцип ведения женщин, получающих МГТ – постепенное снижение дозы назначаемых препаратов по мере увеличения возраста пациентки. Сегодня в распоряжении врачей есть стандартные, низкие и ультранизкие дозы гормональных препаратов; пероральные, трансдермальные и вагинальные пути введения, что создает уникальные возможности персонифицированного подхода выбора терапии [4].
Информация данной статьи выходит за рамки решения стандартных проблем МГТ. Сохранение качества жизни и профилактика болезней старения на фоне эстрогендефицитного состояния у пациенток, перенесших радикальное лечение по поводу РШМ, является актуальной задачей современной онкогинекологии. Нередко это женщины репродуктивного возраста. Решение проблем реабилитации пациенток, успешно завершивших лечение РШМ, имеет колоссальное значение. Доказательная база в отношении пользы и рисков МГТ в ситуации индуцированной менопаузы при плоскоклеточных формах РШМ не изобилует данными. Не разработаны четкие клинические протоколы и рекомендации по реабилитации онкологических пациенток с искусственно вызванной менопаузой. Женщины недостаточно информированы относительно возможных последствий и осложнений, которые могут возникнуть на фоне или после лечения РШМ.
В данной статье будут представлены результаты немногочисленных исследований пациенток, больных РШМ в анамнезе, получавших МГТ.
МГТ и РШМ
РШМ остается в мире одним из самых распространенных онкологических заболеваний и занимает второе место в структуре онкологической заболеваемости женщин, уступая лишь раку молочной железы. В России в структуре онкологической заболеваемости женского населения РШМ в 2016 году составил 5,2%. Средний возраст впервые заболевших РШМ – 52,0 года. РШМ в 70–80% представлен плоскоклеточной карциномой, в 10–20 % – аденокарциномой, у 10% – низкодифференцированной формой опухоли. В возрастной группе 30–59 лет удельный вес РШМ достигает 5,8%. За последние 10 лет отмечается прирост стандартизированных показателей заболеваемости инвазивным РШМ на 23,9%, без тенденции к снижению показателей смертности. Ежегодный прирост инвазивных форм РШМ составляет 2,2%. Выявление РШМ в III–IV стадиях заболевания составляет около 35% случаев [5].
Основным этиологическим фактором развития цервикальной интраэпителиальной неплазии (CIN) и РШМ является вирус папилломы человека. CIN представляет собой морфологическую форму предопухолевого процесса и имеет различные степени выраженности. Онкогенные типы вируса папилломы человека ВПЧ 16/18 выявляются более чем у 80–90% больных CIN и РШМ. Диагноз РШМ устанавливается только на основании результатов гистологического исследования. Выбор метода лечения РШМ зависит от распространенности опухолевого процесса, факторов риска рецидива опухоли и тяжести сопутствующей соматической патологии [6].
При тяжелой дисплазии (CIN III), внутриэпителиальном РШМ (рак in situ) и микроинвазивной карциноме (стадия IA1 (инвазия ≤3 мм; горизонтальное распространение ≤7 мм) адекватным объемом хирургического вмешательства является конизация шейки матки с последующим выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки.
Расширение объема хирургического этапа лечения при IA1 стадии до простой (эксфолиативной) гистерэктомии с удалением яичников или без такового возможно при незаинтересованности больной в сохранении фертильности. В случаях лимфоваскулярной инвазии, а также при выявлении опухолевых клеток в краях резекции выполняется расширенная гистерэктомия (операция II или III типа по классификации Piver или Querleu-Morrow) Для РШМ IA2 стадии (инвазия >3 и ≤5 мм; горизонтальное распространение ≤7 мм) оптимальным объемом лечения принято считать модифицированную расширенную гистерэктомию (II тип по классификации Piver). При противопоказаниях к хирургическому лечению проводится лучевая терапия. В случаях необходимости сохранить фертильность у больных РШМ IA2 стадии FIGO возможно выполнить радикальную влагалищную или абдоминальную трахелэктомию с тазовой лимфаденэктомией лапаротомным или лапароскопическим доступом.
При большем распространении опухолевого процесса до IB1 и IIА1 стадии (опухоль <4 см) показана расширенная гистерэктомия (III тип по классификации Piver) или лучевая/химиолучевая терапия по радикальной программе. С целью сохранения фертильности возможно выполнение расширенной трахелэктомии (III тип). Тактику адъювантного лечения определяют значимые факторы риска прогрессирования опухолевого процесса. При невозможности проведения хирургического лечения по медицинским показаниям или по выбору пациентки возможно проведение лучевой/химиолучевой терапии по радикальной программе.
Для группы больных РШМ IB2и IIА2 стадии (опухоль >4 см) рассматриваются несколько вариантов лечения, такие как расширенная гистерэктомия (операция III типа) или химиолучевое лечение. Стандартом лечения больных РШМ IIВ–IVA стадии является проведение химиолучевого лечения. Даже при таком распространенном опухолевом процессе у молодых пациенток можно сохранить яичники, методикой транспозиции их из зоны облучения. Для больных IVВ стадии РШМ с отдаленными метастазами возможна системная платиносодержащая химиотерапия [7, 8].
Несмотря на то, что к щадящим хирургическим вмешательствам для женщин с нереализованной репродуктивной функцией можно отнести конизацию или ампутацию шейки матки, радикальную трахелэктомию с лимфаденэктомией или без нее, достаточно часто пациенткам, даже при ранних стадиях РШМ необоснованно расширяют объем хирургического вмешательства, выполняя расширенную гистерэктомию.
Необходимо помнить, что в ситуации только хирургического этапа лечения РШМ, яичники возможно сохранить без рисков большего прогрессирования опухолевого процесса. При запущенных стадиях заболевания пациентки подвергаются химио- и/или лучевой терапии, следствием чего может быть прекращение функции гонад. В случае проведения лучевой терапии на область малого таза целесообразно решить вопрос о выполнении транспозиции яичников во время хирургического этапа лечения или до планируемой лучевой и/или химиолучевой терапии выше области малого таза, что позволит сохранить их функцию. Мета-анализ (24 статьи, опубликованных в период с 1980 по 2013 г.) с участием женщин, больных РШМ продемонстрировал значимое сохранение функции яичников при выполнении их транспозиции [9].
На сегодняшний день не существует четких рекомендаций относительно того, какой конкретный препарат или какую схему МГТ могут использовать клиницисты у пациенток больных раком шейки матки. Тем не менее, возможность назначения МГТ у молодых женщин с преждевременной менопаузой должна быть рассмотрена в контексте коррекции вазомоторных нарушений, профилактики сердечно-сосудистых заболеваний и остеопороза.
Самые первые исследования, посвященные изучению эффективности и безопасности приема МГТ пациентками, имеющими РШМ в анамнезе, датируются 1987 годом.
Следует отметить, что в период пубертата пролиферативные изменения в ткани шейки матки находятся на пике активности за счет влияния половых гормонов. Кроме того, как нормальная, так и опухолевая ткань шейки матки продолжает экспрессировать рецепторы стероидных гормонов даже после наступления менопаузы. Однако на сегодняшний день не установлена взаимосвязь развития РШМ с половыми гормонами [10].
В ряде исследований было подтверждено протективное влияние МГТ на риск развития инвазивных форм РШМ [11].
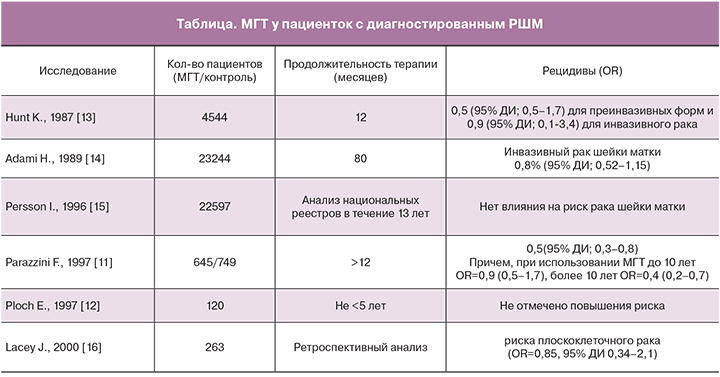
Е. Ploch в 1997 году опубликовал работу по исследованию 120 пациенток I и II стадий плоскоклеточного РШМ (по классификации FIGO), получавших МГТ. Проведенная терапия не изменила общую выживаемость в течение 5 последующих лет наблюдения, хотя важно отметить, что данный показатель был значительно хуже в группе пациенток, подвергшихся лучевой терапии вследствие ее осложнений, а не рецидива основного заболевания [12].
В исследовании K. Hunt для оценки долгосрочного использования МГТ был проведен перекрестный анализ пациенток (n=2964) в возрасте 45–64 года. Причем 1482 женщины принимали комбинированные формы МГТ (13 различных препаратов) более 12 месяцев (12–18 месяцев), а вторая половина была отнесена к группе контроля. В I группе (МГТ+) отмечалось снижение риска как преинвазивных, так и инвазивных форм плоскоклеточного РШМ в сравнении с контролем [13].
В популяционном исследовании H. Adami с участием 23 244 женщин, также получающих МГТ (средняя продолжительность приема 6,7 года) было отмечено незначительное снижение риска инвазивного РШМ (ОР – 0,8; 0,52–1,15) [14].
В 1996 году был проведен анализ национальных реестров, который включал 22 597 шведских женщин, с различной продолжительностью приема как монотерапии эстрогенами, так и комбинированных форм МГТ. В работе не было выявлено какого-либо влияния на риск развития РШМ [15].
Для изучения взаимосвязи использования МГТ с риском развития РШМ в Северной Италии было проведено исследование по типу «случай-контроль» (1981–1993 года) с участием 645 пациенток в возрасте 40–75 лет, имеющих в анамнезе РШМ и использующих МГТ. 749 женщин аналогичного возраста были отнесены к группе контроля. Результаты исследования позволили предположить, что МГТ не только не повышает риска РШМ, но и имеет протективный эффект при данном заболевании в случае длительного использования МГТ [11]. Результаты исследований риска рецидива плоскоклеточного РШМ на фоне использования МГТ представлены в таблице.
В последнее время отмечается тенденция к увеличению доли аденокарцином в структуре РШМ. Данный гистотип является эстроген-чувствительным. Поэтому назначение только эстрогенсодержащей МГТ ассоциировано с большим риском рецидива по сравнению с пациентками, получающими комбинированные формы МГТ. В исследовании случай-контроль среди пациенток с аденокарциномой шейки матки, принимавших МГТ, риск рецидива составил 2,1 (95% ДИ 0,95–4,6), для плоскоклеточного варианта – 0,85 (95% ДИ 0,34–2,1). Причем при монотерапии эстрогенами в случае аденокарциномы шейки матки риск рецидива достигал 2,7 (95% ДИ, 1,1–6,8) [16]. Хотя некоторые исследователи предполагают, что прогестины также могут способствовать развитию аденокарциномы шейки матки [17]. В случае наличия аденокарциномы шейки матки проведение МГТ не рекомендовано и женщинам следует назначать негормональное лечение для коррекции вазомоторных симптомов.
В ситуации, когда на фоне использования МГТ развилась плоскоклеточная форма РШМ отменять данную терапию нет необходимости. МГТ не увеличивает риски прогрессирования и рецидива заболевания в случае уже перенесенного плоскоклеточного РШМ в анамнезе и возникновения показаний к гормональной терапии спустя длительное время. Кроме того, если у пациентки на фоне лечения плоскоклеточного РШМ возникли климактерические симптомы, то противопоказаний к назначению МГТ в данный период нет. На основании Кохрановского обзора для пациенток, успешно завершивших лечение плоскоклеточного РШМ, МГТ следует считать безопасной (II–III уровень доказательности) [18].
Долгосрочные когортные исследования показали отсутствие повышения риска развития РШМ при применении МГТ (уровень доказательности <2++>, расшифровку см. ниже). Единственные относительно объективные данные, касающиеся применения МГТ у больных РШМ и предродовыми заболеваниями получены в двух рандомизированных плацебо-контролируемых исследованиях: WHI («Women’s Health Initiative») и исследовании влияния на сердце эстроген-прогестагенной заместительной терапии (Heart and Estrogen/progestin Replacement Study – HERS). <1+>. В исследовании WHI (группа комбинированной терапии) цитологические результаты оценивались в течение 6-летнего периода последующего наблюдения. При этом годовой показатель выявления цитологических отклонений был значимо выше в группе МГТ, чем в группе плацебо (ОШ 1,4; 95% ДИ 1,2–1,6), однако не было выявлено различий в частоте плоскоклеточных интраэпителиальных поражений высокой степени, которые были бы сравнимы с CIN II–III и РШМ. Статистически недостоверна более высокая частота выявления цитологических отклонений (ОШ 1,4; 95% ДИ 0,9–2,0) определена в исследовании HERS среди женщин группы МГТ, но, также как и в исследовании WHI, риск РШМ не был повышен. При этом наличие папилломавирусной инфекции не является противопоказанием для назначения МГТ. Тем не менее, цитологический контроль на фоне МГТ следует проводить согласно рекомендациям скрининга [3].
Любая связь между применением МГТ и аденокарциномой шейки матки остается неясной. В ретроспективном регистрационном исследовании, проведенном в Финляндии и изучавшем женщин в постменопаузе (n=243 857), которые в течение 5 лет принимали МГТ, было выявлено увеличение риска аденокарцином (СКЗ – стандартизованный коэффициент заболеваемости) 1,83; 95% ДИ 1,24–2,59), в то время как риск плоскоклеточной карциномы, наоборот, уменьшался (СКЗ 0,34; 95% ДИ 0,16–0,65)5. <2+> Необходимы дальнейшие исследования в этой области [19].
В клинических рекомендациях Британского общества по менопаузе (British Menopause Society & Women’s Health Concern) и Международного общества по Менопаузе (International Menopause Society) указано, что МГТ не противопоказана после лечения плоскоклеточного РШМ [3, 20].
Заключение
Большинство женщин, получающих хирургическое или комбинированное лечение плоскоклеточного РШМ, находятся в постменопаузе, однако доля пациенток репродуктивного возраста продолжает расти. Симптомы индуцированной менопаузы, как правило, более выражены, так как внезапное прекращение функции яичников сочетается с другими соматическими и психологическими проблемами, ассоциированными с диагностированным злокачественным заболеванием и проводимой терапией. Рост контингента больных плоскоклеточным РШМ связан с более ранним выявлением и эффективным лечением данного заболевания. Это означает, что внимание к качеству жизни и коррекции последствий долгосрочного дефицита эстрогенов не должны быть упущены. Спорность клинических ситуаций в определении риска и решение вопроса о возможности назначения МГТ после диагностирования и лечения плоскоклеточных форм РШМ основана на несовершенстве достаточной доказательной базы [21–24]. МГТ является наиболее эффективной терапией, предназначенной для купирования вазомоторных симптомов, обладающей протективным влиянием на сердечно-сосудистую систему и костную ткань.
В настоящее время слово «рак» не звучит как некий приговор. Современная онкология предоставляет широкие возможности профилактики, ранней диагностики и эффективного комбинированного лечения плоскоклеточной формы РШМ. Для многих женщин становится актуальным получение полноценной реабилитации после проведенного лечения плоскоклеточного РШМ с целью сохранения качества жизни. Мультидисциплинарный подход не только в лечении, но и на этапе реабилитации позволит значимо улучшить качество жизни больных плоскоклеточной формой РШМ. При любой стадии РШМ и проведении различных вариантов лечения (органосохраняющее или гистерэктомия или химиолучевая терапия) – назначение МГТ не увеличивает риски прогрессирования опухолевого процесса. Своевременное информирование пациентов о возможных последствиях и осложнениях тех или иных методов лечения плоскоклеточных форм РШМ, правильная подготовка, применение современных методов реабилитации будут способствовать значительному улучшению качества жизни этой категории пациенток.
Расшифровка уровней доказательства из текста:
<1+> – Корректно выполненные мета-анализы, систематические обзоры рандомизированных контролируемых исследований или рандомизированные контролируемые исследования с низким риском систематической ошибки.
<2+> – Корректно выполненные исследования по типу случай-контроль или когортные исследования с низким риском искажения, систематической ошибки или случайных результатов и средней вероятностью причинной взаимосвязи.
<2++> – Высококачественные систематические обзоры исследований по типу случай-контроль или когортных исследований или высококачественные исследования по типу случай-контроль или когортные исследования с очень низким риском искажения, систематической ошибки или случайных результатов и высокой вероятностью причинной взаимосвязи.



