Экстракорпоральное оплодотворение (ЭКО) – важная вспомогательная репродуктивная технология, помогающая парам с бесплодием, ежегодно такое лечение получают около 1,5 млн женщин во всем мире [1, 2]. Россия является страной, в которой активно используется ЭКО – согласно регистру Российской ассоциации репродукции человека, в 2014 году было проведено более 95 000 циклов в 133 клиниках [3].
Для устранения дефицита прогестерона в лютеиновую фазу, вызванного стимуляцией яичников при проведении ЭКО, осуществляется рутинная поддержка лютеиновой фазы в комбинации с аналогами гонадотропин-рилизинг гормона [4–6]. Прогестерон часто применяется для обеспечения поддержки лютеиновой фазы, а систематический обзор показал, что его применение было связано с улучшением показателей живорождения [7]. В настоящее время стандартом терапии для поддержки лютеиновой фазы при ЭКО является микронизированный вагинальный прогестерон (МВП) [8], однако интравагинальный метод введения может быть связан с такими побочными эффектами, как раздражение, выделения и кровотечение из влагалища [9]. Следовательно, существует потребность в эффективном альтернативном лечении с хорошей переносимостью.
Дидрогестерон (таблетки для приема внутрь по 10 мг) в клинической практике с 1960-х гг. и широко применяется во всем мире для лечения угрожающего и привычного выкидыша, а также для лечения бесплодия, обусловленного недостаточностью лютеиновой фазы [10]. В ряде небольших проспективных исследований по поддержке лютеиновой фазы при ЭКО показано, что пероральный дидрогестерон так же эффективен, как МВП, хорошо переносится, не имеет побочных эффектов МВП, связанных с путем введения, и характеризуется более высоким уровнем удовлетворенности пациенток лечением [7, 11–18].
Недавно были опубликованы результаты исследования Lotus I, крупного проспективного двойного слепого рандомизированного клинического исследования, в котором сравнивалась эффективность, безопасность и переносимость перорального дидрогестерона и МВП [19]. Было выявлено, что дидрогестерон как минимум не уступает МВП с точки зрения частоты беременности на 12-й неделе гестации (первичная цель исследования Lotus I). Более того, дидрогестерон хорошо переносился и имел схожий с МВП профиль безопасности [19]. В исследовании Lotus I приняла участие большая субпопуляция российских женщин (около 20% всей популяции), при этом их младенцы наблюдались еще в течение 6 месяцев после родов в рамках расширенного периода наблюдения для оценки безопасности. Здесь представлен анализ терапии дидрогестероном, а также дополнительные результаты по безопасности и переносимости, полученные при анализе всей популяции исследования Lotus I.
Материал и методы исследования
Ранее уже было представлено подробное описание исследования Lotus I [19]. Вкратце, Lotus I – многоцентровое рандомизированное контролируемое двойное слепое, с использованием двойной имитации, исследование III фазы, проводившееся в двух параллельных группах на базе 38 центров в Австрии, Бельгии, Финляндии, Германии, Израиле, России и Испании в период с августа 2013 г. по март 2016 г. В исследование включали женщин с ненаступившей менопаузой (от 18 до 42 лет, с индексом массы тела (ИМТ) от 18 до 30 кг/м2), с документально подтвержденным бесплодием в анамнезе, которым планировали процедуру ЭКО. Пациенток рандомизировали (с использованием метода двойной имитации) либо в группу приема перорального дидрогестерона в таблетках по 10 мг 3 р/сут и плацебо в форме вагинальных капсул 3 р/сут, либо МВП в капсулах по 200 мг 3 р/сут и плацебо в форме пероральных таблеток 3 р/сут. При получении положительного результата теста на беременность на 15-й день исследуемое лечение продолжалось до 12-й недели гестации (10-я неделя лечения). Период последующего наблюдения для оценки безопасности как для матери, так и для младенца составил 30 дней после родов, за исключением России, где был дополнительный период последующего наблюдения за младенцами в течение 6 месяцев с учетом регуляторных требований для данного исследования. Главная цель исследования состояла в том, чтобы продемонстрировать как минимум сопоставимую эффективность дидрогестерона с МВП для поддержки лютеиновой фазы в циклах ЭКО на основании наличия сердцебиений плода на 12-й неделе гестации. Дополнительные цели исследования включали частоту живорождений. Был проведен апостериорный анализ данных, включая данные по российской субпопуляции, а также анализ для выявления прогностических факторов. Также были получены данные по безопасности и переносимости путем регистрации нежелательных явлений, возникших во время лечения (НЯнФЛ), в том числе серьезных НЯнФЛ, а также оценивались данные физикального обследования.
Результаты исследования
Исследуемая популяция
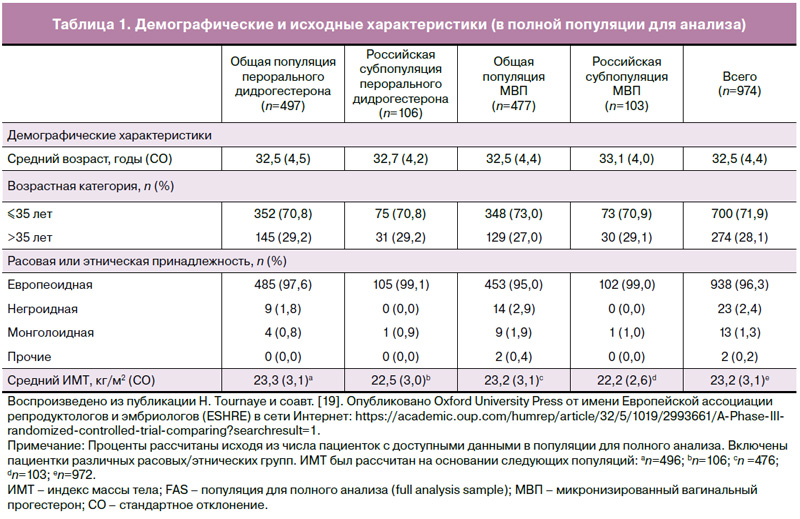
В общей сложности в исследовании Lotus I были скринированы 1143 пациентки, из которых 1031 была рандомизирована для проведения лечения (рис. 1) [19]. Всего 520 и 511 пациенток были распределены в группы дидрогестерона и МВП, при этом 497 и 477 пациенток вошли в популяцию для полного анализа (FAS), а 492 и 475 пациенток – в популяцию «анализа по протоколу» (PPS) соответственно [19]. Примерно 20% пациенток были включены в России (n=216), при этом по 108 пациенток были рандомизированы в группы дидрогестерона и МВП; 106 и 103 вошли в популяцию FAS, а 105 и 103 – в популяцию PPS соответственно. В общей сложности участие в исследовании завершили 30,5% (315/1031) пациенток в целом и 36,6% (79/216) в российской популяции соответственно. Схожая доля пациенток досрочно прекратила терапию в исследовании и в целом, и в российской популяции, при этом основной причиной досрочного прекращения участия в исследовании было неподтверждение наличия беременности на 4-й неделе гестации (48,2% [497/1031] и 45,4% [98/216] соответственно) [19]. Демографические и исходные характеристики в исследовании в целом и в российской популяции были схожими в обеих группах (табл. 1) [19].
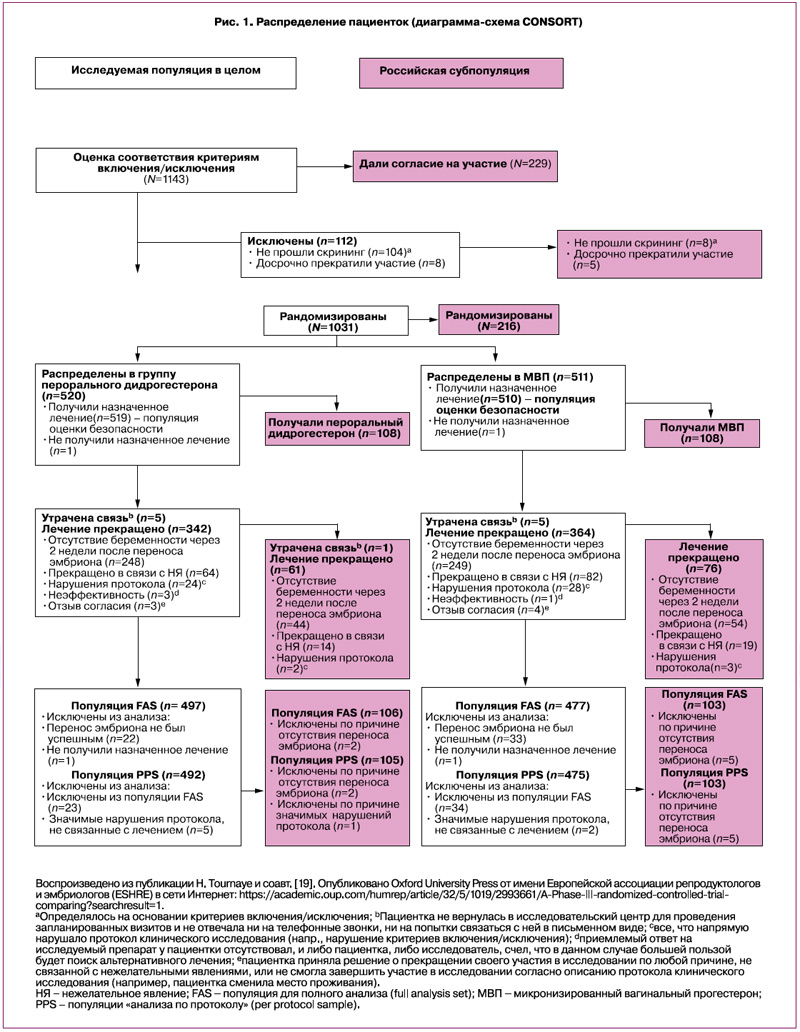
Эффективность
Исследуемая популяция в целом
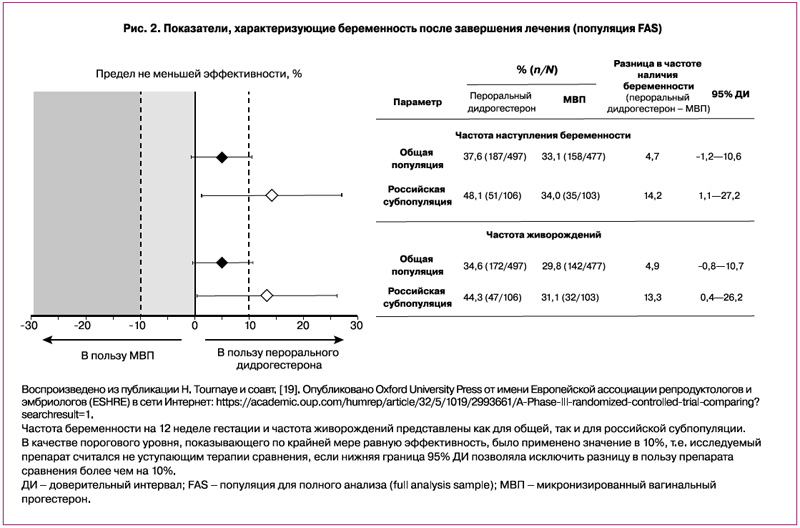
Главная цель исследования Lotus I была достигнута: дидрогестерон к 12-й неделе беременности продемонстрировал сопоставимую с МВП эффективность (рис. 2) [19]. В популяции FAS частота беременности на 12-й неделе гестации составила 37,6 и 33,1% в группе дидрогестерона и МВП соответственно (абсолютная разница, скорректированная для страны и возрастной группы, составила 4,7%; 95% доверительный интервал [ДИ] от –1,2 до 10,6%) [19]. Отношение шансов для дидрогестерона в сравнении с МВП на 12-й неделе гестации составило 1,24 (95% ДИ 0,95–1,62; логистическая регрессионная модель с лечением, страной и возрастной группой в качестве факторов не представлена в основной публикации по исследованию Lotus I). В популяции FAS частота живорождений составила 34,6 и 29,8% в группах дидрогестерона и МВП соответственно (абсолютная разница, скорректированная для страны и возрастной группы, составила 4,9%; 95% ДИ от –0,8 до 10,7%) [19]. Отношение шансов для дидрогестерона в сравнении с МВП для частоты живорождений составило 1,27 (95% ДИ 0,97–1,67%).
Эффективность лечения: субанализ российской популяции
Исследование эффектов лечения в зависимости от страны проводилось для частоты беременности к 12-й неделе гестации и для показателей живорождения. Что касается субанализа российской популяции, частота беременности к 12-й неделе гестации составила 48,1 и 34,0% в группе дидрогестерона и МВП соответственно (абсолютная разница, скорректированная для возрастной группы, составила 14,2%; 95% ДИ 1,1–27,2%; рис. 2). Более того, показатели живорождений среди российских пациенток составили 44,3 и 31,1% в группе дидрогестерона и МВП соответственно (скорректированная абсолютная разница 13,3%; 95% ДИ: 0,4–26,2%).
Влияние страны на частоту беременности к 12-й неделе гестации и частоту живорождений далее было оценено путем оценки взаимосвязи между страной и лечением с использованием логистической регрессионной модели (с возрастной группой в качестве дополнительного фактора, идущего после стратифицированной рандомизации в исследовании). Хотя данный анализ выявил значимое влияние страны (p=0,008), различия в эффекте лечения между странами не были значимыми (p=0,72). Ретроспективный статистический анализ с использованием логистического регрессионного анализа показал, что возраст, центр, день переноса эмбриона и проводимое лечение были значимыми прогностическими факторами для беременности на 12-й неделе гестации (p<0,05).
Течение и исходы лечения/беременности
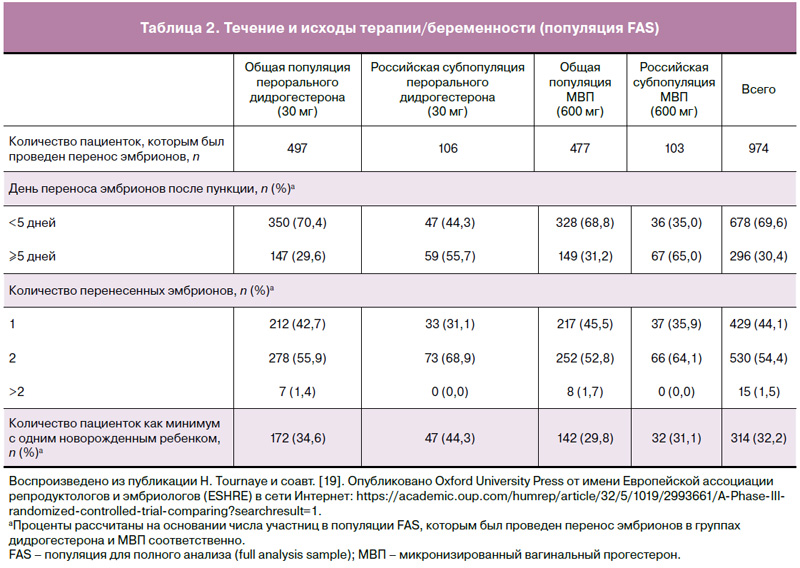
Установлено, что в российской популяции перенос эмбриона проводили в более поздний день после забора яйцеклеток как в группе дидрогестерона, так и в группе МВП, в сравнении с общей популяцией (табл. 2; ≥5 дней: 55,7 и 65% в сравнении с 29,6 и 31,2% соответственно). Кроме того, в российской популяции доля двойных переносов эмбрионов была большей как в группе дидрогестерона, так и в группе МВП, в сравнении с общей популяцией исследования (табл. 2; 68,9 и 64,1% в сравнении с 55,9 и 52,8% соответственно).
В целом было 15 потерь беременности в группе дидрогестерона и 16 – в группе МВП в период с 12-й недели гестации и до родов. Сообщалось о следующих причинах этих событий в группе дидрогестерона и МВП соответственно: выбывание пациентки из наблюдения (не задокументировано живорождение; 11 случаев в сравнении с 9 случаями), рекомендованное прерывание по причине врожденных аномалий (2 случая в сравнении с 3 случаями) и прерывание беременности на поздних сроках/внутриутробная гибель плода (2 случая в сравнении с 4 случаями).
Безопасность и переносимость
Обзор НЯнФЛ и серьезных НЯнФЛ
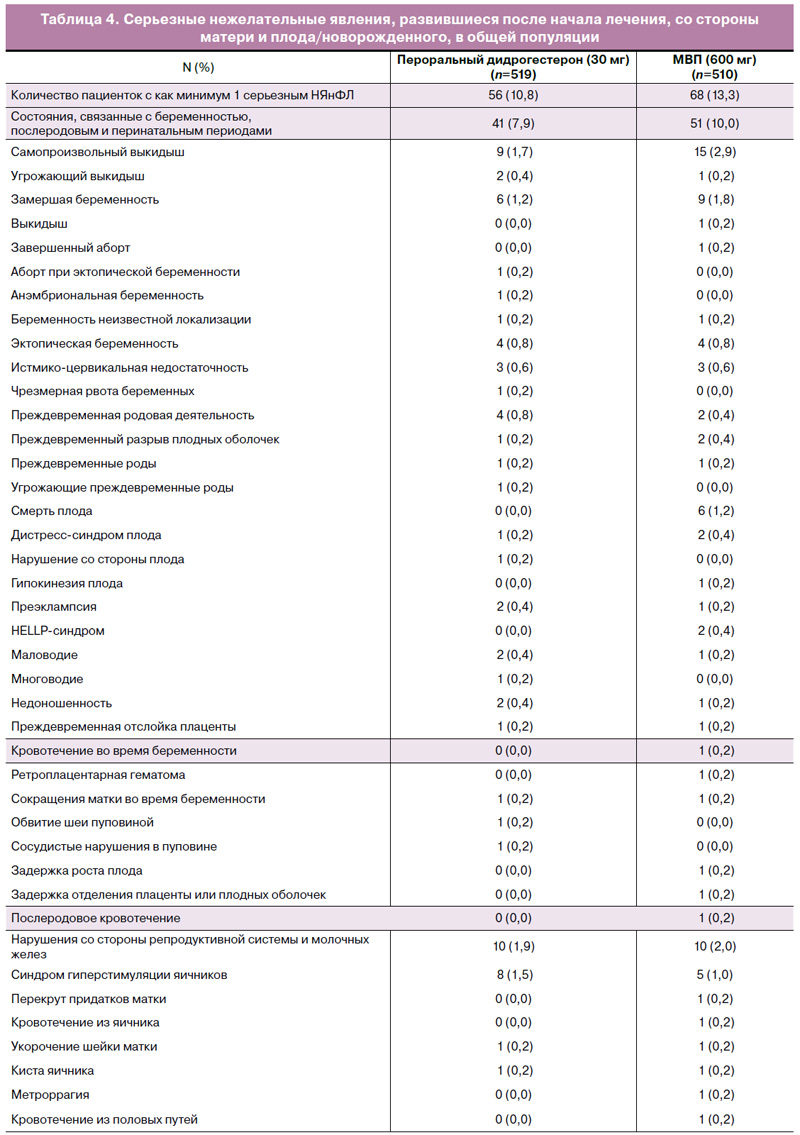
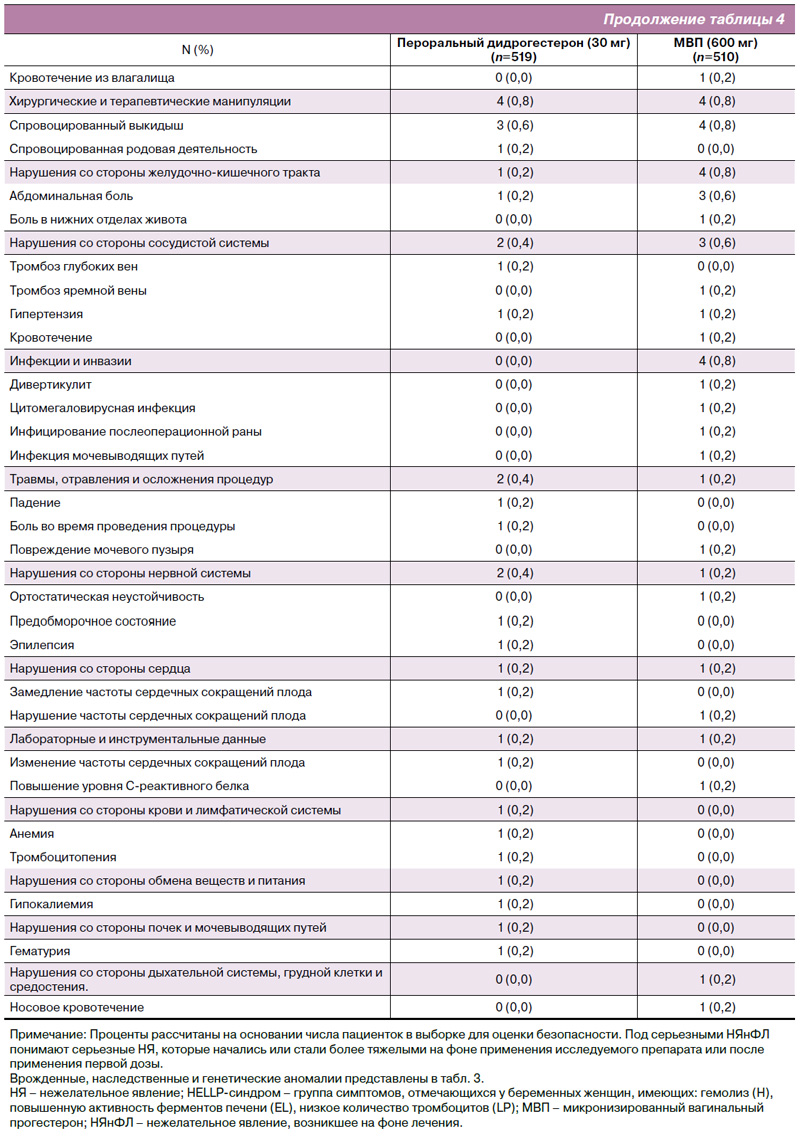
Нежелательные явления, развившиеся на фоне лечения, со стороны как матери, так и плода/новорожденного, были представлены для популяции исследования в целом [19]. Как и ожидалось, в этой популяции пациенток отмечалась хорошая переносимость дидрогестерона, что согласуется с известным профилем безопасности и переносимости данного препарата [19]. Доли пациенток, у которых развились серьезные НЯнФЛ, были схожими в группах дидрогестерона и МВП как в популяции исследования в целом (10,8 и 13,3% соответственно) [19], так и у российских пациенток (13,9 и 12,0% соответственно). НЯнФЛ, послужившие причиной прекращения участия в исследовании, также были схожими в группах дидрогестерона и МВП как в популяции исследования в целом (12,4 и 16,0% соответственно) [19], так и у российских пациенток (13,0 и 17,6% соответственно).
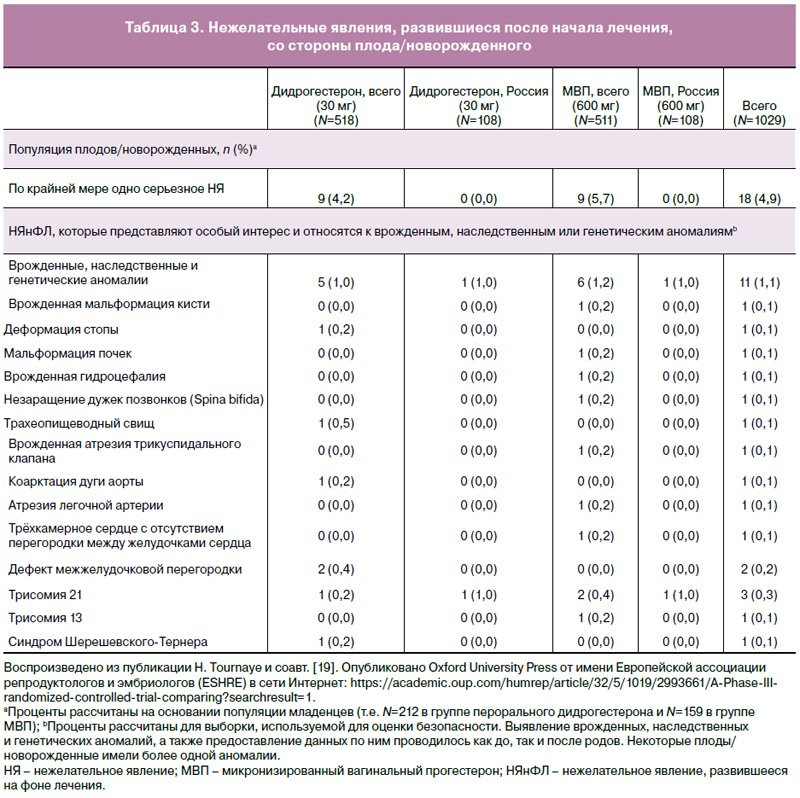
НЯнФЛ, представляющие особый интерес и связанные с врожденными, наследственными и генетическими нарушениями, развившиеся как в общей популяции, так и у российских пациенток, суммированы в табл. 3. Обзор серьезных НЯнФЛ со стороны матери и плода/новорожденного, возникших у пациенток в популяции исследования в целом, можно найти в табл. 4. Следует отметить, что явления кодировались как можно ближе к тому, о чем сообщалось исследователями, и у одной пациентки могло быть более одного серьезного НЯнФЛ в одно и то же время. Сообщалось о шести гибелях плода в группе МВП и ни об одном подобном случае в группе дидрогестерона. Все случаи смерти были связаны с потерей одного или обоих плодов при двуплодной беременности. Не сообщалось о случаях смерти матери ни в группе дидрогестерона, ни в группе МВП.
Единственным НЯнФЛ, представляющим особый интерес, о котором сообщалось не менее чем у 2% пациенток в группе дидрогестерона и группе МВП, был самопроизвольный выкидыш (2,3% в сравнении с 4,1%) и замершая беременность (2,5% в сравнении с 2,0%) [19]. Наиболее частым НЯнФЛ среди новорожденных была недоношенность – 7 случаев в группе дидрогестерона и 9 случаев в группе МВП [19]. Не все эти случаи были сообщены как серьезные. Было четыре НЯнФЛ, связанные с повышением активности ферментов печени на фоне терапии: 2 случая в группе дидрогестерона и 2 случая в группе МВП. Как и ожидалось, спонтанный выкидыш был основным НЯнФЛ, которое приводило к выбыванию из исследования, поскольку лечение в таких случаях прекращалось.
НЯнФЛ в зависимости от системно-органного класса
НЯнФЛ со стороны матери и плода/новорожденного были проанализированы согласно системно-органному классу и приведены в отчете для групп дидрогестерона и МВП следующим образом: нарушения со стороны репродуктивной системы и молочной железы (21,8 и 18,4%; при этом кровотечения из влагалища были наиболее частым НЯнФЛ в целом для обеих групп лечения – 11,6 и 9,2%); нарушения со стороны желудочно-кишечного тракта (19,1 и 17,2%); нарушения со стороны нервной системы (7,7 и 8,2%); нарушения со стороны сосудистой системы (в обеих группах 3,5%), включая периферическую эмболию и тромбоз (в обеих группах 0,2%) [19].
Данные по безопасности для младенцев
Данные по безопасности новорожденных, собранные во время родов, были схожи в группах дидрогестерона и МВП, при этом большинство младенцев родилось без каких-либо отклонений по данным физикального обследования (93,4 и 92,4% соответственно в популяции исследования в целом [19] и 100,0 и 97,1% соответственно в российской популяции). Количество плодов/новорожденных, у которых развилось как минимум одно серьезное НЯнФЛ, было сходным в обеих группах: 4,2% в группе дидрогестерона и 5,7% в группе МВП [19]. В общей сложности было 11 плодов/новорожденных с НЯнФЛ, связанными с врожденными, наследственными или генетическими нарушениями, при этом у некоторых было более одного состояния (5 в группе дидрогестерона и 6 в группе МВП; табл. 3) [19]. В российской популяции было два плода с трисомией 21, по одному в каждой группе лечения. В конечном итоге, среди российских пациенток в исследовании Lotus I матерями не сообщалось о проблемах со здоровьем младенцев во время визита 11 (телефонный звонок спустя 6 месяцев после родов для оценки безопасности и благополучия младенца/ев).
Обсуждение
Исследование Lotus I продемонстрировало, что пероральный дидрогестерон не уступал МВП в отношении достижения главной цели – наличия сердцебиения плода на 12-й неделе гестации [19]. Выводы, полученные при анализе результатов дополнительных целей, подтвердили результаты первичной эффективности, со схожими данными по частоте живорождений в обеих группах [19].
Российские результаты согласуются с общими результатами сравнимой эффективности между двумя видами терапии. Lotus I – одно из немногих крупных контролируемых рандомизированных клинических исследований III фазы, оценивающих поддержку лютеиновой фазы при применении вспомогательных репродуктивных технологий (ВРТ), имеющее адекватную мощность. Оно было проведено в соответствии с руководством по Надлежащей клинической практике Международной конференции по гармонизации (ICH GCP), что обеспечивает однородное выполнение протокола исследования в различных странах-участницах. Исследование было полностью «слепым» за счет использования дизайна с двойной имитацией. Протокол также содержал заранее установленный предел не меньшей эффективности, который был согласован с регуляторными органами после обращения за научной консультацией. Даже несмотря на то, что исследование не имело достаточной мощности для проведения анализа по подгруппам, например, для оценки российских данных в отдельности, важно отметить, что данные субанализа российской популяции подтверждают общее заключение о не меньшей эффективности дидрогестерона в сравнении с МВП. Все это в совокупности подтверждает общий вывод, применимый и к российским пациенткам.
Поскольку вагинальное применение позволяет целенаправленно доставлять лекарственное средство к матке [20], можно было бы ожидать, что оно может быть более эффективным для поддержки лютеиновой фазы при применении ВРТ. Однако результаты исследования Lotus I показали, что дидрогестерон не уступал МВП [19]. Более того, результаты исследования Lotus I соответствуют результатам метаанализа (2015 г.) данных по частоте продолжающейся беременности в подгруппах, в котором сравнивался дидрогестерон и капсулы МВП, и было получено значение относительного риска 1,19 в пользу дидрогестерона (95% ДИ 0,99–1,42); I2=0%; шесть рандомизированных контролируемых исследований; 1821 женщина; доказательство приемлемого качества) [11]. Поскольку дидрогестерон – это ретропрогестерон, он отличается от прогестерона более высокой биодоступностью, обеспечивающей длительное и стабильное системное действие [21, 22]. По этой причине в исследовании Lotus I использовалась суточная доза перорального дидрогестерона, которая в 20 раз меньше таковой МВП [19]. Поскольку дидрогестерон имеет высокую селективность к рецепторам прогестерона, вероятность побочных эффектов, обусловленных воздействием на другие рецепторы, снижена [21, 22].
Наконец, дидрогестерон имел схожий с МВП профиль безопасности и переносимости при применении для поддержки лютеиновой фазы в рамках ЭКО как в отношении матери, так и плода/новорожденного [19]. В российской популяции не сообщалось о проблемах со здоровьем младенцев через 6 месяцев последующего наблюдения.
Заключение
Как среди российских пациенток, так и в целом было выявлено, что дидрогестерон так же эффективен, как стандартная терапия МВП у женщин, которым проводится ЭКО [19]. В связи с этим результаты исследования Lotus I потенциально могут повлиять на лечение примерно 1,5 млн женщин во всем мире, которым ежегодно проводится ЭКО [1, 2] и которые могут выиграть от применения перорального дидрогестерона [19]. Дидрогестерон также представляет собой эффективную терапию для женщин в России, страны, активной с точки зрения частоты проведения процедур ЭКО [3].
Благодарности
Поддержка исследования со стороны компании Abbott: Элке Калер, Эрик ван Лювен и Владимир Ковалёв. Помощь в составлении текста статьи: Виктория Харви-Джонс (компания Alpharmaxim Healthcare Communications). Мы хотели бы поблагодарить следующих исследователей из стран-участниц. Австрия: Катарина Уолч (г. Вена); Бельгия: Дерик Коеман (г. Брассхаат), Том Коетцер (г. Гент), Вим Деклер (г. Гент), Каролина Лекок (г. Брюссель), Уильям Омбелет (г. Генк), Карен Пирайер (г. Лёвен), Жан-Франк Симон (г. Монс) и Кристин Винс (г. Брюссель); Финляндия: Кирсимарйа Кестилаа (г. Турку), Анна Кивийаарви (г. Хельсинки) и Никлас Симберг (г. Хельсинки); Германия: Марен ГёкенянФестаг (г. Дрезден), Анетт Сейман (г. Берлин), Томас Стровитски (г. Гейдельберг) и Петер Сидоу (г. Берлин); Израиль: Илан Кальдерон (г. Хайфа), Адриан Елленбоген (г. Хадера), Итан Люненфельд (г. Беэр-Шева), Даниэль Сейдман (г. Тель-Авив) и Алекс Симон (г. Иерусалим); Россия: Ирина Данкова (г. Екатеринбург), Татьяна Гурская (г. Москва), Владимир Кузьмин (г. Москва), Ирина Витязева (г. Москва) и Ирина Бармина (г. Москва), Вера Прилепская (г. Москва) и Нина Татарова (г. Санкт-Петербург); Испания: Эрнесто Босх Апаричио (г. Валенсия), Ана Белен Касас Балазоте (г. Барселона), Маркос Феррандо Серрано (г. Бильбао), Антонио Госальвез (г. Посуэло-де-Аларкон) и Роберто Маторрас (г. Баракальдо).
Финансирование
Данное исследование проводилось при спонсорской поддержке компании Abbott Established Pharmaceuticals.
Конфликт интересов
У автора Г.Т. Сухих конфликты интересов, подлежащие разглашению, отсутствуют; у автора И.И. Баранова конфликты интересов, подлежащие разглашению, отсутствуют; у автора Г.А. Мельниченко конфликты интересов, подлежащие разглашению, отсутствуют; у автора Н.В. Башмаковой конфликты интересов, подлежащие разглашению, отсутствуют; автор К. Блокилл получал гонорары от компаний: Abbott, Ferring, Finox, Merck Serono и MSD; автор Г. Гризингер получал гонорары за исследовательскую работу от компании Abbott во время проведения данного исследования, вне рамок представленного материала получал персональные гранты и нефинансовую поддержку от компаний: MSD, Ferring, Merck Serono, Finox, TEVA, Glycotope, а также персональные гранты от компаний: Vitrolife, NMC Healthcare LLC, ReprodWissen LLC и ZIVA LLC; автор А.А. Ломакина является сотрудником компании Abbott Laboratories, Москва, Россия; автор К. Пексман-Фейз является сотрудником компании Abbott GmbH& Co. KG, Висбаден, Германия и владеет акциями компании Abbott.



