По данным ВОЗ, среди людей среднего возраста курение является одним из лидирующих факторов риска заболеваемости и преждевременной смертности, причем у женщин это второй по значимости фактор риска после высокого артериального давления. Если у взрослых курение приводит к риску развития различных системных заболеваний [1], то во время внутриутробного развития эффекты материнского курения могут приводить к непоправимым нарушениям развития плода и сказываются на здоровье и развитии новорожденного, качестве его последующей жизни. Так, внутриутробное воздействие табачного дыма связывают с недостаточностью легочных функций и повышением астматических симптомов в детстве, низким весом при рождении, орофасциальными расщелинами, синдромом внезапной глухоты у новорожденных, срединным отитом, нейроповеденческими нарушениями и др. [2–7]. Установлено, что курение матери во время беременности действует как экзогенный фактор, который препятствует нормальному внутриутробному развитию плода в дозозависимой манере [8].
Традиционные исследования соотношения влияния наследственности и факторов окружающей среды на индивидуальную вариативность в показателях здоровья и заболеваемости делают акцент на корреляции между заболеванием, внешним воздействием и генотипом. Исследования последних десятилетий в области геномики человека показали, что наряду со структурной вариативностью генома существенную роль в развитии заболеваний и системных нарушений играет эпигенетическая регуляция экспрессии генов, в особенности на ранних стадиях развития [9]. Эпигенетическая регуляция реализуется посредством специальных механизмов, которые контролируют доступность промоторов генов (последовательность нуклеотидов ДНК, узнаваемых РНК-полимеразой и факторами транскрипции, как стартовая площадка для начала транскрипции) и функциональную активность других регуляторных областей генома и включают в себя метилирование ДНК, модификации гистонов, ремоделирование хроматина и редактирование РНК [10]. Исследование этих механизмов является основным объектом эпигенетики (от греч. epi – над, сверху), изучающей закономерности наследуемых изменений в экспрессии генов, которые происходят без изменения последовательности ДНК.
В данном обзоре мы более подробно рассматриваем один из основных эпигенетических механизмов – метилирование ДНК и его роль в эмбриональном развитии человека, а также обсуждаем значимость такого средового фактора, как влияние табачного дыма при курении матери на эпигенетический статус развивающегося ребенка.
Метилирование ДНК как эпигенетический механизм
Одним из основных и наиболее изученных эпигенетических механизмов является метилирование ДНК [10]. Этот механизм регуляции активности генов, участвует в ряде ключевых процессов, включая геномный импринтинг, инактивацию Х-хромосомы [11], подавление транспонируемых элементов в геноме [12] и поддержание активности генома в тканеспецифичной манере [13], обеспечивая структурное и функциональное разнообразие клеток и тканей организма. Метилирование ДНК у человека преимущественно состоит в присоединении метильной группы (CH3) к одному из азотистых оснований – цитозину. Эта модификация в большинстве случаев происходит в динуклеотидной последовательности CpG (С – цитозин и следующий за ним G – гуанин, соединенные остатком фосфорной кислоты – p). Такая последовательность имеет аналогичную в комплементарной цепи двойной спирали ДНК. Это дает возможность после репликации восстанавливать метилирование вновь синтезированной цепи ДНК по образцу одной имеющейся нити (рис. 1). Именно это и обеспечивает возможность наследования в ряду клеточных поколений паттерна ДНК-метилирования. Участки высокой плотности CpG называются CpG островками, или островками метилирования, и обнаруживаются в промоторных областях большинства (свыше 70%) генов человека.
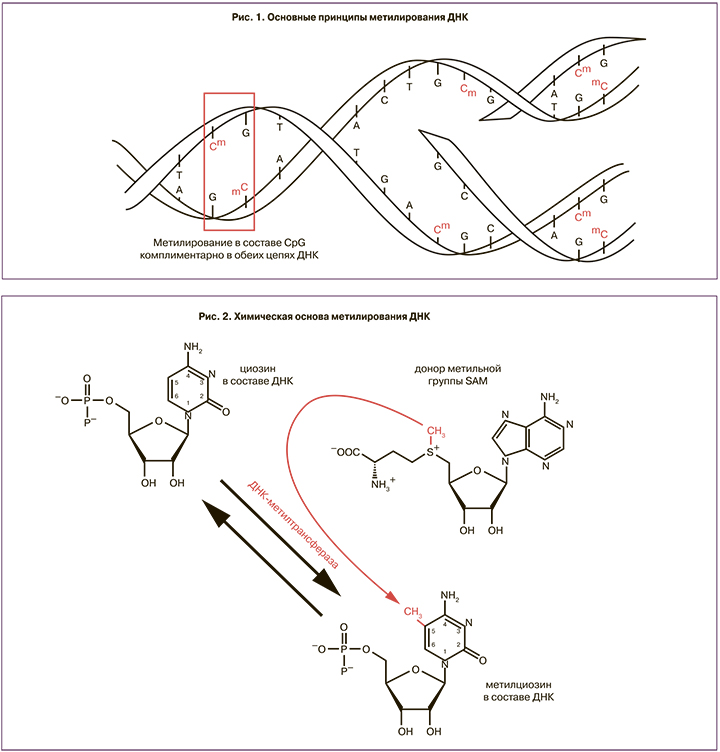
Процесс метилирования осуществляется комплексом ферментов, где одна из основных ролей принадлежит ДНК-метилтрансферазам 1 и 3 (DNMT1 и DNMT3). DNMT1 работает в основном на полуметилированной ДНК, ее функции связаны с восстановлением паттерна метилирования после репликации в соматических клетках организма, что особенно важно для тех тканей, где активные клеточные деления происходят на протяжении всей жизни. Субстратом для семейства DNMT3 служит неметилированная ДНК, и они играют важную роль при установлении тканеспецифичного паттерна метилирования de novo на самых первых этапах развития. DNMT3a и DNMT3b в ходе нормального эмбриогенеза должны начинать работу первыми и устанавливать специфичный рисунок метилирования, необходимый для обеспечения особых структурно-функциональных состояний хроматина в онтогенезе [14]. Требуемое для правильного развития соотношение между метилированными и неметилированными цитозинами поддерживается благодаря сбалансированной активности метилтрансфераз и процесса удаления с молекулы ДНК лишних метильных групп – деметилирования (рис. 2).
Обратимость ДНК-метилирования обеспечивает гибкость эпигенетической наследственности [15]. В отличие от ошибок в генетической информации ошибки метилирования могут быть исправлены или скорректированы, но именно это делает систему уязвимой. Поэтому природа сделала этот процесс многоэтапным и подчиненным различным контролирующим системам. Процесс деметилирования ДНК может осуществляться разными путями, включая пассивную потерю метильной группы и разные пути активного удаления с участием модифицирующих ферментов. В развивающихся эмбрионах человека важную роль играет путь с промежуточным окислением метилцитозина до гидрокриметилцитозина [16]. В его реализации ключевую роль играют ферменты семейства ТЕТ – название произошло от транслокации 10-й и 11-й хромосомы (Ten to Eleven Translocation), поскольку впервые повышенная активность этих белков была обнаружена в клетках, несущих транслокацию t(10;11)(q22;q23) у больных острой миелоидной лейкемией. В норме они способствуют быстрому удалению метильных групп в CpG островках и облегчению доступа факторам транскрипции к промоторам конкретных генов.
В зависимости от типа дифференцировки, клетки наследуют определенный паттерн метилирования; известно, что 10–15% CpG сайтов метилированы в клеточно-специфичной манере [13]. Этот паттерн метилирования передается в клеточных поколениях, но в ответ на внешнее воздействие клетки могут его корректировать и активировать работу определенных генов. Сбой отлаженной системы контроля может приводить к риску развития заболеваний. Так, повышенная активность деметилаз ассоциирована с развитием онкологических заболеваний, и, напротив, подавление деметилазной активности приводит к повышению уровня метилирования CpG островков в промоторных районах генов и нарушению их работы [17].
Благодаря своей пластичности паттерны ДНК-метилирования изменяются с возрастом под влиянием приобретенного опыта и воздействий окружающей среды, образа жизни и социо-эмоциональных факторов [18, 19]. У здорового человека процессы метилирования и деметилирования находятся под строгим контролем и помогают быстро реагировать в ответ на потребности организма и изменения условий. Динамичная природа ДНК-метилирования широко используется в поиске биомаркеров в исследованиях, направленных на изучение роли среды в возникновении рака и других заболеваний в контексте их молекулярной этиологии [20–24].
Динамика ДНК-метилирования в ходе эмбриогенеза
Если для взрослого человека изменения в ДНК-метилировании могут при неудачном стечении обстоятельств привести к нарушению функционирования отдельных клеток и тканей, или к раковому их перерождению, то в развивающемся организме даже кратковременное нарушение скоординированной эпигенетической регуляции оказывает серьезное влияние на реализацию программы развития и носит непоправимый характер. Степень серьезности таких нарушений зависит от величины воздействия и конкретного этапа развития, на который оно пришлось. Именно в процессе гонадогенеза и в ходе эмбрионального развития происходят наиболее быстрые и кардинальные динамические изменения, когда клеточно-специфичные паттерны метилирования устанавливаются через несколько волн глобального деметилирования и повторного de novo метилирования [25, 26].
Появлению нового человека предшествует формирование в организмах его родителей половых клеток (гамет) – яйцеклетки и сперматозоида. ДНК примордиальных половых клеток значительно метилирована; при миграции клеток в недифференцированные гонады в них наблюдается снижение уровня метилирования. В процессе созревания гамет их генетический аппарат подвергается своеобразной очистке от эпигенетической информации – происходит активное деметилирование ДНК. Этот процесс происходит по-разному в оогенезе и сперматогенезе, вследствие, генетическая информация от родителей маркирована по-разному и эти различия будут сохраняться во всех клетках человека; они будут стерты только в клетках полового пути во время гаметогенеза [27, 28].
Непосредственно после оплодотворения начинается второй раунд эпигенетического репрограммирования генома, который сопровождается глобальными изменениями характера метилирования ДНК и модификаций гистонов. Сначала в зиготе происходит снижение уровня метилирования ДНК отцовского пронуклеуса, а затем и материнского [16, 27, 28].
Снижение уровня метилирования продолжается до стадии морулы. В этом процессе задействованы механизмы, как активного, так и пассивного деметилирования. Затем запускаются процессы реметилирования, обеспечивающие дифференцировку бластомеров на внутреннюю клеточную массу (ВКМ) и трофэктодерму на стадии бластоцисты. После имплантации в результате метилирования de novo устанавливаются эпигенетические различия между клетками ВКМ и трофэктодермой. Паттерны метилирования ДНК генома зародыша сохраняются при последующих делениях; дальнейшая дифференцировка клеток ВКМ с образованием трех зародышевых листков сопровождается установлением специфичного для каждого из них характера метилирования ДНК, или паттерна метилирования, за счет локальных изменений. В норме и материнская, и отцовская копии генов имеют одну и ту же возможность быть активной в любой клетке; большинство генов экспрессируются в равной степени, будучи унаследованы от любого из родителей. Однако несколько сотен из ~25 тыс. генов человека подвержены геномному импринтингу – процессу, который ограничивает экспрессию копии гена от одного из родителей, и который реализуется опять же с помощью метилирования ДНК.
Данные о динамике ДНК-метилирования в основном получены на модельных объектах, все они свидетельствуют о наличии этапа удаления эпигенетических маркеров и последующем становлении новых профилей метилирования и ремоделирования хроматина на ранних этапах развития. У человека репрограммирование родительских геномов происходит при первых клеточных делениях и на стадии морулы уже начинается установление новых эпигенетических сигналов, присущих дифференцирующимся тканям эмбриона. Нарушения эпигенетического репрограммирования, в том числе обусловленные негативным влиянием внешних факторов, могут приводить к сбоям в программе онтогенеза, формированию аберрантных профилей экспрессии генов, и, как следствие, тяжелым патологиям или остановке развития, гибели эмбрионов или нарушениям развития плода [16, 26].
Материнское курение во время беременности и метилирование ДНК ребенка
Эффектам материнского курения во время беременности посвящены множество экспериментальных и обзорных публикаций. Помимо косвенных влияний через ухудшение здоровья матери, в педиатрии широко известны прямые эффекты материнского курения на развитие плода [2]. Здесь мы отметим некоторые из них, к числу таковых относятся эффекты никотина, накапливающегося в фетальной крови, амниотической жидкости и грудном молоке, причем концентрации у плода обычно на 15% выше материнского уровня. Эффекты никотина проявляются на каждом триместре беременности – от спонтанных абортов в первом триместре, до повышения риска преждевременных родов и снижения веса при рождении в последнем триместре. Показано, что никотин влияет на оба фактора, от которых зависит вес новорожденного: гестационный возраст плода во время родов и скорость роста плода. В моделях животных и на человеке было установлено, что никотин увеличивает материнское артериальное давление и частоту сердечных сокращений, при одновременном снижении кровотока матки. В дополнение, окись углерода в табачном дыме образует карбоксигемоглобин, который ингибирует выделение кислорода в ткани плода. Все это в сочетании с действием содержащихся в табачном дыме канцерогенных ксенобиотиков приводит к токсикации, гипоксии, оказывает негативное влияние на многие системы развивающегося плода, в особенности респираторную и нервную [2–4]. Как следствие, это исключает нормальное развитие ребенка, формируя внутриутробные пороки мозга и других органов, и может приводить к дефектам психики, проявляющимся в необоснованном плаче, нарушении сна, позже – в неконтролируемой агрессии.
Как было отмечено в предыдущих параграфах данного обзора, активное курение вызывает изменения в ДНК-метилировании. Пренатальный период, в свою очередь, является самым критическим в становлении эпигенетического статуса индивида. Первые же сравнительные исследования показали, что геномы детей (исследовалась периферическая кровь детей дошкольного и младшего школьного возраста), подвергшихся воздействию материнского курения во время беременности, характеризуются изменениями в глобальном и геноспецифическом метилировании ДНК [29]. Причем исследования изменений в ДНК-метилировании в зависимости от продолжительности воздействия табачного дыма обнаружили, что метильные метки указывают скорее на устойчивое, нежели краткосрочное, воздействие курения матери во время беременности [30]. Показано, что многие ассоциированные с материнским курением эпигенетические изменения имеют долгосрочный эффект и сохраняются на протяжении взрослой жизни (возраст испытуемых был за 40 лет), вне зависимости от активного курения [31].
В исследованиях влияния материнского курения на внутриутробное развитие используются различные подходы. Один из них – «ретроспективный», он рассматривает эпигенетические последствия у сформировавшихся организмов в разные периоды развития и основан на сравнении когорт взрослых [31] и детей (обычно младшего возраста) [29, 32] от матерей, куривших во время беременности и некурящих матерей. Другой – основан на изучении особенностей ДНК-метилирования в тканях плаценты и/или пуповинной крови [5, 7, 30, 33–39], и периферической крови новорожденных [40], или в фетальных тканях. Последние обычно используются в исследованиях на моделях животных [41]; в применении к человеку такие исследования строятся на тканях абортированных эмбрионов и они немногочисленны [34, 42–44].
Следует отметить, что, как и в случае исследований эпигенетических эффектов активного курения взрослых, крайне слабо изучены особенности тканеспецифичного ответа плода на материнское курение. Тогда как имеющиеся данные указывают на то, что такой дифференцированный ответ имеет место; как минимум он был обнаружен в различиях метилирования для некоторых генов (AHRR и CYP1A1) между плацентарными и фетальными тканями [37], а также отмечается в слабом перекрывании пула генов, ассоциированных с материнским курением в клетках крови и тканях головного мозга [42]. Другая сторона проблемы состоит в том, что исследования на фетальных тканях проводятся на крайне динамичной в пренатальном периоде эпигенетической системе, как было кратко описано в предыдущей главе обзора. Здесь крайне важны сроки развития плода, поскольку неизвестно когда в ходе развития происходят и стабилизируются, становясь детектируемыми, конкретные эпигенетические альтерации, вызванные материнским курением. Так, в работе, выполненной на тканях головного мозга от эмбрионов на втором триместре беременности, было показано, что основным дифференцирующим фактором для эпигенома выступало не курение матери, а стадия – ранний или поздний этап триместра, сопровождающегося быстрым развитием головного мозга [42]. При этом влияние материнского курения также было обнаружено в изменениях метилирования ДНК. Но еще больший эффект, по мнению авторов связанный с внутриутробным воздействием никотина, состоял в изменениях в структуре развития ДНК-метилирования, связанных с замедлением созревания нейронов и/или уменьшением числа зрелых нейронов у детей от курящих матерей.
Одно из первых крупномасштабных полногеномных исследований, опубликованное B.R. Joubert с соавт. [30, 35], было выполнено на когорте из свыше тысячи новорожденных (Norwegian Mother and Child Cohort Study). Изучая метилирование ДНК в клетках пуповинной крови и оценивая воздействие пренатального сигаретного дыма на основе циркулирования материнского котинина – метаболита никотина и стабильного биомаркера сигаретного курения, авторы идентифицировали эпигенетические изменения в 10 генах, ассоциированные с уровнем материнского котинина. Среди них наиболее значимыми были те, которые были обнаружены в генах ксенобиотик-детоксикации, а именно AHRR и CYP1A1. Как обсуждалось выше, эти два гена, стабильно обнаруживаются в ассоциации с активным курением у взрослых. Несколькими годами позже эти результаты были частично и полностью подтверждены и дополнены новыми находками в целом ряде исследований [5, 32, 35, 36, 39, 40].
Силами консорциума «Консорциум по эпигенетике беременности и детства» (Pregnancy and Childhood Epigenetics consortium, PACE) были объединены полногеномные данные целого ряда исследований, выполненных на одной платформе – биочип Illumina Infinium HumanMethyaltion450. Был проведен мета-анализ с включением 13 детских когорт из США и Европы, тщательно охарактеризованных с позиций истории материнского курения при беременности, с данными полноэпигеномного типирования пуповинной крови при рождении [38]. Пожалуй, на сегодня это исследование представляет собой наиболее обширную и всестороннюю оценку влияния материнского курения во время беременности на метилирование ДНК у потомства. С привлечением когорт детей старшего возраста были рассмотрены долгосрочные эффекты инициированных внутриутробным никотином эпигенетических альтераций с корректировкой на влияние постнатального вторичного табачного дыма. При анализе были приняты во внимание стаж курения и частота курения во время беременности – постоянное или эпизодическое курение. Были рассмотрены когортоспецифические ассоциации между курением матерей во время беременности и метилированием ДНК у потомства. Для определения функциональной значимости установленных эпигенетических альтераций были оценены ассоциации между статусом метилирования и уровнем экспрессии ряда генов; проводился анализ контролируемых ими биологических путей и анализ генных функциональных сетей.
В целом, на основе этой крупномасштабной работы [38] были сделаны следующие основные наблюдения и выводы.
- Материнское курение при беременности вносит значимую дисрегуляцию в геном развивающегося ребенка. Так, по результатам исследования было выявлено свыше 6 тысяч CpG сайтов в геноме, показавших значимые изменения статуса метилирования у детей от курящих матерей, среди которых снова лидирующие позиции в контексте значимости ассоциации (1,64×10-193) занимает ген AHRR.
- Наблюдаемые у младенцев эпигеномные альтерации являются долгосрочными. Так, несмотря на то, что у старших детей отмечалось некоторое «затухание» эффекта материнского курения, тем не менее, наблюдалась высокая конкордантность статусов метилирования у новорожденных и детей старшего возраста, статистически подтвержденная для 73% (4 из 6 тысяч) эпигенетических маркеров.
- Как и ожидалось, любые паттерны курения матери оказывают эффект на плод. Однако постоянное устойчивое курение характеризуется наибольшей величиной эффекта на эпигеномные альтерации и, возможно, связанные с ними последствия для здоровья и развития ребенка.
- О том, что такие последствия существуют известно, а о том, что они могут быть частично обусловлены эпигеномными нарушениями, говорят результаты анализа функциональной роли генов, чье метилирование изменяется из-за внутриутробного воздействия табачного дыма. Так, основные функциональные роли таких генов состоят в контроле над биологическими процессами развития. Среди них такие функции, как рост и анатомическое развитие, включая те, которые специфически связаны с эмбриональным морфогенезом (в эту группу входят гены активные во время эмбриогенеза), развитие нервной системы, развитие и пролиферация клеток [38]. Тот факт, что эпигенетические изменения, несомненно, могут являться одним из молекулярных механизмов, обуславливающих связь воздействия внутриутробного табачного дыма с различными негативными последствиями для здоровья и развития ребенка, подтверждается, пусть пока не многочисленными, работами по поиску ассоциаций в ряду материнское курение – эпигеном – фенотипы, в числе которых рассматривались ожирение [5], нарушение иммунного ответа [7] и нарушения развития центральной нервной системы [6].
Эпигенетика курения. Открытые вопросы и перспективы исследований
Курение является серьезной проблемой для здоровья, и понимание механизмов его воздействия является важной областью исследований. Исследования в области геномики последних 10 лет показали, что хроническое воздействие табачного дыма является неблагоприятным экологическим стимулом, способным модифицировать паттерны ДНК-метилирования, что, в свою очередь, может опосредовать эффекты курения на экспрессию генов и, в конечном счете, обусловливать сопутствующие курению нарушения и заболевания. Установлено, что инициированные табачным дымом альтерации в ДНК-метилировании могут происходить на всех этапах развития – во взрослом состоянии при активном курении и во время эмбрионального развития вследствие курения матери. Во взрослом состоянии курение влияет на уже установленные паттерны метилирования, которые лишь поддерживаются надлежащим образом в течение жизни и во время деления клеток. Тогда как пренатальное воздействие табачного дыма происходит в то время, когда ДНК-метилирование является высокодинамичным, развиваются закономерности метилирования в геноме и устанавливается эпигенетический статус организма, который поддерживается на протяжении всей жизни. Как следствие, пренатальные эффекты табачного дыма многократно усиливаются, оказывая серьезное влияние на реализацию программы эмбрионального развития.
В первую очередь эффекты курения нацелены на конкретные области эпигенома; так в соматических тканях курильщиков, в плаценте курящих матерей и тканях плода отмечаются одни и те же альтерации в паттернах метилирования генов, участвующих в химической детоксикации компонентов табачного дыма (например, AHRR и CYP1A1). Но в то же время влияние курения включает механизмы дестабилизации паттернов метилирования на глобальном геномном уровне. При этом, по-видимому, в различных клетках и тканях рисунок этих альтераций частично может отличаться, затрагивая различные генные каскады. Это было отмечено как в соматических тканях взрослых курильщиков, так и в дифференцирующихся эмбриональных тканях.
Несмотря на существенный прогресс в исследованиях эпигенетики курения, многие вопросы требуют дальнейшей разработки; среди таковых следует особенно выделить два основных. Во-первых, при установленных ассоциациях курения с нарушением метилирования ряда генов остается слабоизученной проблема систематического ответа эпигенома на курение, с позиций его дисрегуляции на уровне систем генов и генных каскадов. Во-вторых, следует отметить, что курение может изменить метилирование ДНК в ряде тканей, и некоторые из этих изменений могут различаться между тканями [42, 45, 46]. Однако основные работы проводятся на лимфоцитах крови, как наиболее доступном для исследований биологическом материале. Таким образом, остается слабоизученным вопрос о дифференцированном эпигеномном ответе на курение в различных тканях и органах.
Дальнейшее развитие исследований влияния курения на эпигеном, включая его воздействие на ДНК-метилирование, имеет высокий потенциал. Во-первых, новые находки в данной области способствуют пониманию молекулярных механизмов воздействия табачного дыма на организм и возникновения сопутствующих курению нарушений развития и здоровья. Во-вторых, эпигенетические изменения, приводящие к резким фенотипическим изменениям, особенно интересны, потому что они по природе своей полностью или частично обратимы. Это свойство потенциально позволяет запустить сценарий, где «эпигенетический код» может диктовать экспрессию определенного набора генов, по существу выступая в качестве переключателя «вкл/выкл». В настоящее время уже существует опыт разработки и использования «эпигенетических лекарств» при некоторых неврологических и раковых заболеваниях [47, 48]. Конечно, в случае с курением какое-либо эпигенетическое лекарство для борьбы с его эффектами представляется разработкой отдаленного будущего. Однако уже сегодня исследования влияния некоторых веществ на эпигеномные эффекты материнского курения для потомства приносят свои результаты. Так, в одном из рандомизированных клинических исследований было показано, что добавление витамина С в рацион курящей беременной женщины способствует нормализации метилирования ДНК у ребенка и снижению такого известного эффекта материнского курения, как недостаточность легочных функций у младенцев [34].



