К одному из наиболее часто встречающихся гинекологических заболеваний относится миома матки, которая, по данным ряда авторов, встречается у 20–54% женщин [1–6].
Наши клинические наблюдения показывают, что миома матки при профосмотрах выявляется у 18–20% женщин, при беременности у 8–10%, среди больных гинекологических стационаров – у 25–30%. Следует отметить также, что миома матки чаще (до 65%) выявляется в возрасте 40–50 лет, когда клинические проявления заболевания заставляют женщину обращаться за медицинской помощью. Однако в возрасте от 21 до 36 лет миома матки наиболее часто сочетается с бесплодием (до 21%), невынашиванием беременности (до 27%), дисфункцией яичников (до 29%). Кроме того, среди всех женщин, у которых с помощью ультразвукового исследования обнаруживают фиброматозные узлы, пациентки в возрасте до 21 года, по нашим данным, встречаются в 4% наблюдений.
В настоящее время пересмотрена доминирующая ранее концепция о ведущей роли эстрогенов в патогенезе миомы матки. В ряде научных исследований, выполненных в последнее десятилетие, было показано, что более 90% клеток миомы матки содержат рецепторы прогестерона. Это указывает на то, что прогестерон активно участвует в периферическом росте миомы. При этом следует отметить, что эстрогены выполняют вспомогательную функцию, то есть обеспечивают возможность прогестерону проявлять свою активность в отношении роста и развития лейомиомы матки [2, 5–7].
 В лечении практически любого заболевания неинвазивные вмешательства являются всегда более предпочтительными в сравнении с оперативными. Поэтому при отсутствии абсолютных показаний к операции в большинстве случаев мы считаем рациональным в лечении больных с миомой матки начинать с консервативной терапии, а при ее неэф-фективности переходить к инвазивным методам. При выборе хирургического лечения наряду с другими критериями необходимо в первую очередь руководствоваться возрастом пациентки и ее репродуктивными планами.
В лечении практически любого заболевания неинвазивные вмешательства являются всегда более предпочтительными в сравнении с оперативными. Поэтому при отсутствии абсолютных показаний к операции в большинстве случаев мы считаем рациональным в лечении больных с миомой матки начинать с консервативной терапии, а при ее неэф-фективности переходить к инвазивным методам. При выборе хирургического лечения наряду с другими критериями необходимо в первую очередь руководствоваться возрастом пациентки и ее репродуктивными планами.
Для консервативного лечения миомы матки предлагаются многие группы препаратов. В основе всех методов гормонотерапии лежат попытки предупредить стимулирующее воздействие стероидных гормонов, эстрадиола и прогестерона на опухолевые клетки [2, 6, 8].
Вместе с тем, учитывая данные литературы, указывающие на влияние эндогенного прогестерона на рост миоматозных узлов, патогенетически обоснованным и весьма перспективным является применение препаратов, подавляющих действие указанного гормона. К веществам, блокирующим действие прогестерона на уровне рецепторов, относятся антигестагены. Одним из представителей этой группы лекарственных средств является препарат гинестрил, содержащий мифепристон в дозе 50 мг. Можно предположить, что блокада прогестероновых рецепторов будет способствовать как торможению роста опухоли, так и уменьшению размеров миоматозных узлов и матки в целом. Кроме блокирования рецепторов к прогестерону мифепристон оказывает такие важные тканевые эффекты на уровне миоматозного узла, как увеличение апоптоза и снижение пролиферации клеточных элементов [3, 6, 8].
В российских источниках литературы, в отличие от зарубежных, имеются немногочисленные работы, посвященные применению мифепристона в лечении миомы матки.
Вышеуказанное определило цель исследования – оценить эффективность применения и переносимость препарата гинестрил (мифепристон, 50 мг) при консервативном лечении пациенток с миомой матки.
Материал и методы исследования
Под наблюдением находились 73 женщины в возрасте от 25 до 40 лет, ориентированные на проведение органосохраняющего лечения миомы матки, так как они планировали в будущем рождение детей. Консервативная терапия мифепристоном рассматривалась при размерах миомы матки до 12 недель беременности как самостоятельный вид лечения, а при размерах, соответствующих 12–16 неделям – как подготовительный этап к проведению хирургической миомэктомии, учитывая имеющуюся железодефицитную анемию у пациенток с большими размерами матки.
 Критерием включения пациенток в исследование были: множественная миома матки, интерстициальное и/или субсерозное расположение миоматозных узлов, отсутствие гиперпластического процесса эндометрия, готовность пациентки участвовать в исследовании и строго выполнять предписания врача.
Критерием включения пациенток в исследование были: множественная миома матки, интерстициальное и/или субсерозное расположение миоматозных узлов, отсутствие гиперпластического процесса эндометрия, готовность пациентки участвовать в исследовании и строго выполнять предписания врача.
Критериями исключения были: субмукозная локализация узлов лейомиомы, сочетание опухолей матки и яичников, беременные или кормящие грудью женщины.
Пациенткам мы рекомендовали, согласно указаниям, представленным в Федеральном руководстве РФ по гинекологии (2008), прием 1 таблетки гинестрила (мифепристон в дозе 50 мг) per os 1 раз в сутки в течение 3 месяцев.
До начала терапии для исключения онкопатологии и оценки состояния молочных желез проводили эхографию и/или маммографию (по показаниям). Указанные исследования выполнялись вне менструации в первой половине менструального цикла.
Всем пациенткам при первичном осмотре и в динамике наблюдения проводилось комплексное обследование, включающее оценку общего состояния, проведение гинекологического исследования, выполнение ультразвукового исследования органов малого таза и молочных желез, проведение «офисной» гистероскопии и гистологическое исследование эндометрия, полученного при pipelle-биопсии.
Эффективность терапии оценивали на основании клинических данных и результатов инструментальных исследований.
Предварительные наблюдения показали, что существует определенная зависимость между исходным размером узлов и степенью их уменьшения на фоне монотерапии мифепристоном. Поэтому все пациентки в последующем ретроспективно были разделены на две группы в зависимости от первоначальных размеров миоматозных узлов.
1-ю группу сформировали 32 пациентки, у которых размеры миоматозных узлов не превышали 3 см.
Во 2-ю группу вошла 41 женщина, имеющая миому матки, с размерами узлов более 3 см.
Результаты исследования и их обсуждение
Женщины 1-й группы с небольшими размерами миоматозных узлов, в отличие от пациенток другой группы, были более молодого возраста, имели меньше соматической и сопутствующей гинекологической патологии. Однако нарушения становления менструальной функции одинаково часто встречались у женщин в обеих группах. В то же время у пациенток 1-й группы чаще наблюдалось бесплодие, а у пациенток 2-й группы – невынашивание беременности.
На фоне проводимой терапии общее состояние большинства наблюдаемых пациенток было удовлетворительным и каких-либо жалоб они не предъявляли. Однако на фоне применения антигестагена у небольшого числа женщин отмечались некоторые проявления нейровегетативных (изменение артериального давления, пульса, пастозность нижних конечностей) и психоэмоциональных (раздражительность, плаксивость, нарушение сна) расстройств: в 1-й группе – у 5 (15,6%) и 3 (9,30%) пациенток, во 2-й группе – у 7 (17,1%) и 5 (12,2%) соответственно. Следует отметить, что указанные нарушения встречались в основном у пациенток с ранее имевшими место неврозоподобными состояниями и легко купировались симптоматическими лекарственными средствами.
Аллергических реакций во время применения гинестрила не отмечалось.
Состояние менструальной функции представлено на рис. 1 (см. на вклейке). Как видно из представленных данных, у пациенток 2-й группы чаще, чем в другой группе, встречались такие осложнения, как меноррагия и метроррагия. В период приема антигестагенного препарата у всех наблюдаемых пациенток развивались в течение первого месяца и сохранялась на протяжении всего периода терапии олиго- или аменорея.
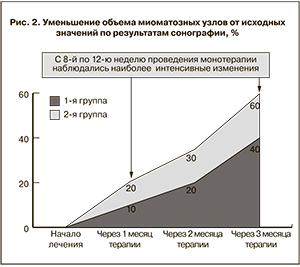
 Особенности, выявленные при проведении ультразвукового исследования органов малого таза в процессе наблюдения, представлены на рис. 2. Ежедневное применение гинестрила способствовало постепенному уменьшению размеров миоматозных узлов, причем наиболее интенсивные изменения наблюдались с 8-й по 12-ю неделю проведения лекарственной терапии. Детальный анализ данных сонографии показал, что на фоне приема мифепристона наиболее выраженный эффект в виде уменьшения объема узла на 40–60% исходного наблюдался при его размерах, не превышающих 3 см (в 1-й группе). При размерах фиброматозных узлов больше 3 см (во 2-й группе) уменьшение их объема по окончании лечения происходило на 25–45%. Следует отметить, что у одной пациентки из 2-й группы мы вообще не наблюдали каких-либо изменений в размерах имеющихся у нее миоматозных узлов. Возможно, это было связано с индивидуальными особенностями метаболизма применяемого лекарственного средства у данной больной и отсутствием его фармакологического действия.
Особенности, выявленные при проведении ультразвукового исследования органов малого таза в процессе наблюдения, представлены на рис. 2. Ежедневное применение гинестрила способствовало постепенному уменьшению размеров миоматозных узлов, причем наиболее интенсивные изменения наблюдались с 8-й по 12-ю неделю проведения лекарственной терапии. Детальный анализ данных сонографии показал, что на фоне приема мифепристона наиболее выраженный эффект в виде уменьшения объема узла на 40–60% исходного наблюдался при его размерах, не превышающих 3 см (в 1-й группе). При размерах фиброматозных узлов больше 3 см (во 2-й группе) уменьшение их объема по окончании лечения происходило на 25–45%. Следует отметить, что у одной пациентки из 2-й группы мы вообще не наблюдали каких-либо изменений в размерах имеющихся у нее миоматозных узлов. Возможно, это было связано с индивидуальными особенностями метаболизма применяемого лекарственного средства у данной больной и отсутствием его фармакологического действия.
Динамика изменений толщины эндометрия (М-эхо) на фоне приема мифепристона по данным сонографии не имела четких отличий между пациентками, была индивидуальной и находилась в диапазоне от 6 до 10 мм, в среднем 7,2±1,2 и 7,4±1,3 мм у пациенток 1-й и 2-й групп соответственно. В ряде исследований было показано, что некоторое утолщение эндометрия на фоне применения антипрогестагеннов объясняется патогенетическим действием лекарственного средства на рецепторы к прогестерону, в том числе находящиеся в слизистой матки. Указанные изменения являются клинически не значимыми и не приводят к патологическим изменениям [6, 8].
Следует отметить, что по данным эхографии каких-либо структурных изменений в придатках матки не наблюдалось.
Проведение гистероскопии до начала терапии позволяло исключить субмукозное расположение узла, диагностировать и удалить полип эндометрия, а также обнаружить признаки аденомиоза. Контрольное проведение гистероскопии по окончании трехмесячного курса приема гинестрила показало отсутствие у всех пациенток появления новых патологических новообразований в полости матки.
Гистологическое исследование слизистой матки до начала лечения позволяло обнаружить эндометрий в фазе пролиферации или подтверждало наличие полипов эндометрия: у 25 (78,1%) и 33 (80,5%), а также у 3 (9,4%) и 2 (4,9%) пациенток по группам соответственно. Морфологическое исследование, проведенное после лечения, указывало на признаки состояния эндометрия в фазе ранней или средней пролиферации и отсутствие гиперпластических изменений слизистой матки у всех наблюдаемых женщин.
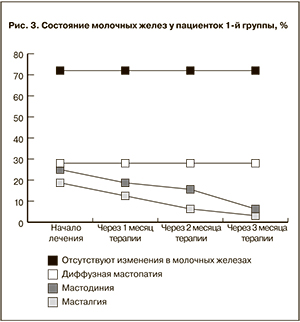
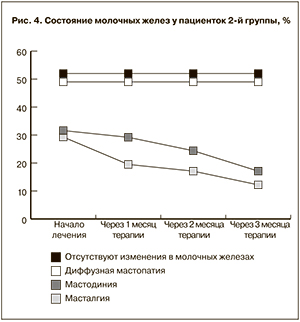
Оценка состояния молочных желез представлена на рис. 3 и 4. Какого-либо отрицательного влияния гинестрила на их состояние не было. На фоне приема мифепристона признаки диффузной мастопатии у тех женщин, у которых было данное заболевание, сохранялись. Однако ранее имеющиеся жалобы на напряжение и болезненные ощущения в области молочных желез у большинства пациенток в процессе приема антигестагена исчезали.
После проведенной монотерапии мифепристоном (50 мг) дальнейший период наблюдения пациенток продолжался от 6 до 12 месяцев и зависел от личной дисциплинированности пациентки, ее репродуктивных планов и поведения.
Женщинам, нуждающимся в контрацепции и имеющим после проведенной консервативной терапии размеры узлов не более 2 см, было рекомендовано применение микродозированных эстрогенсодержащих контрацептивов (комбинированный оральный контрацептив зоэли или внутривлагалищное кольцо новаринг). Выбор указанных контрацептивов был обусловлен тем, что помимо невысокой дозы стероидных ингредиентов эти препараты, как показано в ряде исследований, оказывают наименьшее влияние на метаболические, сосудистые и гемостатические параметры, чем другие эстрогенгестагенсодержащие средства [9–11].
Пациентки, у которых после проведенной монотерапии размеры узлов были от 2 до 3 см, не имеющие деформации полости матки, а также при сочетании миомы с аденомиозом с лечебно-контрацептивной целью использовали внутриматочную левоноргестрел-высвобождающую систему.
Наши наблюдения в течение года после проведенной антигестагенной терапии подтверждают данные других исследователей о том, что при небольших размерах миомы матки применение микродозированных гормональных контрацептивов и внутриматочной гормональной контрацепции в большинстве случаев не способствуют росту миомы матки [9, 10]. Из 23 пациенток, использовавших комбинированные контрацептивы, у 22 (95,7%) была стабилизация размеров узлов и только у одной женщины наблюдалось их незначительное (на 5%) увеличение. При использовании внутриматочной гормональной системы с левоноргестрелом также всего лишь у 1 из 8 женщин отмечался рост узла на 9%.
15 пациенткам, у которых после проведенной предоперационной терапии препаратом мифепристон (50 мг) размеры узлов были от 3 до 7,5 см, была проведена оперативная миомэктомия. Технических трудностей при хирургическом вылущивании узлов не возникало, тогда как некоторые авторы указывают, что после предоперационной терапии агонистами гонадотропин-рилизинг гормонов органосохраняющие операции более затруднительны из-за потери псевдокапсулы, при этом «миомэктомия превращается в миометрэктомию» [4].
При планируемой беременности и уменьшении миоматозных узлов до 2,5 см и ниже мы рекомендовали прием дюфастона по 10 мг 2 раза в день с 16-й по 25-й день менструального цикла. Основной целью назначения дидрогестерона было обеспечение формирования полноценной секреторной трансформации эндометрия, положительное его влияние на овуляцию и предупреждение прогрессирования роста узла. Наши наблюдения показали, что указанный прогестин хотя и не привел к уменьшению узлов, но и не способствовал их быстрому росту. Вероятно, это связано с тем, что экзогенно введенный гестаген, связываясь со специфическими рецепторами, снижает действие эндогенного прогестерона и его влияние на развитие миомы матки. На фоне приема дюфастона у 15 (68%) из 22 женщин наступила желанная беременность, другим 7 (32%) пациенткам через 6 месяцев наблюдения планировалось проведение дополнительного комплекса обследования и лечения по поводу отсутствия беременности.
Наблюдение в течение шести месяцев за 5 женщинами, которые имели после лечения размеры узлов от 1,5 до 2,5 и не принимали с лечебно-профилактической целью каких-либо лекарственных средств, показало, что менструальный цикл у них восстанавливался в течение первых двух месяцев после монотерапии мифепристоном, а рост узлов не отмечался в течение указанного периода наблюдения. В то же время известно, что после окончания приема агонистов гонадотропин-рилизинг гормонов, имеющих центральные механизмы действия, отмечается мощный выброс лютеинезирующего, фолликулостимулирующего и периферических гормонов с последующим быстрым возобновление роста миоматозных узлов на матке [1–4].
Выводы
- Пациентки с миомой матки по своему составу неоднородны. С увеличением их возраста наблюдается рост фиброматозных узлов, накопление сопутствующей соматической и гинекологической патологии. Выявленные особенности следует учитывать в работе врачу женской консультации для формирования группы риска по развитию миомы матки и выработки плана индивидуального ведения пациентки.
- Консервативная терапия может рассматриваться как начальный этап алгоритма проведения лечебно-профилактических мероприятий у пациенток с миомой матки, так как позволяет приостановить рост или уменьшить размеры доброкачественной опухоли матки, улучшить качество жизни пациентки, реализовать репродуктивные планы, отсрочить выполнение операции или провести предоперационную подготовку больной. Применение в течение трех месяцев гинестрила в качестве препарата выбора при монотерапии миомы матки патогенетически целесообразно, клинически эффективно (98%) и безопасно. Наиболее значительное (на 40–60%) уменьшение опухоли наблюдается при размерах миоматозного узла, изначально не превышающего 3 см в диаметре.
- На фоне применения мифепристона в суточной дозе 50 мг в течение трех месяцев не наблюдается каких-либо патологических изменений в эндометрии, придатках матки и молочных железах. Возникающие при приеме антигестагенного препарата у некоторых пациенток психоэмоциональные расстройства и вегето-сосудистые нарушения могут быть корригированы симптоматической терапией. Следует расценивать как положительный эффект на фоне приема мифепристона (50 мг) развитие олиго- или аменореи, так как это предупреждает развитие менструальноподобного кровотечения у пациенток с миомой матки и позволяет успешно провести противоанемическую терапию в предоперационном периоде. Вместе с тем изменения менструального цикла (олиго- и аменорея) наблюдаются только в период лечения и носят обратимый характер после прекращения приема антигестагена.



