Частота выявления полипов эндометрия (ПЭ) достигает 25–35%, в связи с чем они занимают ведущее место в структуре внутриматочной патологии. ПЭ служат показанием для проведения каждой четвертой гистероскопии ввиду их ассоциации с аномальными маточными кровотечениями (АМК), бесплодием и риском малигнизации [1–5]. Доля ПЭ, манифестирующих АМК, по разным данным, колеблется от 38% до 81,5%, в зависимости от используемых методов диагностики и возраста пациенток [1, 5–7]. Так, по одним данным, ПЭ являются причиной АМК в перименопаузе у 81,5% пациенток, а в постменопаузе – у 69% [8]. По результатам других исследований, частота АМК при ПЭ существенно ниже: в репродуктивном возрасте укладывается в 38%, а постменопаузе – в 46,5% [5, 6, 9]. ПЭ могут проявляться как обильными и длительными менструальными (ОМК), так и межменструальными кровотечениями (ММК). Однако данные о частоте и возможных причинах возникновения разных типов АМК при ПЭ крайне малочисленны. Механизмы, приводящие к клинической манифестации ПЭ, до сих пор остаются предметом дискуссий. Возникновение АМК чаще связывают с хроническим воспалением, патологическим ангиогенезом, тромбозами, микроэрозиями капилляров и ишемическим некрозом в ПЭ [1, 2, 10]. Логично предположить, что крупные и множественные ПЭ должны вызывать АМК чаще, чем мелкие и единичные, однако большинство авторов подобной корреляции не выявили [11, 12]. Клиническая манифестация ПЭ также может зависеть от их морфологической структуры, в частности, от соотношения железистого и фиброзного компонентов, которое лежит в основе подразделения ПЭ на железистые, фиброзные и железисто-фиброзные [13]. Следует отметить, что, по мнению экспертов ВОЗ (2014), такая классификация не вполне оправдана и не имеет существенного клинического значения, в том числе в вопросе взаимосвязи морфологической структуры ПЭ и АМК [14].
Таким образом, частота выявления различных типов АМК при ПЭ, а также механизмы их возникновения остаются до конца неясными, что вызывает сложности в диагностике и выборе тактики ведения пациенток. В связи с этим целью исследования явилось изучение гистологических и морфометрических особенностей ПЭ и их ассоциации с АМК.
Материалы и методы
В исследование были включены 130 женщин с гистологически подтвержденным диагнозом ПЭ в возрасте от 21 до 45 лет (в среднем 31,8±8,6 года). Были проведены ретроспективный анализ течения заболевания, оценка гистологических и морфометрических характеристик ПЭ. Критериями исключения служили патологические состояния, которые могли быть причиной АМК – миоматозные узлы с субмукозным и центрипетальным ростом, аденомиоз II–III степени, а также коагулопатии. Оценка характера менструального цикла и типа АМК проводилась в соответствии с классификацией FIGO (2018). Все случаи АМК были разделены на категории: ММК, ОМК или олигоменорея + ОМК, а также сочетание обильных менструальных и ациклических кровотечений (ОМК+ММК).
Помимо морфологических характеристик ПЭ, оценивалось состояние прилежащего эндометрия. С учетом этого, все образцы были подразделены на подгруппы: ПЭ на фоне эндометрия стадии пролиферации (ПЭ+СтП, n=58); ПЭ на фоне хронического эндометрита (ХЭ) (ПЭ+ХЭ, n=63); ПЭ на фоне гиперплазии эндометрия (ПЭ+ГЭ, n=7). ХЭ подразделяли на полную и неполную формы. Критериями полной формы служили: наличие плазматических клеток, очаговой лимфоидной инфильтрации, фиброзированной стромы. Неполная форма ХЭ диагностировалась при наличии очаговой или рассеянной инфильтрации лимфоцитами, фиброзирования стромы или склерозирования спиральных артерий на фоне эндометрия стадии пролиферации.
С целью выявления структурных особенностей проведена морфометрия 30 образцов ПЭ: 15 – сопровождающихся АМК и 15 – не имеющих клинической симптоматики. Морфометрический анализ проводился на препаратах, окрашенных гематоксилином и эозином, при 100-кратном увеличении. В каждом образце ПЭ были выбраны 2 поля зрения сосудистой ножки для измерения следующих параметров: количество сосудов, толщина сосудистой стенки, площадь сосудистого компонента, площадь эндометриальных желез, площадь стромы и соотношение площади желез к площади стромы. С помощью компьютерной программы Axio Vision 4.0 (Karl Zeiss, Германия) измеряемые показатели были представлены в микрометрах и квадратных микрометрах.
Статистическую обработку данных проводили с помощью программы Statistica 10.0. Для оценки категориальных признаков использовался метод хи-квадрата Пирсона. Для определения статистической значимости различий морфометрических показателей использовался метод Манна-Уитни. Данные представлены в виде медианы (Me) и квартилей 25 (Q1) и 75 процентиля (Q3). Статистически значимыми считались различия данных при р<0,05.
Результаты
Анализ гистологических заключений позволил выявить признаки атипической гиперплазии эндометрия (АГЭ) в ПЭ у двух женщин (1,5%) в возрасте 40 и 45 лет. Остальные ПЭ были охарактеризованы как доброкачественные железисто-фиброзные (n=106; 82,8%), железистые (n=13; 10,2%) или фиброзные (n=9; 7,0%). В 60 (46,1%) случаях ПЭ были диагностированы на фоне эндометрия СтП, в остальных 53,9% случаев – сочетались с патологией слизистой тела матки. Наиболее часто ПЭ выявлялись на фоне ХЭ – 63 (48,5%) случая, на фоне ГЭ без атипии – 7 (5,4%) случаев. Полная и неполная формы ХЭ встречались практически с равной частотой – 24,6% и 23,9% соответственно.
Было выявлено, что в 79 (60,8%) случаях ПЭ проявлялись АМК, соответственно, в остальных случаях не имели клинической манифестации и были диагностированы при ультразвуковом исследовании. У 37 (46,8%) пациенток АМК проявлялись ОМК, у 24 (30,4%) – ММК, у 12 (15,2%) наблюдалось сочетание ОМК+ММК. ОМК на фоне олигоменореи отмечали 6 (7,6%) пациенток, во всех этих случаях ПЭ сочетались с ГЭ. ПЭ с фокусами АГЭ также проявлялись ОМК на фоне олигоменореи. В связи тем, что АМК в указанных выше случаях могли быть симптомами как ГЭ, так и ПЭ, из дальнейшего исследования они были исключены. Анализ частоты и типов АМК при ПЭ не выявил статистически значимых отличий у пациенток различного возраста.
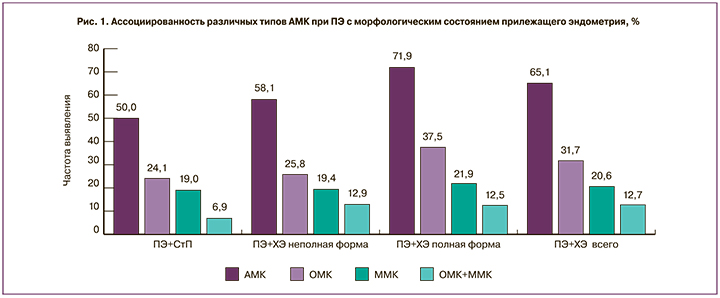
Данные о взаимосвязи типов АМК с гистологическим диагнозом представлены на рисунке 1. Как видно, АМК несколько чаще (на 15,1%) встречались при сочетании ПЭ с ХЭ, чем при ПЭ на фоне СтП. После разделения ХЭ на полную и неполную формы оказалось, что манифестация ПЭ значительно чаще наблюдалась при полной форме ХЭ, чем при СтП (ОШ=2,56; 95% ДИ 1,01–6,49; p=0,05). В группе с неполной формой ХЭ значимых различий от СтП не установлено. Что касается структуры различных типов АМК, то, независимо от прилежащего эндометрия, во всех подгруппах наблюдалось преобладание ОМК. Их доля при полной форме ХЭ была несколько выше, чем при СтП, однако статистически значимых отличий не выявлено.
С целью выявления взаимосвязи клинической манифестации ПЭ с их диаметром все образцы были разделены на 3 категории: ПЭ малых размеров – менее 0,6 см, средних – 0,6–1,0 см и больших – более 1,0 см. Доля ПЭ малых размеров составила 31,6%, средних – 46,9%, крупных – 21,5%. При этом установлено, что диаметр ПЭ не зависит от возраста пациенток или наличия ХЭ.
Как видно из рисунка 2, частота АМК при ПЭ разного диаметра существенно не различалась. Однако с увеличением размеров ПЭ наблюдался рост доли ОМК: с 9,7% при малых до 38,1% при больших ПЭ (р<0,001). Значимые различия в частоте ОМК также наблюдались между группами средних и больших ПЭ (p=0,001), тогда как между малыми и средними ПЭ существенной разницы не выявлено. При малых и средних размерах ПЭ частота ММК была приблизительно равной, а при крупных – оказалась в 6 раз ниже. Отмечено, что частота ОМК+ММК имеет обратную зависимость с диаметром ПЭ. Как оказалось, 109 (83,9%) пациенток имели единичные ПЭ и 21 (16,1%) – множественные. Частота выявления АМК при этом была схожей – 57,1% и 60,0% соответственно. ОМК при множественных ПЭ отмечались в 1,9 раза чаще, а ММК – в 2,2 раза реже, чем при единичных ПЭ, хотя статистических различий выявить не удалось.
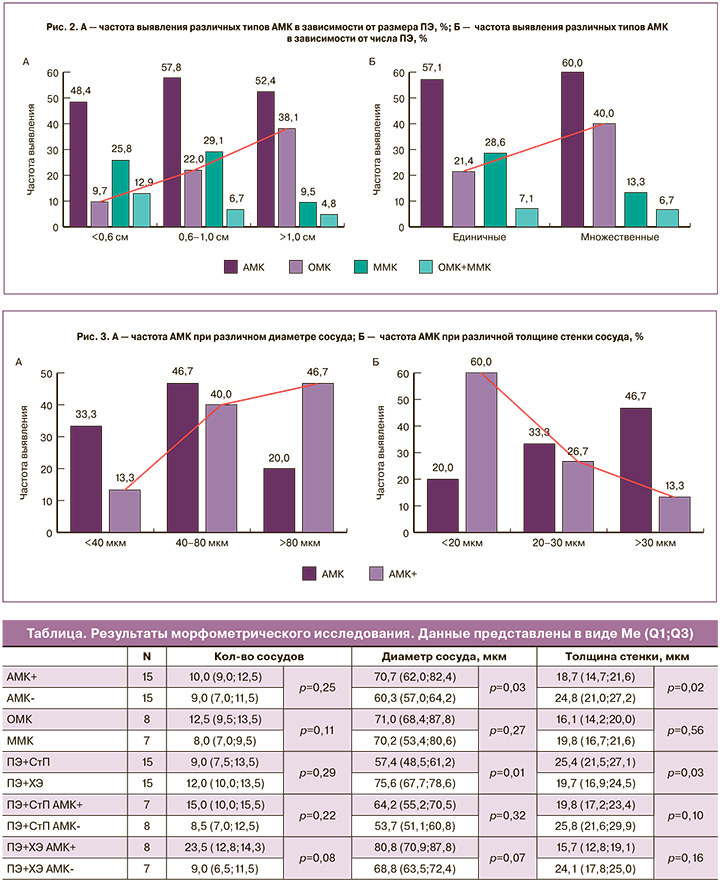
Наряду с гистологическим было проведено морфометрическое исследование, результаты которого представлены в таблице. Количество сосудов и площадь сосудистого компонента существенно не различались при ПЭ с АМК и без АМК. Однако при АМК отмечались застойные явления в микрососудах и их расширение, что нашло отражение в увеличении их просвета (p=0,03). В зависимости от диаметра сосуды были подразделены на малые (менее 40 мкм), средние (40–80 мкм) и большие (более 80 мкм). При АМК сосуды имели в основном средний и большой диаметр просвета и лишь в 13% случаев – малый. При диаметре сосудов более 80 мкм число манифестных ПЭ было в 2,3 раза выше, чем бессимптомных ПЭ (p=0,05) (рис. 3).
Среди пациенток с АМК толщина сосудистой стенки в ПЭ была меньше, чем в группе без АМК, – 16,5 мкм против 24,8 мкм (p=0,02). При подразделении образцов на сосуды с тонкими (менее 20 мкм), средними (20–30 мкм) и толстыми стенками (более 30 мкм) было выявлено, что на долю первых приходится 60% всех случаев АМК, и лишь 13% АМК диагностируется при толстых стенках. Визуальные отличия, характерные для ПЭ с АМК и без клинической манифестации, представлены на рисунке 4.

Морфометрическая оценка ПЭ с учетом типа АМК не выявила статистически значимых различий между ОМК и ММК. Проведенный анализ показал, что наличие ХЭ ассоциировалось с патологическими изменениями микрососудов. На фоне ХЭ диаметр сосудов в ПЭ был больше (р=0,01), а толщина стенки – меньше (р=0,03). Это соотносится с данными о более высокой частоте выявления АМК при ПЭ и ХЭ (см. рис. 1). Сравнение морфометрических показателей ПЭ на фоне ХЭ и СтП с АМК и без АМК показало, что, независимо от состояния прилежащего эндометрия, при АМК наблюдается тенденция к истончению стенок и увеличению диаметра микрососудов. Однако при наличии ХЭ эти изменения более выражены, чем при эндометрии СтП. Так, среди манифестных ПЭ, в группе ПЭ+ХЭ, диаметр сосудов был существенно больше, чем в группе ПЭ+СтП (р=0,04). Толщина сосудистой стенки при этом не имела достоверных различий. Анализ морфометрических характеристик не выявил значимой взаимосвязи диаметра, количества сосудов и толщины сосудистой стенки с размерами ПЭ. При этом наблюдалось постепенное увеличение площади сосудистого компонента: с 72 922,7 (24 082,6;106 660,3) мкм2 – при ПЭ малых размеров до 209 176,9 (108 197,6;446 452) мкм2 – при средних и 308 760,6 (112 070,7;356 753,6) мкм2 – при больших. Таким образом, площадь сосудов в крупных ПЭ оказалась в 4 раза больше, чем в малых (р=0,007).
Из 30 отобранных на морфометрическое исследование ПЭ 16 были охарактеризованы как железисто-фиброзные, 8 – как железистые и 6 – как фиброзные. По данным морфометрии, соотношение площади желез к площади стромы варьировало от 0,1 до 0,3 и не имело значимых отличий между этими группами. Площадь желез, площадь стромы и их соотношение не коррелировали с наличием АМК, сопутствующей патологией эндометрия и диаметром ПЭ.
Обсуждение
ПЭ являются наиболее распространенной формой внутриматочной патологии и причиной АМК как в репродуктивном периоде, так и в постменопаузе. Для ПЭ также характерна высокая частота рецидивов, следствием которой являются многочисленные внутриматочные вмешательства, не только снижающие качество жизни женщин, но и оказывающие повреждающее воздействие на эндометрий, повышающие риск возникновения внутриматочных синехий и бесплодия. ПЭ ассоциированы также с риском малигнизации, который в репродуктивном возрасте составляет 0,5–3,4%, в постменопаузе увеличивается до 12,9% [2, 4, 12]. Проведенное исследование не выявило злокачественных изменений в ПЭ, однако АГЭ в ПЭ была диагностирована в 1,5% случаев, что в целом согласуется с литературными данными. В подавляющем большинстве случаев ПЭ были охарактеризованы как железисто-фиброзные, реже – как железистые и фиброзные. Результаты более объективного морфометрического исследования не выявили значимых различий в площади желез, площади стромы и их соотношении при указанных выше гистологических диагнозах. Обращает внимание и тот факт, что железисто-стромальное соотношение не коррелировало ни с одним из клинических, гистологических и морфометрических параметров. Полученные данные отражают низкую клиническую значимость классификации ПЭ, основанной на соотношении фиброзного и железистого компонента, и подтверждают целесообразность использования классификации ВОЗ (2014), подразделяющей ПЭ лишь на 2 категории – доброкачественные и с АГЭ.
Основными клиническими проявлениями ПЭ являются АМК, они были выявлены у 60,8% женщин. Почти в каждом втором случае АМК характеризовались ОМК, в каждом третьем – ММК, значительно реже – их комбинацией. ОМК на фоне олигоменореи во всех случаях были связаны с ГЭ, в том числе с АГЭ в ПЭ. Эти результаты указывают на то, что ПЭ могут проявляться различными типами АМК, но возникают, как правило, на фоне регулярного ритма менструации, тогда как для ГЭ свойственно чередование АМК с олигоменореей. Таким образом, характер нарушений менструального цикла может косвенно указывать на наличие той или иной патологии эндометрия еще на догоспитальном этапе.
В нашем исследовании частота АМК не зависела от диаметра, а также от числа ПЭ, что согласуется с данными литературы [11, 12]. Однако отмечена взаимосвязь между размером ПЭ и типом АМК. ОМК чаще выявлялись при ПЭ больших размеров, чем при малых. Некоторые авторы считают, что торсионные движения крупных ПЭ могут приводить к травматизации эндотелия капилляров, тромбозу и ишемическому некрозу их верхушки [15]. Это вызывает обширную зону повреждения сети микрососудов, что при наступлении менструации приводит к увеличению объема кровопотери. ПЭ малых размеров в большей степени характеризовались ММК. Есть точка зрения, что ММК могут возникать на фоне лейкоцитарной инфильтрации эндометрия или при сопутствующем ХЭ за счет того, что протеолитические ферменты лейкоцитов приводят к деструкции межклеточных связей и клеточных мембран, выбросу простагландинов, сосудистому тромбозу, ишемическому некрозу и аутолизу сосудов. Было показано, что зона поражения артериол при этом представляет собой микроэрозии, которые проявляются скудными кровянистыми выделениями в середине менструального цикла [15]. Несмотря на то что при множественных ПЭ доля ОМК почти в 2 раза больше, чем ММК, статистически достоверных данных не получено. Это может быть связано с относительно малым числом случаев множественных ПЭ в нашем исследовании.
Вопрос о механизмах возникновения АМК при ПЭ остается дискутабельным, в связи с чем был проведен морфометрический анализ манифестных и бессимптомных ПЭ. Результаты исследования не выявили различий по площади и количеству сосудов в ПЭ между исследуемыми группами. Однако при АМК диаметр сосудов был значительно большим, а толщина сосудистой стенки меньшей, чем при бессимптомных ПЭ. Аналогичных исследований, касающихся морфометрических особенностей сосудов ПЭ и их связи с АМК, в доступной литературе нами обнаружено не было. Однако было показано, что расширение микрососудов и истончение их стенок также лежат в основе АМК, возникающих на фоне непрерывного режима локального и системного использования гестагенов [16, 17]. Стоит отметить, что, в отличие от данной работы, авторы указанных исследований не использовали метод компьютерной морфометрии, а патологические изменения сосудов определяли только при гистологической оценке образцов эндометрия. Известно, что патологически расширенные сосуды эндометрия характеризуются снижением количества перицитов (клеток, несущих опорную функцию в капиллярах) и гладкомышечных сосудистых клеток, что приводит к существенному истончению стенки и повышению ломкости сосудов. Расширение капилляров может быть связано с застоем крови, повышением давления и легкой травматизацией истонченной стенки сосудов [16–18].
Учитывая, что сосудистая ножка ПЭ, содержащая «клубок» крупных кровеносных сосудов, рассматривается как следствие патологического ангиогенеза, его нарушения могут служить одной из возможных причин структурных изменений сосудов, приводящих к АМК [10, 13, 16]. К числу наиболее важных индукторов неоангиогенеза относят сосудистый эндотелиальный фактор роста (СЭФР), экспрессия которого может быть повышена в ПЭ [19, 20]. Избыточное воздействие СЭФР способствует увеличению диаметра и истончению стенок капилляров функционального слоя эндометрия [16], что может лежать в основе структурных изменений сосудов и возникновения АМК при ПЭ. Другим важным звеном регуляции ангиогенеза считается сигнальный путь NOTCH, который играет ключевую роль в формировании кровеносных сосудов как в нормальном эндометрии, так и в ПЭ [21]. Установлено, что мутации в гене NOTCH-3 ассоциируются с патологией гладкомышечных клеток сосудов и развитием артериовенозных мальформаций, которые являются одной из причин кровотечений [22]. Возможно, что схожий механизм, связанный с нарушением ангиогенеза, играет роль и в возникновении АМК при ПЭ.
Согласно результатам ряда исследований, формирование сосудистой ножки ПЭ может быть результатом прогрессирующей васкулопатии, связанной с ХЭ [10, 23]. Carvalho и соавт. установили, что в 85,7% случаев бесплодия, связанного с ХЭ, имеются патологические изменения в сосудах эндометрия [23]. Как известно, ПЭ сочетаются с ХЭ в 19,7–27,5% [4, 23]. В проведенном исследовании они выявлялись на фоне воспалительных изменений эндометрия в каждом втором случае (48,5%). Столь высокую частоту сопутствующего ХЭ можно объяснить выделением как полной (24,6%), так и неполной формы ХЭ (23,9%), при которой иммуногистохимическим методом также выявляются плазматические клетки и высокий уровень провоспалительных цитокинов в эндометрии [24].
Важно отметить, что в ПЭ на фоне ХЭ истончение стенок и увеличение диаметра микрососудов было более выраженным по сравнению с ПЭ, возникшими на фоне СтП. Это может свидетельствовать о том, что длительный воспалительный процесс усугубляет патологические изменения капилляров, что приводит к увеличению частоты АМК при сочетании ПЭ с полной формой ХЭ в 2,5 раза.
Заключение
Результаты исследования позволяют сделать заключение, что с клинической точки зрения подразделение ПЭ на железистые, фиброзные и железисто-фиброзные представляется недостаточно обоснованным. В 60,8% случаев ПЭ манифестируют АМК на фоне регулярного ритма менструации, в каждом втором случае – на фоне ОМК, в каждом третьем – на фоне ММК, реже – при их сочетании. Одним из механизмов формирования АМК при ПЭ могут быть структурные изменения микрососудов в виде расширения их просвета и истончения стенок, вероятно, возникающие на фоне нарушений ангиогенеза. Наличие ХЭ в прилежащем эндометрии усугубляет морфологические изменения сосудов и увеличивает вероятность АМК.



