Эндометриоз – хроническое воспалительное заболевание с высокой распространенностью и серьезными репродуктивными и общими последствиями для здоровья [1, 2]. Эндометриоз является одним из наиболее распространенных доброкачественных гинекологических новообразований у женщин в пременопаузе и затрагивает, по различным оценкам, 10–15% женщин репродуктивного возраста [3]. Несмотря на многолетние исследования, патогенетические механизмы заболевания остаются невыясненными, а методы диагностики и лечения – малоэффективными. Это заболевание представляет значимую проблему общественного здравоохранения, сильно влияющую на качество жизни женщин, а также являющуюся значительным экономическим бременем.
В соответствии с клиническими проявлениями различают 3 фенотипа заболевания: перитонеальный эндометриоз (ПЭ), эндометриома яичников и глубокий инфильтративный эндометриоз (ГЭ) [4]. Понятие ГЭ подразумевает инфильтрацию эндометриоза глубже 5 мм под брюшиной и представляет собой наиболее агрессивную форму заболевания. ГЭ имеет общие признаки злокачественных заболеваний: повышенная пролиферативная и сниженная апоптотическая активность, инвазивность, адгезивность, склонность к метастазированию; может трансформироваться в злокачественные опухоли [5, 6]. Это дает основание предполагать возможность использования методов терапии рака и для ГЭ. В связи с этим представляют интерес рецепторы эфрина (Eph), которые зарекомендовали себя в экспериментальных исследованиях на животных в качестве перспективной мишени при лечении рака [7].
Эфриновые рецепторы (Eph) входят в семейство рецепторных тирозинкиназ, участвующих в эмбриогенезе, управляя ростом органов межклеточными коммуникациями [8]. Eph экспрессируются на поверхности клеточной мембраны, и их функциональная активация осуществляется путем связывания с соответствующим лигандом, эфрином. Тирозинкиназы рецепторов Eph и их лиганды эфрина являются критическими регуляторами передачи сигналов и формирования паттерна, зависящими от клеточных контактов. Связывание Eph/ephrin может приводить к активации различных биологических функций, таких как адгезия, или отталкивание, или повышенная или сниженная подвижность [9]. Патологическое повышение или снижение экспрессии Eph ассоциируется с различными заболеваниями – раком, сердечно-сосудистыми заболеваниями, болезнями мозга и др. [10]. В связи с этим Eph представляют интерес в качестве терапевтических мишеней при лечении различных заболеваний [11].
Рецептор EphA1 впервые был обнаружен в линии клеток рака печени человека, продуцирующих эритропоэтин, в 1987 г., показана его повышенная экспрессия (сверхэкспрессия) при различных видах рака человека, включая карциному желудка, колоректальный рак, рак яичников и молочной железы [12]. Рецептор регулирует многие аспекты биологии опухоли, выживаемости пациентов и рассматривается в качестве терапевтической мишени для лечения рака [13]. В то же время мы не нашли в поисковых системах работ по экспрессии EphA1 при РЭ. Аналогично не обнаружили работ по экспрессии рецептора в эутопическом и эктопическом эндометрии при эндометриозе.
В связи с этим целью настоящей работы было провести сравнительное исследование экспрессии EphA1 на мембране эпителиоцитов желез слизистой тела матки у пациенток с эндометриозом и РЭ методом иммуногистохимии.
Материалы и методы
Работа выполнена на базе ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Для проведения исследования из 46 пациенток были сформированы 4 группы: 1-ю группу составили 20 женщин с ГЭ (10 – в пролиферативной, 10 – в секреторной фазе менструального цикла (МЦ)), 2-ю – 21 женщина с ПЭ (12 – в пролиферативной, 8 – в секреторной фазе МЦ), 3-ю – 6 женщин с РЭ (высокодифференцированный эндометриоидный гистологический тип, стадия FIGO Ia рT1aNxMO), 4-ю (контрольную) группу составили 9 женщин без эндометриоза, прооперированных по поводу трубно-перитонеального фактора бесплодия, у которых по данным гистологического заключения не выявлено эндометриоза и других патологических изменений в эндометрии. Группы дополнительно разделены на подгруппы в зависимости от фазы МЦ накануне операции. Критериями исключения послужили: наличие тяжелых экстрагенитальных заболеваний и другой онкопатологии. Все пациенты подписали информированное согласие на участие в данном исследовании. Исследование было одобрено Этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава России.
Для полуколичественной оценки экспрессии EphA1 использовали стандартную технику иммуногистохимического окрашивания депарафинизированных препаратов антителами, как описано ранее [14]. Для выявления EphA1 использовали антитела фирмы Abcam Inc – кроличьи поликлональные антитела клона ab217363 в разведении 1:200 и в качестве вторичных антител – козий антикроличий иммуноглобулин IgG H&L (HRP) – клон ab205718. В качестве отрицательного контроля использовали срезы, окрашенные без специфических антител.
Статистический анализ
Статистический анализ проводили с использованием пакета программ MedCalc Statistical Software 11.5.0. Статистическую значимость между сравниваемыми группами определяли с применением непараметрического U-критерия Манна–Уитни. Данные представлены в виде медианы (Ме) и квартилей Q1 и Q3 в формате Ме (Q1; Q3). Уровень статистической значимости при проверке нулевой гипотезы считали соответствующим p<0,5.
Результаты
Данные, представленные в таблице, показывают, что на мембране эпителиоцитов желез слизистой тела матки у пациенток без патологии эндометрия экспрессия рецептора EphA1 значимо более высокая в секреторной фазе, чем в пролиферативной (35,0 и 22.0 у.е. соответственно, р=0,003, рисунок, А, Б).
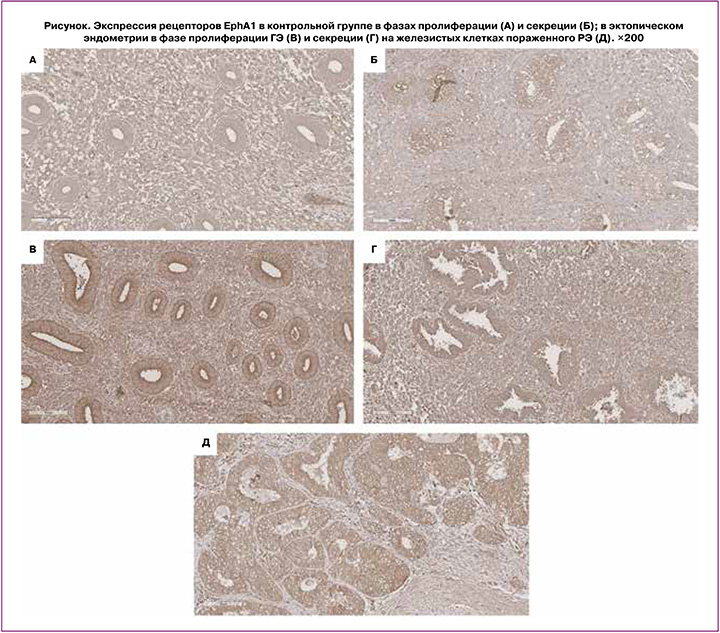
Уровень экспрессии рецептора на мембране эпителиоцитов желез в раковых клетках эндометрия значимо превосходил экспрессию в клетках нормального эндометрия как в пролиферативной, так и в секреторной фазах (46,0 у.е., p=0,003, таблица, рисунок, В), что указывает на аномально повышенный (сверхэкспрессированный) уровень EphA1 в раковых клетках (рисунок, Д).
При ПЭ экспрессия EphA1 на мембране эпителиоцитов желез в эутопическом эндометрии значимо не отличалась от таковой в контрольной группе в соответствующих фазах цикла. В то же время на поверхностных очагах на брюшине повышенная экспрессия рецептора выявилась в пролиферативной, но не в секреторных фазах цикла (таблица).
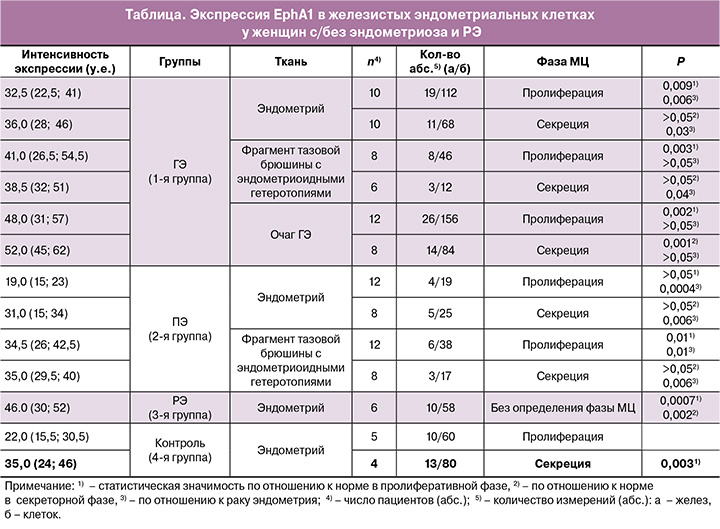
У пациентов с ГЭ на мембране эпителиоцитов желез в эутопическом эндометрии повышенная экспрессия EphA1 выявлялась только в пролиферативной фазе: 32,5 у.е. по сравнению с 22,0 у.е. в норме (р=0,009). В секреторной фазе цикла экспрессия EphA1 на мембране эпителиоцитов желез эутопического эндометрия была на том же уровне, что и в нормальном эндометрии, – 36,0 у.е. У этих же пациентов на мембране эпителиоцитов желез в эктопических очагах на брюшине, представляющих собой поверхностную форму эндометриоза, повышенная экспрессия EphA1 выявлялась также только в пролиферативной (41,0 у.е., р=0,003), но не в секреторной фазе цикла (таблица).
Значимо повышенная экспрессия EphA1 и в пролиферативной, и секреторной фазах была выявлена на эпителиоцитах желез в глубоко инфильтративных очагах пациентов с ГЭ (48,0, р=0,002 и 52,0, р=0,001 соответственно). При этом экспрессия в обеих фазах цикла была на уровне экспрессии на поверхности эпителиоцитов желез пораженного РЭ, что иллюстрирует фотография Д на рисунке.
Обсуждение
Эфриновые рецепторы и их лиганды-эфрины находятся на поверхности клеток, и взаимодействие между ними, осуществляемое путем межклеточного контакта, активирует широкий спектр сигнальных путей, направленных на пролиферацию, апоптоз, дифференцировку, клеточную адгезию, миграцию [15]. EphA1 вместе с его основным лигандом EphrinА1 играет важную роль в обеспечении репродуктивной функции путем регуляции фолликулогенеза, овуляции, транспорта эмбрионов, имплантации и формирования плаценты [16]. EphA1 экспрессируется на внешней мембране эпителиальных клеток эндометрия, тогда как его лиганд EphrinА1 выявляется на внешней мембране клеток бластоцистов, что опосредует установление маточной имплантации и обеспечивает пролиферацию и инвазию трофобласта в толщу децидуальной ткани [17]. Процесс прикрепления эмбриона приходится на секреторную фазу менструального цикла, что объясняет выявленную в нашей работе повышенную экспрессию EphA1 именно в этой фазе. В секреторной фазе формируется рецептивность эндометрия, важным фактором которой является разрастание кровеносной сосудистой системы в толще эндометрия, обеспечивающееся повышенной экспрессией в этот период ангиогенных факторов [18]. Китайскими исследователями было показано, что EphA1 активирует ангиогенез путем прямой стимуляции сигнальной системы SDF-1/CXCR4, контролирующей рост сосудистой системы в ткани [19].
Повышенная экспрессия EphA1 выявлялась при многих видах рака, в том числе и при раке яичников и цервикального канала [16, 20]. Целенаправленное ингибирование этой экспрессии на экспериментальных моделях часто сопровождается торможением различных стадий онкологического процесса. В связи с этим эфриновые рецепторы в последнее время рассматриваются как перспективные мишени для терапии различных онкологических заболеваний [21]. Мы не обнаружили в поисковых системах публикаций по экспрессии EphA1 при злокачественных поражениях эндометрия. Проведенные нами исследования показали, что и при РЭ, в частности ранней форме рака (высокодифференцированный эндометриоидный гистологический тип, стадия FIGA Ia рT1aNxM0), выявляется значимо повышенная, по сравнению с нормой, экспрессия EphA1, что может быть использовано в дальнейшем для разработки терапии заболевания.
Эндометриоз, особенно ГЭ, имеет ряд общих биологических процессов со злокачественными заболеваниями, в регуляции которых участвуют эфриновые рецепторы [5]. Ранее нами было показано, что EphA2 при ГЭ проявляет повышенную экспрессию на поверхности эпителиоцитов желез эктопического эндометрия пациентов с ГЭ, схожую со сверхэкспрессированным уровнем в раковых клетках эндометрия [22]. Аналогично было показано, что EphB4 проявляет повышенную экспрессию в эктопическом эндометрии по сравнению с эутопическим [23]. Более того, в экспериментах с трансплантированными мышами показано, что подавление экспрессии EphB4 приводит к торможению роста эндометриоидных клеток путем ингибирования ангиогенеза [24].
В нашем исследовании была выявлена повышенная экспрессия EphA1 в эутопическом эндометрии в пролиферативной фазе цикла при ГЭ, но не в контрольной (здоровой) группе или у пациенток с ПЭ, что может быть обусловлено повышенным уровнем системного воспалительного ответа при ГЭ. Однако в секреторной фазе повышения экспрессии рецептора в эутопическом эндометрии пациенток с ГЭ мы не обнаружили. На сегодняшний день нет публикаций по экспрессии EphA1 в эндометриоидных тканях, и необходимы дальнейшие исследования для понимания особенности его функции. Однако выявленная повышенная экспрессия EphA1 в эндометрии женщин с ГЭ в пролиферативной фазе в дальнейшем может быть использована для дифференциации эндометриоза по тяжести заболевания.
В эктопических очагах на брюшине и при ПЭ, и при ГЭ повышенная экспрессия рецептора выявилась только в пролиферативной фазе, но не в секреторной. В то же время на мембране эпителиоцитов желез в инфильтративных очагах эндометрия выявилась значимо повышенная экспрессия EphA1 в обеих фазах цикла, не уступавшая экспрессии в аналогичных тканях пораженных РЭ. Эта сверхэкспрессия еще раз подтверждает наличие общих механизмов патогенеза при раке и эндометриозе.
Заключение
Представленные данные открывают новые перспективы в понимании молекулярных процессов, участвующих в патогенезе эндометриоза и РЭ. Повышенный сверхэкспрессированный уровень EphA1 делает его перспективной мишенью для лечения как ГЭ, так и РЭ. Необходимо провести дальнейшее исследование в данном направлении, чтобы понять механизм развития патологических процессов, лежащих в основе бесплодия и болевых симптомов у женщин с эндометриозом.



