Врожденные (или внутриутробные) инфекции, в большой степени определяющие уровень мертворождаемости, неонатальной и младенческой смертности, являются одними из наиболее значимых заболеваний плода и новорожденного [1, 2]. Врожденными инфекциями принято называть те инфекционные заболевания детей, которые развиваются вследствие инфицирования плода в анте- или интранатальном периоде.
Диагноз врожденных инфекционных заболеваний устанавливается на основании совокупности клинических данных, результатов лабораторных, в том числе микробиологических, и инструментальных исследований. Недоношенные дети с экстремально низкой (ЭНМТ) и очень низкой массой тела (ОНМТ) при рождении практически всегда рождаются в тяжелом состоянии и имеют признаки ранней неонатальной дизадаптации, обусловленные не только инфекционными причинами, что определяет существенные дифференциально-диагностические трудности. Особую трудность у таких детей представляет раннее выявление врожденных инфекционно-воспалительных заболеваний бактериальной этиологии.
Одним из достоверных методов диагностики врожденной бактериальной инфекции является выделение микроорганизмов из стерильных локусов: кровь, а при подозрении на менингит цереброспинальная жидкость. Однако широкое превентивное использование антибиотиков как у матери, так и ребенка в перинатальном периоде предопределяет исключительную редкость выявления бактериемии и невозможность использования выделения возбудителя из крови в качестве основного диагностического критерия. Напротив, обнаружение микроорганизмов из ротоглотки, наружного ушного канала, пуповинного остатка, кала при бактериологическом исследовании говорит о колонизации и не свидетельствует о развитии инвазивной системной инфекции [3].
В настоящее время основная роль в диагностике врожденных бактериальных инфекций отводится комплексной клинико-лабораторной диагностике, включающей, помимо микробиологических методов, оценку системной воспалительной реакции организма ребенка. Однако, учитывая значительную степень морфофункциональной незрелости детей, родившихся с ЭНМТ и ОНМТ, диагностическая ценность маркеров системного воспаления в первые дни жизни остается дискутабельной, что обусловливает актуальность продолжения исследований.
Цель исследования: изучить особенности клинико-лабораторных проявлений врожденных бактериальных инфекций у детей с ЭНМТ и ОНМТ в первые 72 часа жизни.
Материал и методы исследования
В период с января 2012 по декабрь 2013 года в отделении реанимации и интенсивной терапии новорожденных ФГБУ НЦАГиП им. академика В.И. Кулакова Минздрава России были обследованы 129 новорожденных детей с ЭНМТ и ОНМТ в первые трое суток жизни. Проводилось исследование клинического анализа крови на 1-е сутки жизни и повторно на 3-и сутки жизни; биохимический анализ крови, гемостазиограмма на 3-и сутки жизни; кислотно-основное состояние (КОС) и лактатемия капиллярной крови оценивались каждые 6–8 часов, С-реактивный белок (СРБ) и прокальцитонин (ПКТ) – на 3-и сутки жизни; нейросонография, ультразвуковое исследование органов брюшной полости, ЭХО-кардиография, рентгенография органов грудной клетки выполнялись в 1-е сутки жизни. В зависимости от тяжести состояния нейросонография, ЭХО-кардиография, рентгенография органов грудной клетки проводились повторно на 3-и сутки жизни.
 Диагноз врожденной инфекции устанавливался по совокупности клинико-лабораторных и инструментальных изменений, включающих полиорганную недостаточность, специфические изменения на рентгенограмме легких в виде очаговых и инфильтративных теней (абсолютные признаки пневмонии [4, 5]), положительных результатов бактериологического исследования крови воспалительных изменений в клиническом анализе крови [6, 7], а именно: лейкоцитоза на 1-е и 3-и сутки жизни (более 30 и 20 тыс. соответственно), лейкопении (менее 5 тыс.), нейтрофилеза (более 20 тыс. в 1-е сутки жизни и 7 тыс. на 3-и сутки жизни), нейтропении (менее 5 тыс. в 1-е сутки жизни и менее 2 тыс. на 3-и сутки жизни), повышения нейтрофильного индекса (≥0,2).
Диагноз врожденной инфекции устанавливался по совокупности клинико-лабораторных и инструментальных изменений, включающих полиорганную недостаточность, специфические изменения на рентгенограмме легких в виде очаговых и инфильтративных теней (абсолютные признаки пневмонии [4, 5]), положительных результатов бактериологического исследования крови воспалительных изменений в клиническом анализе крови [6, 7], а именно: лейкоцитоза на 1-е и 3-и сутки жизни (более 30 и 20 тыс. соответственно), лейкопении (менее 5 тыс.), нейтрофилеза (более 20 тыс. в 1-е сутки жизни и 7 тыс. на 3-и сутки жизни), нейтропении (менее 5 тыс. в 1-е сутки жизни и менее 2 тыс. на 3-и сутки жизни), повышения нейтрофильного индекса (≥0,2).
Клиническая оценка тяжести состояния новорожденных в процессе реанимации и интенсивной терапии проводилась общепринятыми методами: физикальный осмотр ребенка проводился в родильном зале, при поступлении в отделение (через 20–30 мин после рождения), а затем каждые 3–4 часа до полной стабилизации состояния.
При этом состояние детей в первые 5 минут жизни оценивалось по шкале Апгар, степень дыхательной недостаточности в первые часы жизни определялась по шкале Сильверман. Общая тяжесть состояния и степень выраженности полиорганной недостаточности в первые трое суток жизни оценивалась ежедневно по шкале Neomod [8].
Верификация диагноза инфекционно-воспалительного заболевания проводилась в возрасте 72 часов.
На основании результатов комплексного клинико-лабораторного и клинико-инструментального обследования были выделены три группы новорожденных.
Первая группа включала детей с врожденной инфекцией (n=51). Для них было характерно наличие полиорганной недостаточности, абсолютных рентгенологических признаков пневмонии и повышение СРБ и/или ПКТ. При бактериологическом обследовании в первые сутки жизни у одного ребенка была обнаружена бактериемия.
Вторую группу составили дети, у которых по данным рентгенографии отсутствовали абсолютные признаки пневмонии, не было признаков полиорганной недостаточности, но имелось повышение концентрации СРБ или ПКТ в крови выше нормативных значений, то есть проявления системного воспаления, что не позволяло исключить вероятность течения инфекционного процесса (n=52).
Третья группа включала детей, не имевших признаков врожденной инфекции, концентрации СРБ и ПКТ у которых в крови были пределах нормативных значений (n=26).
Статистическая обработка данных выполнялась с использованием пакета прикладных программ Statistica 8.0 (StatSoft Inc., США). Количественные признаки описывались медианами и квартилями (Ме [LQ; UQ]). Качественные признаки описывались абсолютными и относительными частотами их значений. Для количественных признаков сравнение несвязанных групп проводилось с использованием непараметрического теста Манна–Уитни (U-test). Для сравнения частот значений признаков в группах применялся двухсторонний точный критерий Фишера. Различия считались статистически значимыми при достигнутом уровне значимости р<0,05. Все дети в данном исследовании подбирались методом случайной выборки с учетом задач проводимого исследования.
Результаты исследования
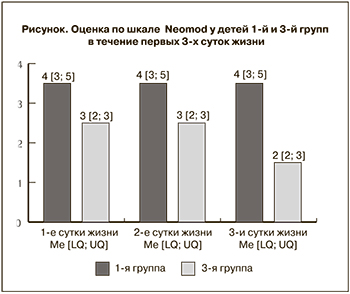
Сравнительный анализ показал, что дети с врожденной инфекцией (1-я группа) рождались в более тяжелом состоянии по сравнению с новорожденными 3-й группы, не имеющих признаков врожденной инфекции. Оценка по шкале Апгар в 1-й группе составила на 1-й минуте жизни 5 4–6) баллов, тогда как в 3-й группе она была 6 (6–7) баллов (р=0,0034). К 5-й минуте данная тенденция сохранялась (7 (6–7) баллов в 1-й группе и 7 (7–8) баллов в 3-й группе (p=0,014)). Дети 1-й группы находились в достоверно более тяжелом состоянии на протяжении первых трех суток жизни (Neomod) по сравнению с новорожденными 3-й группы (p≤0,0002) (рисунок).
Среди детей 1-й группы была статистически достоверно более выражена степень тяжести дыхательной недостаточности. Оценка по шкале Сильверман при поступлении детей в отделение реанимации и интенсивной терапии новорожденных составила 4 (3–4) балла в 1-й группе и 3 2–4) балла в 3-й группе (р=0,0197). Потребность в проведении искусственной вентиляции легких (ИВЛ) в 1-е сутки жизни в 1-й группе (56,8% новорожденных) была достоверно статистически значимо более высокой, чем у детей 3-й группы (11,5%) (р=0,0001). К 3-м суткам жизни потребность в проведении ИВЛ сохранялась только среди детей 1-й группы. Кроме того, общая длительность респираторной терапии (383 108–717) часов в 1-й группе, 108 (52–257) часов в 3-й группе) и концентрация кислорода во вдыхаемой смеси (FiO2) в течение пер -й группе, 0,21 (0,21–0,215) в 3-й группе) были достоверно выше в 1-й группе по сравнению с 3-й группой (р=0,0009, p<0,0005 соответственно).
При исследовании КОС отмечалось статистически достоверно более низкое значение уровня рН в 1-й группе на протяжении первых трех суток жизни (7,29–7,31 (7,23–7,36)) по сравнению с -й группой (7,33–7,36 (7,29–7,4), p<0,013), в 1-е сутки жизни был более выражен дефицит оснований (ВЕ) (в 1-й группе -9,1 (-11,2–-5,4), в 3-й группе -5,95 (-8,3–-3,9, р=0,033), а также значения рСО2 на 3-и сутки жизни (36,95 (32,1–45,6) мм рт. ст. в 1-й группе и 29,3 (25,9–36,6) мм рт. ст. в 3-й группе, р=0,0007).
Среди детей 1-й группы были статистически достоверно более выражены гемодинамические нарушения в виде артериальной гипотензии на протяжении первых трех суток жизни по сравнению с детьми 3-й группы (среднее артериальное давление 30–35 26–38) мм рт. ст. в 1-й группе и 33–40,5 (30,5–44) мм рт. ст. в 3-й группе, р<0,016), что достоверно более часто требовало применения кардиотонических препаратов в комплексной терапии (61,7% – 1-я группа и 16,7% – 3-я группа, р=0,0003).
При исследовании почечной функции отмечалось статистически достоверное повышение концентраций мочевины (1-я группа – 9,2 (7,1–12,3), 3-я группа – 7,6 (4,5–10), р=0,0077), креатинина (1-я группа – 93 (72–122,7), 3-я группа 63,7 (49–81), р=0,0017), β2-микроглобулина (1-я группа 4,8 (3,8–5,1), 3-я группа – 3,3 (2,8–3,6), р=0,009) в сыворотке крови в 1-й группе по сравнению с 3-й группой на третьи сутки жизни, что свидетельствует о почечной недостаточности.
Недостаточность желез внутренней секреции проявлялась более высокими показателями гликемии со 2-х суток жизни среди детей 1-й группы (7,1 6,1–9,1)) по сравнению с детьми 3-й группы (5,2 (4,75–6,9), р=0,0015). Потребность в применении инсулинотерапии (актрапид) на 2-е сутки жизни в 1-й группе отмечалась у 31,4% детей, в 3-й группе – у 3,8% (р=0,0384).
В 1-й группе статистически достоверно более часто отмечались реактивные изменения печени по данным ультразвукового исследования органов брюшной полости в первые сутки жизни (25,5% в -й группе и 4,1% в 3-й группе, р=0,024), а также проявления нарушения синтетической функции печени в виде статистически достоверно более низкой концентрации общего белка (в -й группе 42,8 (39–46,2) г/л и в -й группе 46,95 (42,9–51,8) г/л, р=0,0006) и концентрации альбумина (27,5 24,8–28,9) г/л в 1-й группе и 31,2 28–33,6) г/л в -й группе, р=0,0001).
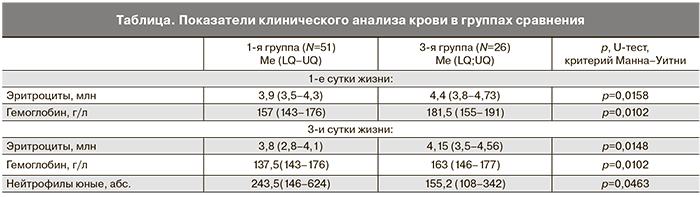
Сравнительный анализ показателей клинического анализа крови выявил статистически достоверно более значимые признаки анемии и повышение абсолютного числа юных форм нейтрофилов среди детей 1-й группы по сравнению с новорожденными 3-й группы (таблица).
Анализ показателей воспалительных изменений в клиническом анализе крови на 1-е и 3-и сутки жизни показал, что достоверное статистически значимое отличие среди детей 1-й и 3-й групп имеет только нейтрофильный индекс в возрасте 1 суток жизни (р=0,048).
Смертность детей 1-й группы составила 27,5%, в 3-й группе – 3,8%, что является статистически достоверным (р<0,011).
Сравнительный анализ клинико-лабораторных признаков, а также данных инструментальных методов обследования детей 2-й и 3-й групп не выявил достоверно статистически значимых отличий, что позволяет рассматривать 2-ю группу детей как не имеющих врожденных инфекций, а изолированное повышение одного из маркеров воспаления (или СРБ, или ПКТ) как проявление системного воспаления, не связанного с врожденной инфекцией.
Обсуждение
В нашем исследовании новорожденные с врожденной инфекцией имели более низкую оценку по шкале Апгар и более высокую по шкале Neomod. Wójkowska-Mach и соавт. также указывает, что более низкая оценка по шкале Апгар повышает риск реализации врожденной пневмонии [9]. Применение шкалы Neomod обеспечивает более точную раннюю диагностику синдрома полиорганной недостаточности у недоношенных детей [10].
Для новорожденных с ЭНМТ и ОНМТ с течением врожденной инфекции было характерно наличие полиорганной недостаточности с вовлечением дыхательной, сердечно-сосудистой систем, а также нарушением почечной функции и, вероятно, недостаточностью желез внутренней секреции. Полученные нами результаты соответствуют имеющимся в литературе данным [11].
Недостаточность желез внутренней секреции у новорожденных детей, сопровождающаяся, в частности, гипергликемией, является проявлением стрессовой ситуации, в том числе обусловленной течением сепсиса [12]. Группа детей с врожденной инфекцией имела достоверно более частую потребность в коррекции гипергликемии препаратом инсулина (актрапид).
Достоверно значимых различий при соспоставлении частоты и тяжести нарушений других органов и физиологических систем, а именно: печеночной недостаточности, нарушения перфузии кожи, недостаточности системы гемостаза, дисфункции желудочно-кишечного тракта, нарушения функции центральной нервной системы – в исследуемых группах не отмечалось. Согласно нашим отдаленным наблюдениям, характерные для течения инфекционного процесса более выраженные изменения со стороны выше описанных органов и систем у глубоконедошенных детей проявляются в сроки более 72 часов жизни.
При исследовании клинического анализа крови было отмечено статистически достоверно более значимое повышение абсолютного числа юных форм нейтрофилов в группе детей с врожденной инфекцией, что, согласно данным литературы может являться признаком септического процесса [13]. Однако это изменение выявлено только у 13% детей 1-й группы, что свидетельствует о низкой специфичности данного показателя. По данным S. Arif ни один из тестов, используемых изолированно, не обладает досточной диагностической ценностью при верификации врожденной инфекции, в то время как комбинация общего числа лейкоцитов, абсолютного числа нейтрофилов и СРБ повышает чувствительность до 100% [14].
В нашем наблюдении отмечено достоверно более частое развитие ранней анемии у детей 1-й группы, что подтверждается работой Jiang и соавт., которые считают анемию в раннем неонатальном периоде одним из признаков врожденного сепсиса [15].
Сравнительный анализ 2-й и 3-й групп не выявил статистически значимых различий клинико-лабораторных данных, за исключением сывороточных концентраций СРБ или ПКТ, что позволяет сделать вывод о недостаточной информативности изолированного повышения одного из маркеров системного воспаления при комплексной диагностике врожденной инфекции. Разнообразие неинфекционных факторов: синдром аспирации мекония, травматическое или ишемическое повреждение ткани головного мозга, гемолиз, или хориоамнионит у матери в родах – могут также приводить к повышению СРБ выше нормативных значений [16]. В отличие от CРБ, у детей при травматических повреждениях, вирусных инфекциях, а также при синдроме аспирации мекония концентрация ПКТ остается в пределах нормативных значений. Тем не менее, ПКТ имеет свои ограничения, так как его концентрация увеличивается у новорожденных, требующих проведения реанимационных мероприятий в родильном зале, а также у новорожденных с отсутствием инфекционного заболевания от матерей с хориоамнионитом [11].
Анализ результатов бактериологического исследования выявил низкий процент положительных результатов при наличии у детей клинической картины врожденной пневмонии и раннего неонатального сепсиса. Следует отметить, что объем материала, взятого на микробиологическое исследование, а также вирулентность микроорганизма являются важными факторами, влияющими на результаты микробиологического исследования. Кроме того, необходимо обращать внимание на применение антибактериальных лекарств матерью перед родами, что также может оказывать влияние на микрофлору новорожденного и затруднять у него диагностику инфекционного процесса [17].
Выводы
Характерным проявлением врожденных инфекционно-воспалительных заболеваний у детей с ЭНМТ и ОНМТ в первые 72 часа жизни является полиорганная недостаточность с развитием преимущественно дыхательной, почечной недостаточности, гемодинамических нарушений, сопровождающаяся выраженными метаболическими нарушениями (гипергликемией и стойкими нарушениями КОС). Воспалительные изменения клинического анализа крови не имеют достаточной чувствительности и специфичности для верификации диагноза врожденной инфекции у детей с ЭНМТ и ОНМТ в первые 72 часа жизни. Исключение составляет нейтрофильный индекс, измеренный в первые сутки жизни, который обладает умеренной специфичностью, однако имеет низкую чувствительность.
Изолированное повышение одного из биохимических маркеров системного воспаления (СРБ или ПКТ) при отсутствии других клинико-лабораторных признаков не может использоваться в качестве достоверного признака врожденной инфекции у детей с ЭНМТ и ОНМТ, по крайней мере, в первые 72 часа жизни.



