Несмотря на достижения современной медицины, фиброзно-кистозная мастопатия (ФКМ) и фиброаденома (ФА), которые относятся к доброкачественным заболеваниям (ДЗМЖ), продолжают лидировать в структуре заболеваний молочных желез. Представляя собой патологию, в основе которой лежит нарушение процессов пролиферации и регрессии эпителиального и соединительно-тканного компонентов, ДЗМЖ повышают риск заболеваемости раком молочной железы [1–3]. В течение последних нескольких лет рядом работ [4, 5] показана связь между обеспеченностью витамином D (VD) и раком молочной железы, а также установлено снижение плотности молочной железы при приеме витамина D и кальция у женщин в пременопаузе [6]. В связи с этим большой интерес представляет протективный эффект VD при ДЗМЖ.
По данным исследований обеспеченность VD определяется не только уровнем инсоляции, но и генетическими факторами. Так, в ходе полногеномного анализа ассоциаций был выявлен ряд генетических маркеров, обусловливающих содержание циркулирующей формы VD и истинной обеспеченности VD на тканевом уровне. Была обнаружена ассоциация циркулирующего VD с полиморфизмом генов VDR (кодирует ядерный рецептор VD), GC (кодирует VD-связывающий белок – DBP) и CYP2R1 (кодирует фермент микросомальную гидролазу, превращающий VD 3 в активную для рецепторного захвата форму). Особый интерес в оценке влияния генетического полиморфизма на уровень VD представляет ген CYP2R1, однонуклеотидные замены в котором связаны с селективным дефицитом циркулирующей формы VD как в общей популяции [7], так и в группах с различными формами онкологических заболеваний [8].
Целью данной работы явилось исследование содержания VD у женщин с ДЗМЖ в связи с особенностями клинического течения и влияния полиморфизма гена CYP2R1 (rs2060793) на уровень циркулирующей формы VD.
Материал и методы исследования
В исследование включены 247 женщин, не состоящих в кровном родстве, из них 131 – без признаков ДЗМЖ, 116 – больные с диагнозом ДЗМЖ: 40 с ФА и 76 – с диффузной ФКМ. Всем женщинам проведено комплексное обследование: физикальный осмотр и ультразвуковое исследование молочных желез, пациентками старше 40 лет – маммография. Диагноз подтверждался данными пункционной биопсии и результатами гистологического исследования тканей, полученных в результате секторальной резекции молочной железы.
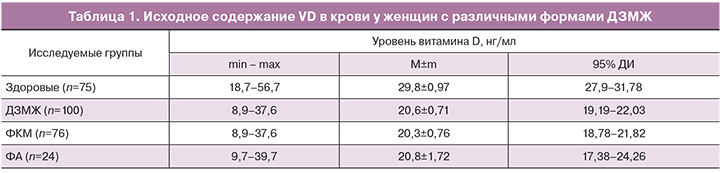
Уровень циркулирующей формы VD сыворотки крови оценивали методом хемилюминесцентного иммуноанализа на микрочастицах (CMIA) системы ARCHITECT 25-OH Vitamin D (Abbott Laboratories, США) у 100 женщин с ДЗМЖ (основная группа) и у 75 здоровых лиц (группа сравнения).
Генотипирование по локусу -1559 Т>С гена CYP2R1 (rs2060793) в образцах ДНК, выделенных из лейкоцитов периферической крови, проводили методом полимеразной цепной реакции в режиме реального времени с использованием TaqMan проб (ООО «СибДНК», г.Новосибирск). Соответствие распределения частот аллелей и генотипов равновесию Харди–Вайнберга (РХВ) оценивали по критерию χ2. Статистический анализ биохимических и клинических данных проводили с использованием SPSS Statistics 20 и Excel 2010.
Результаты исследования
Проведенные исследования показали, что средний возраст женщин с ДЗМЖ составил 36,14±0,91 года, при этом в возрасте до 29 лет было 25% (n=25) больных, от 30 до 39 лет – 31% (n=31), от 40 до 49 лет – 42% (n=42), старше 50 лет – 2% (n=2). Очевидно, что наибольшая частота ДЗМЖ – 75% приходится на возраст от 30 до 50 лет, с максимальной частотой в возрасте 40–49 лет. Анализ гинекологического статуса показал, что практически у каждой третьей пациентки с ДЗМЖ имеется заболевание, сопровождающееся абсолютной или относительной гиперэстрогенией – эндометриоз, миома матки, синдром поликистозных яичников. Наибольшая частота гинекологической патологии (35,5%,) установлена у пациенток с ФКМ. Исходное содержание VD у больных основной группы колебалось от 8,9 до 39,7 нг/мл и в среднем составило 20,61±0,71 нг/мл (табл. 1), что оказалось достоверно ниже, чем у здоровых женщин; при этом различий в обеспеченности между подгруппами женщин с ДЗМЖ в зависимости от нозологической формы обнаружено не было.
Также не было установлено различий в обеспеченности VD в зависимости от возраста пациенток в обеих группах наблюдения. Детальный анализ позволил установить, что для группы женщин без признаков ДЗМЖ характерна наибольшая частота нормального уровня VD – 36% по сравнению с 12% пациенток с мастопатией (табл. 2). При этом только у здоровых женщин зафиксированы уровни VD, превышающие 40 нг/мл – 7 наблюдений (9,3%). Очевидно, что основная масса здоровых находится в зоне недостаточности VD (20–29 нг/мл) – 58,7%, и лишь 5,3% имеют его дефицит (менее 20 нг/мл).
Среди женщин с ДЗМЖ наблюдалась противоположная картина: более половины больных с мастопатией находились в зоне дефицита VD, недостаточность диагностирована в 35% случаев. Таким образом, низкая обеспеченность VD характерна для 88% больных с ДЗМЖ и 64% здоровых женщин. Однако степень недостаточности в этих группах различна: ДЗМЖ сопровождаются глубоким дефицитом VD, который встречается у каждой второй пациентки (табл. 2).

Интересными представляются результаты, полученные при изучении обеспеченности VD в зависимости от времени года (уровня инсоляции). Оказалось, что у здоровых женщин уровень VD достоверно зависит от фактора инсоляции. В период с минимальной инсоляцией он составил 28,4±1,93 нг/мл, с максимальной продолжительностью светового дня – 33,42±2,95 нг/мл (p<0,05). У пациенток же с ДЗМЖ не зарегистрировано достоверной разницы в обеспеченности VD в зависимости от уровня инсоляции: минимальная солнечная инсоляция – 19,42±0,95 нг/мл против 21,81±1,29 нг/мл в период с максимальной солнечной активностью. Изучение особенностей течения заболевания молочных желез выявило зависимость тяжести клинической картины от уровня исходного VD. Пациентки с дефицитом VD (13–20 нг/мл) имели классические клинические проявления ФКМ: выраженный болевой синдром и нагрубание молочных желез, выделения из сосков, более значимые изменения по данным ультразвукового исследования. Ультразвуковая картина характеризовалась наличием множественных крупных кист до 20 мм и более на фоне фиброзных изменений, в анамнезе неоднократные пункции и склерозирование кист, неэффективность длительно проводимой консервативной терапии. Женщины с крупными кистами более 2 см в диаметре имели самый низкий уровень VD – 15,5±1,54 нг/мл. У больных с ФА выраженный дефицит VD сопутствовал рецидивам узловых образований и неоднократным секторальным резекциям молочной железы. Для женщин с недостаточностью VD (20–29 нг/мл) были характерны умеренно выраженные клинические симптомы, волнообразное длительное течение заболевания и неполный эффект проводимой консервативной терапии. Корреляции показали обратную связь выраженности кистозного компонента по данным ультразвуковой картины (r=0,44, р<0,05) и длительности заболевания с уровнем обеспеченности VD в крови (r=0,48, р<0,05). У больных с ФА клиническая картина при дефиците и недостаточности витамина D носила неспецифический характер: чувство дискомфорта и определение уплотнения в молочной железе.
В последние несколько лет появляются данные о генетической детерминанте в содержании уровня VD. В связи с этим нами проведен анализ ассоциации полиморфизма гена CYP2R1, который, по данным ряда полногеномных исследований, оказывает влияние на содержание VD в сыворотке крови у условно здоровых доноров. Одним из полиморфизмов гена является полиморфизм -1559 T>C (находится вблизи промоторной области, rs2060793). Данная нуклеотидная замена не приводит к замене аминокислот, однако расположение вблизи промоторной области может отвечать за контроль уровня выработки фермента, тем самым оказывать эффект на его активность. Носители аллеля С характеризуются сниженными значениями 25(ОН)D3 [9].
При анализе полученных данных, отклонения от равновесия Харди–Вайнберга в распределении частот аллелей и генотипов в исследуемой группе не обнаружено (χ2=0,1364, р=0,7119). Как в группе контроля, так и в группе пациенток с ДЗМЖ, выявлено преобладание (более 80%) генотипов, несущих 1 или 2 полиморфные аллели (гетерозиготный и гомозиготный генотипы TC и CC соответственно). Таким образом, данный полиморфизм не оказывает влияния на генетическую предрасположенность к развитию ДЗМЖ (ОШ 1,17, 95% 0,81–1,69).

При анализе влияния исследованного полиморфизма на уровень циркулирующей формы VD было установлено, что носители одного или двух полиморфных аллелей С в общей популяции характеризуются сниженными значениями витамина D в сыворотке крови по сравнению с носителями гомозиготного генотипа ТТ. Аналогичные тенденции наблюдались и у больных с различными формами ДЗМЖ. Однако при любом варианте генотипа больные женщины имеют достоверно больший дефицит VD, чем здоровые (p<0,05) с сохранением очевидной тенденции к снижению уровня показателя у носителей генотипов ТС и СС (табл. 3).
Таким образом, можно предположить, что исследуемый полиморфизм -1559Т>C гена CYP2R1 не ассоциирован с предрасположенностью к доброкачественным заболеваниям молочной железы, таким как ФКМ и ФА, но носители гетерозиготного и гомозиготного полиморфизма по аллелю С генотипов характеризуются стойким снижением уровня циркулирующей формы VD.
Обсуждение
В коже под действием солнечных лучей образуется холекальциферол. Являясь провитамином, он переходит в биологически активную форму VD в процессе двух реакций гидроксилирования. Первая проходит в печени, где фермент 25-гидроксилаза (CYP27A1), кодируемой геном CYP2R1, образует 25-гидроксихолекальциферол (25-OHD3) – основная циркулирующая форма VD. Именно по ее уровню оценивают обеспеченность VD. Повторное гидроксилирование происходит в почках под влиянием фермента CYP27B1 – альфа-гидроксилазы. Это приводит к образованию биологически активного D-гормона – 1,25-дигидроксивитамина D (1,25OH2D) – кальцитриола. Эта форма VD связывается с рецептором витамина D (VDR) и реализует свои биологические эффекты. При ДЗМЖ концентрация VDR и рецепторов основных регуляторных белков такая же высокая, как и в здоровой молочной железе [10], но обеспеченность VD остается дефицитной и связана с симптомами мастопатии. Генетический полиморфизм гена, регулирующего метаболизм VD, может определять длительность и объемы проводимой заместительной терапии VD. Наличие полиморфизма гена CYP2R1, снижающего его биологическую активность, позволяет предположить, что повышение инсоляции с целью компенсации дефицита VD для данного индивидуума не будет иметь решающего значения ввиду невозможности образования биологически активных форм VD. Для этих женщин значимым источником VD становятся его перорально поступающие формы, при этом низкий уровень VD и зимой, и летом также определяет стратегию длительной поддерживающей терапии VD независимо от уровня круглогодичной инсоляции. Стабильно низкая обеспеченность витамином D, возможно, является одним из факторов стимуляции гиперэстрогении и активности эстрогеновых рецепторов в молочных железах. Так в эксперименте на линии раковых клеток молочной железы мышей показано присутствие VDR и рецепторов к эстрогенам. При этом инъекции кальцитриола и диета, содержащая витамин D, приводили к подавлению эстрогеновых рецепторов и уменьшению опухоли молочной железы [11]. Отсутствие взаимосвязи низкой обеспеченности VD и генетического полиморфизма у пациенток с ФКМ позволяет предположить иные нарушения метаболических путей VD у данной категории пациенток, что требует дальнейшего исследования.
Заключение
В 88% случаев больные с ДЗМЖ имеют низкий уровень содержания VD в крови, при этом у половины из них (53%) установлен дефицит VD. Клиническая и ультразвуковая картины находятся в прямой зависимости от степени обеспеченности VD. Выраженные симптомы заболевания и изменения структуры молочной железы, отсутствие эффекта от проводимой ранее консервативной терапии ассоциированы с глубоким дефицитом VD.
Генетический полиморфизм CYP2R1, определяющий сниженный уровень VD, с одинаковой частотой встречается в популяции здоровых женщин и пациенток с ДЗМЖ. Наиболее низкая обеспеченность VD среди здоровых женщин характерна для гомозиготных носителей аллелей С гена CYP2R1. Больные же с ДЗМЖ имеют стойкое, не связанное с сезоном VD-дефицитное состояние, независимо от варианта генетического полиморфизма CYP2R1.



