В России рак шейки матки занимает третье место по частоте встречаемости после злокачественных новообразований молочной железы и тела матки (https://gco.iarc.fr/today). Отмечается рост удельного веса рака шейки матки в структуре онкологических заболеваний женщин репродуктивного возраста: в 2020 г. распространенность рака шейки матки среди женщин детородного возраста в России составила 21 361 (13,8%) случаев (https://gco.iarc.fr/today). Летальность в течение года с момента постановки диагноза снизилась за 10 лет и составила 16,3% по сравнению с показателем 20,8% в 2004 г. [1].
Несмотря на то что роль вируса папилломы человека (ВПЧ) в развитии злокачественного перерождения цервикального эпителия определена, возникновение патологического процесса невозможно без дополнительных факторов риска, приводящих к изменениям генетического материала клеток, происходящего в результате внедрения генома ВПЧ в геном хозяина [2, 3]. Доказана роль ВИЧ в патогенезе ВПЧ-ассоциированного рака шейки матки [4, 5].
По результатам многочисленных исследований отмечена связь развития рака шейки матки с курением сигарет [6–8], ранним началом половой жизни и большим количеством половых партнеров [9–11], применением гормональных контрацептивов [12, 13], иммуносупрессией [14, 15], травматическим повреждением шейки матки, низким социальным статусом и длительной персистенцией инфекций, передающихся половым путем [16, 17].
В нескольких исследованиях было выявлено, что у женщин с двумя и более абортами или родами в анамнезе риск развития рака шейки матки практически в 5 раз выше, чем в популяции [18]. Тем не менее эта связь не была подтверждена в других исследованиях.
Таким образом, в большом количестве публикаций, отражающих результаты эпидемиологических исследований, отмечается взаимосвязь между развитием рака шейки матки и многими зависящими друг от друга факторами. В этой связи представляется актуальным продолжить изучение особенностей анамнестического и клинического течения заболеваний шейки матки с целью выделения группы риска по развитию предраковых процессов шейки матки и выработки своевременной врачебной тактики.
Ранняя диагностика и эффективное лечение преинвазивных поражений остаются по-прежнему наиболее эффективными способами профилактики рака шейки матки [19–21].
Цель настоящего исследования: изучение факторов риска опухолевой трансформации цервикального эпителия на основании изучения клинико-анамнестических особенностей течения различных патологических процессов шейки матки.
Материалы и методы
В проспективное исследование включены 210 пациенток репродуктивного возраста. В зависимости от наличия изменений на шейке матки, данных цитологического и гистологического исследования, а также тестирования на ВПЧ пациентки были разделены на 5 групп: группа 1 – 37 пациенток с цитологическим заключением «NILM» (интраэпителиальные изменения и злокачественные процессы отсутствуют)+ВПЧ высокого канцерогенного риска (ВКР); группа 2 – 43 пациентки с цитологическим заключением «LSIL» (плоскоклеточное интраэпителиальное поражение низкой степени злокачественности)+ВПЧ ВКР; группа 3 – 46 пациенток с цитологическим заключением «HSIL» (плоскоклеточное интраэпителиальное поражение высокой степени злокачественности)+ВПЧ ВКР; группа 4 – 39 пациенток с цитологическим заключением «NILM», гиперкератозом плоского эпителия и отсутствием ВПЧ; группа 5 (группа сравнения) – 45 женщин с цитологическим заключением «NILM» и отсутствием ВПЧ. Все пациентки, принимавшие участие в исследовании, получили о нем полную информацию и подписали информированное добровольное согласие.
Критерии исключения из исследования: острые воспалительные заболевания органов малого таза; нарушения менструального цикла; вакцинация от ВПЧ; беременность, послеродовый период и лактация; наличие онкологических и аутоиммунных заболеваний; экстрагенитальные заболевания в стадии декомпенсации; прием гормональных препаратов; отказ пациента от участия в исследовании; нарушение протокола исследования.
Проведен сбор паспортных данных, контактной информации, семейного положения, жалоб, эпидемиологического анамнеза, анамнеза жизни, наследственных, перенесенных и хронических заболеваний, оперативных вмешательств, гинекологического и акушерского анамнезов. Гинекологический анамнез включал сведения о возрасте наступления менархе, особенностях менструального цикла, половом дебюте, общем количестве половых партнеров, половой активности, сведения о беременностях и их исходах, гинекологических заболеваниях и операциях, методах контрацепции. Учитывались данные наследственности, наличия аллергии, вредных привычек (употребление алкоголя, наркотических и токсических препаратов, курение). Подробно описывался анамнез заболеваний шейки матки, включая наличие папилломавирусной инфекции, вирусную нагрузку и длительность вирусной персистенции, методы диагностики и лечения заболеваний шейки матки, которые проводились ранее.
Статистический анализ
Статистический анализ проводился с использованием программы StatTech v.2.1.0 (ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50).
Формула расчета критерия Шапиро–Уилка:
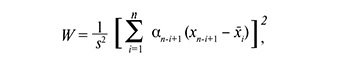
где
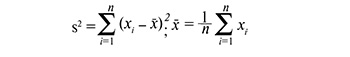
Числитель является квадратом оценки среднеквадратического отклонения Ллойда. Коэффициенты αn-i+1 – известные константы, взятые из таблиц.
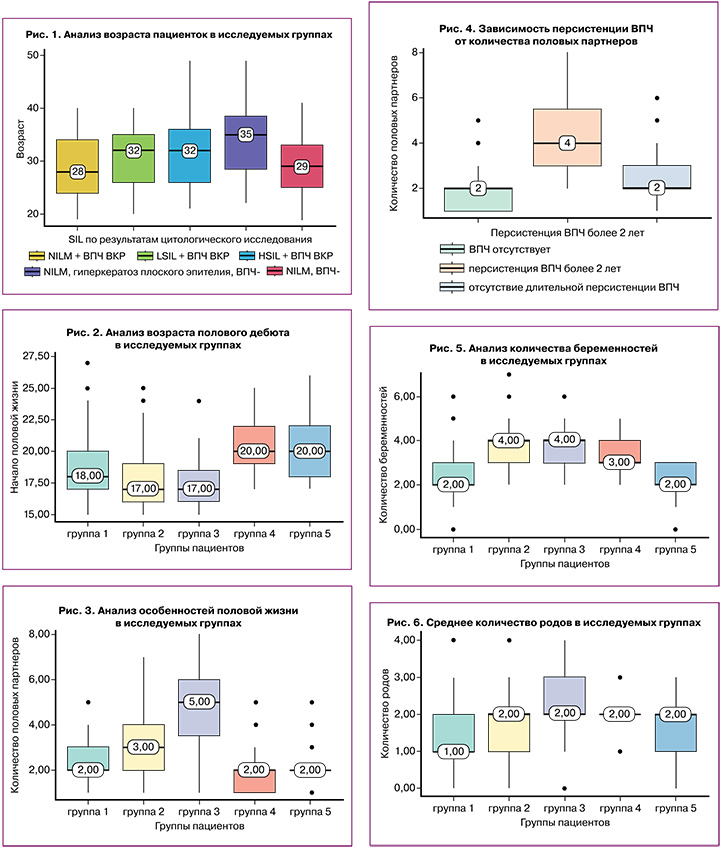
Формула расчета критерия Колмогорова–Смирнова:
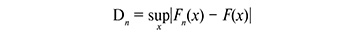
, где хn – выборка независимых одинаково распределенных случайных величин, Fn(х) – эмпирическая функция распределения, F(х) – некоторая «истинная функция» распределения с известными параметрами.
В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение трех и более групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью критерия Краскела–Уоллиса, апостериорные сравнения – с помощью критерия Данна с поправкой Холма.
Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона (при значениях ожидаемого явления более 10).
Направление и теснота корреляционной связи между двумя количественными показателями оценивались с помощью коэффициента ранговой корреляции Спирмена (при распределении показателей, отличном от нормального).
Результаты
При анализе клинико-анамнестических данных все пациентки, принимавшие участие в исследовании, были сопоставимы по возрасту, характеру менструальной функции и частоте экстрагенитальных заболеваний. Медиана возраста обследуемых женщин представлена на рисунке 1.
При антропометрическом исследовании значимых отличий между группами не было выявлено. Ожирение встречалось в 27/210 (12,86%) всех наблюдений: в группе 1 (NILM+ВПЧ ВКР) – 5/37 (13,5%), в группе 2 (LSIL+ВПЧ ВКР) – 8 /43(18,6%), в группе 3 (HSIL+ВПЧ ВКР) – 5/46 (10,9%), в группе 4 (NILM, гиперкератоз плоского эпителия, ВПЧ-) – 4/39 (10,3%), в группе 5 (NILM, ВКР-) – 5/45 (11,1%).
Анализ особенностей половой жизни пациенток показал, что большинство женщин, включенных в исследование, начинали половую жизнь в 17–20 лет. Однако в группах 2 (LSIL+ВПЧ ВКР) и 3 (HSIL+ ВПЧ ВКР) наблюдался более ранний половой дебют, который в среднем составлял 17 лет (p<0,001) (рис. 2).
Среднее количество половых партнеров на момент вступления в исследование: группа 1 (NILM+ВПЧ ВКР) – 2, группа 2 (LSIL+ВПЧ ВКР) – 3, группа 3 (HSIL+ВПЧ ВКР) – 5, группа 4 (NILM, гиперкератоз плоского эпителия, ВПЧ-) – 2, группа 5 (NILM, ВПЧ ВКР-) – 2 половых партнера (рис. 3). По результатам анализа общее количество половых партнеров у пациенток с LSIL и HSIL статистически больше, по сравнению с остальными группами; при этом тяжесть интраэпителиальных поражений зависела от количества половых партнеров (p<0,001).
По результатам исследования, длительность персистенции ВПЧ также зависела от количества половых партнеров: у пациенток с длительной персистенцией ВПЧ в среднем в анамнезе было больше половых партнеров (Me=4), по сравнению с пациентками, у которых отсутствовал ВПЧ по результатам полимеразной цепной реакции или с длительностью инфекции менее 2 лет (Me=2) (p<0,001) (рис. 4).
При анализе акушерского анамнеза были выявлены статистически значимые различия: наибольшее количество беременностей наблюдалось в группах пациенток с LSIL и HSIL и в среднем составляло 4 беременности (рис. 5). Степень тяжести интраэпителиальных поражений не зависела от количества беременностей (p>0,05). Наименьшее количество беременностей в анамнезе наблюдалось в группах 1 и 5 с нормальной цитологической картиной и в среднем составляло 2 беременности (p<0,001).
Наибольшее количество родов выявлялось в группе 3 (HSIL+ВПЧ ВКР) и в среднем было больше 2 (p=0,001) (рис. 6).
Среднее количество абортов в анамнезе было наибольшим в группах 2 (LSIL+ВПЧ ВКР) и 3 (HSIL+ВПЧ ВКР) и составляло 2 аборта (рис. 7). В группах пациенток с плоскоклеточными интраэпителиальными поражениями выявлено статистически больше абортов в анамнезе относительно групп пациентов с нормальной цитологической картиной независимо от наличия ВПЧ (p<0,001). Однако по результатам анализа степень интраэпителиальных поражений не зависела от количества абортов в анамнезе. Согласно результатам анализа, среднее количество абортов в группе пациенток с лейкоплакией шейки матки (группа 4) статистически не отличалось от группы пациенток без патологических изменений шейки матки (группа 5) (p>0,05).
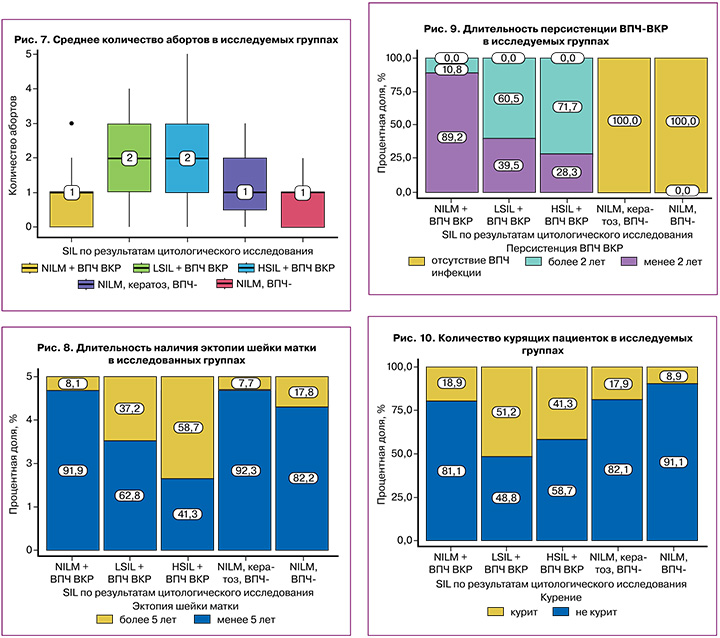
По данным гинекологического анамнеза эктопия шейки матки более 5 лет значимо чаще выявлялась в группах 2 (LSIL+ВПЧ ВКР) и 3 (HSIL+ВПЧ ВКР) – 16/43 (37,2%), 27/46 (58,2%) случаев соответственно (рис. 8). В группе пациенток с HSIL наиболее часто выявлялась эктопия шейки матки более 5 лет (p<0,001).
По результатам исследования персистенция ВПЧ ВКР в цервикальном эпителии более 2 лет выявлена в 59/89 (66,3%) случаях плоскоклеточных интраэпителиальных поражений: в группе 2 (LSIL+ВПЧ ВКР) – 26/43 (60,5%) и в группе 3 (HSIL+ВПЧ ВКР) – 33/46 (71,7%) (рис. 9).
У пациенток с ВПЧ и плоскоклеточными интраэпителиальными поражениями шейки матки значимо чаще встречалось сочетание эндометриоза, миомы матки, гиперплазии эндометрия и доброкачественной дисплазии молочной желез относительно группы сравнения. Эндометриоз наиболее часто диагностировался у пациенток с дисплазией шейки матки, однако частота встречаемости не зависела от степени интраэпителиального поражения: группа 2 (LSIL+ВПЧ ВКР) – 29/43 (67,5%), группа 3 (HSIL+ВПЧ ВКР) – 27/46 (58,7%).
Частота обнаружения миомы матки при ультразвуковом исследовании органов малого таза также была наивысшей в группах 2 и 3 и составила соответственно 14/43 (32,6%) и 19/46 (41,3%).
При проведении ультразвукового исследования молочных желез у пациенток с дисплазией шейки матки чаще выявлялась доброкачественная дисплазия молочных желез: группа 1 (NILM+ВПЧ ВКР) – 0 (0%), группа 2 (LSIL+ВПЧ ВКР) – 8/43 (18,6%), группа 3 (HSIL+ВПЧ ВКР) – 12/46 (26,1%), группа 4 (NILM, гиперкератоз плоского эпителия, ВПЧ-) – 5 /39(12,8%), группа сравнения (NILM, ВПЧ-) – 1/45 (2,2%) пациенток.
Вероятно, можно предположить повышенный пролиферативный потенциал, устойчивость к апоптозу, увеличение ароматазной активности, активацию реакций оксидативного стресса и воспаления у женщин с плоскоклеточными интраэпителиальными поражениями.
Систематическое употребление табака более 5 лет отмечено у 59/210 (28,1%) обследованных, 43/210 (20,47%) пациента бросили курить, 63/210 (30%) – редко курят кальян или сигареты. Наибольшее количество курящих пациентов выявлено в группах с плоскоклеточными интраэпителиальными поражениями: в группе 2 (LSIL+ВПЧ ВКР) – 22/43 (51,2%) и в группе 3 (HSIL+ВПЧ ВКР) – 19/46 (41,3%) пациенток (p<0,001) (рис. 10). Ни одна участница исследования не злоупотребляла алкоголем и не употребляла наркотики. Злоупотреблением алкоголем считалось употребление 30 г и более чистого спирта в день 2–3 раза в неделю и чаще.
Гормональной контрацепцией пользовались 36/210 (17,1%) пациенток: в группе 1 (NILM+ВПЧ ВКР) – 11/37 (29,7%), в группе 2 (LSIL+ВПЧ ВКР) – 8/43 (18,6%), в группе 3 (HSIL+ВПЧ ВКР) – 5/46 (10,9%), в группе 4 (NILM, гиперкератоз плоского эпителия, ВПЧ-) – 4/39 (10,3%), в группе 5 (NILM, ВПЧ ВКР-) – 8/45 (17,8%). Согласно результатам проведенного анализа, нам не удалось установить статистически значимых различий между группами (p=0,148).
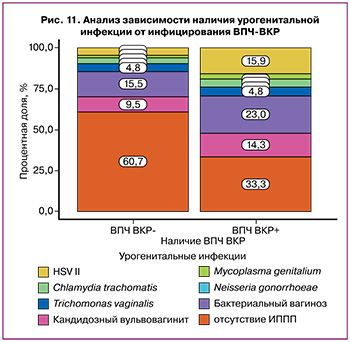
В исследуемых группах относительно часто встречались урогенитальные инфекции. Вирус простого герпеса 2 типа выявлялся у 3/37 (8,1%) пациенток с NILM+ВПЧ ВКР, у 9/43 (20,9%) пациенток с LSIL, у 8/46 (17,4%) пациенток с HSIL, у 1/39 (5,1%) пациентки с лейкоплакией шейки матки и у 2/45(4,4%) пациенток группы сравнения. Бактериальные инфекции (Mycoplasma genitalium, Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis) выявлены в 25/210 (11,9%) случаях, из них смешанные бактериально-вирусные инфекции – в 17/25 (68%). Бактериальный вагиноз выявлялся в 42/210 (20%) случаях: у 5/37 (13,5%) пациенток с NILM+ВПЧ ВКР, у 9/43 (20,9%) пациенток с LSIL, у 15/46 (32,6%) пациенток с HSIL, у 9/39 (23,1%) пациенток с лейкоплакией шейки матки и у 4/45 (8,9%) пациенток группы сравнения.
Также мы провели анализ зависимости наличия урогенитальных инфекций от инфицирования ВПЧ-ВКР (рис. 11). Половые инфекции статистически чаще встречались у пациенток, инфицированных ВПЧ-ВКР (p<0,012).
Обращает на себя внимание, что у каждой третьей пациентки с LSIL+ВПЧ ВКР (37,3%) и более чем в половине случаев наблюдений женщин с HSIL+ВПЧ ВКР (58,2%) в анамнезе имела место эктопия шейки матки более 5 лет. В этой связи логично предположить, что риск развития предраковых заболеваний и рака шейки матки увеличивает незавершенный процесс эпителизации эктопии.
Заключение
Таким образом, проведенный нами анализ анамнестических данных и особенностей клинического течения патологических процессов шейки матки еще раз подтвердил значение определенных факторов в развитии и прогрессировании опухолевой трансформации цервикального эпителия. При оценке факторов риска озлокачествления заболеваний шейки матки необходимо учитывать не только факт наличия инфицирования ВПЧ, но и анамнестическую давность первичного диагноза, возраст полового дебюта, количество половых партнеров, наличие инфекций, передаваемых половым путем, и курение.



