Преэклампсия (ПЭ) у беременных является одной из актуальных проблем в акушерстве; тяжелые формы ПЭ занимают 2-е место в мире и 4-е место в Российской Федерации в структуре материнской смертности [1]. Умеренная ПЭ выявляется у 3–8% беременных во 2-й половине гестации; у 1–2% пациенток ПЭ приобретает тяжелое течение, ухудшая перинатальные исходы, осложняя течение родов и послеродового периода [2]. Клиническое течение ПЭ в настоящее время характеризуется целым рядом особенностей, которые приводят к затруднениям в своевременной постановке диагноза и выборе правильной тактики ведения пациентки. В большом числе наблюдений имеет место нетипичная клиническая симптоматика, вплоть до развития клинических «масок» хирургической патологии (деструктивного острого панкреатита, панкреонекроза, острой дистрофии печени), почечной недостаточности без выраженной гипертензии, геморрагического синдрома, пневмоний и плевропневмоний, перипартальной миокардиодистрофии, лихорадки «неясной этиологии», преходящих нарушений мозгового кровообращения без гипертензивного синдрома [3]. Эти заболевания встречаются относительно редко, их проявления практически идентичны, все они могут имитировать тяжелую ПЭ, но терапевтические подходы к ведению таких пациенток различаются [4].
Известно, что эндотелиальная дисфункция, приводящая к нарушению проницаемости сосудов и системному воспалительному ответу, является важнейшей составляющей патогенеза ПЭ. Вследствие формирования системного воспалительного ответа изменяется функциональная активность лейкоцитов, усиливается экспрессия молекул адгезии, стимулируется миграция клеток в зону воспаления [5, 6]. Ранее нами было выявлено, что у беременных уровень экспрессии молекул клеточной адгезии лейкоцитов, участвующих на этапе трансэндотелиальной миграции, имеет некоторые отличия при различных видах гипертензивных расстройств [7]. Так, по нашим данным при эссенциальной гипертензии достоверно повышался уровень CD99-позитивных нейтрофилов, в то время как при ПЭ возрастал уровень нейтрофилов, экспрессирующих молекулы CD49b [7, 8]. Вероятно, характер экспрессии нейтрофилами молекул поздних этапов адгезии определяется особенностями патогенетических механизмов формирования различных форм гипертензии у беременных. Однако в любом случае связывание нейтрофилов с адгезивными молекулами эндотелия сосудов способно стимулировать респираторный взрыв [9], вызывая повреждение окружающих тканей и усугубляя эндотелиальную дисфункцию сосудов.
Вследствие развития эндотелиальной дисфункции происходит деструкция эндотелиальных клеток, что сопровождается появлением в циркулирующей крови множества маркеров активации эндотелия: тромбоксана А2, эндотелина 1, простациклина, фактора Виллебранда, фибронектина, эндотелиального релаксирующего фактора, клеток эндотелия [10, 11]. По данным литературы маркером таких деструктивных процессов при преэклампсии служит увеличение количества циркулирующих десквамированных эндотелиоцитов (ДЭ) в системном кровотоке, их уровень в крови коррелирует со степенью выраженности клинических проявлений ПЭ, что может выступать в качестве маркера степени тяжести данного осложнения беременности [11, 12].
Несмотря на пристальное внимание к проблеме ПЭ во всем мире, остается много спорных вопросов в диагностике данной патологии, а проведение дифференциальной диагностики данного осложнения беременности представляется крайне важным и зачастую определяющим прогноз мероприятием.
Целью исследования стало выявление дополнительных критериев диагностики тяжелой ПЭ у беременных женщин на основании изучения экспрессии моноцитами и нейтрофилами венозной крови молекул раннего этапа адгезии, рецепторов хемокинов и маркеров эндотелиальной дисфункции.
Материал и методы исследования
На базе акушерской клиники ФГБУ Ивановский НИИ материнства и детства им. В.Н. Городкова Минздрава России обследованы 150 женщин в сроке беременности 22–36 недель с ПЭ различной степени тяжести – основная группа; 1-ю подгруппу составили 74 пациентки с умеренной ПЭ (код по МКБ-Х О14.0), 2-ю – 76 женщин с тяжелой ПЭ (код по МКБ-Х О14.1). В группу контроля вошли 70 пациенток с физиологическим течением беременности. Критериями исключения стали: вторичная (симптоматическая) артериальная гипертензия (коды по МКБ-Х О10.1, О10.2, О10.3, О10.4), хроническая артериальная гипертензия (ХАГ) (код по МКБ-Х О10.0), преэклампсия на фоне ХАГ (код по МКБ-Х О11), гестационная артериальная гипертензия (код по МКБ-Х О13), острые и обострение хронических воспалительных заболеваний, аллергические реакции на момент обследования, опухоли различной локализации, системные заболевания соединительной ткани, хроническая почечная недостаточность.
Диагноз ПЭ выставлялся согласно клиническим рекомендациям (протоколу лечения) «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» (2016 г.).
Материалом для исследования являлась периферическая венозная кровь. Определение содержания моноцитов и нейтрофилов, экспрессирующих молекулы адгезии, проводили методом проточной цитофлуориметрии на приборе FACSCanto II (Becton Dickinson, США). В нейтрофильном (CD14-CD45+) и моноцитарном (CD14+CD45+) гейтах определяли относительное содержание клеток, экспрессирующих молекулы адгезии CD62L (L-селектин), CD11b (β2-интегрин), и рецепторы хемокинов CCR2 (рецептор MCP-1, хемоаттрактанта моноцитов), CX3СR1 (рецептор фракталкина). Определяли количество ДЭ в периферической крови (кл/мкл) по методу J. Hladovec при помощи фазово-контрастной микроскопии с использованием аппарата МИКМЕД-1 (Россия) и подсчетом количества клеток эндотелия в камере Горяева.

Статистический анализ полученных данных осуществлялся с помощью методов вариационной статистики в пакете прикладных лицензионных программ Microsoft Office 2010, Statistica for Windows 6.0., MedCalc 7.4.4.1. Количественное описание величин проводилось с помощью среднего арифметического и стандартной ошибки среднего (M±m) (нормальное распределение) и в виде медианы с указанием 25-го и 75-го перцентилей (Ме, С25–С75) (если распределение отличалось от нормального). Достоверность различий между показателями оценивалась с использованием критериев Стьюдента, Фишера и Манна–Уитни (уровень значимости р<0,05 считался достоверным). Для оценки диагностической значимости исследуемых показателей применялся ROC-анализ. Расчет значений относительного риска – ОР, доверительного интервала – ДИ при уровне значимости 95%, осуществлялся с применением системы OpenEpi.
Результаты и обсуждение
Средний возраст пациенток с ПЭ различной степени тяжести был сопоставим с беременными группы контроля (28 (25–33) лет и 27 (24–31) лет соответственно, р=0,07) и не различался в группах с умеренной и тяжелой ПЭ (р=0,45). Однако отмечено достоверно большее число обследованных в возрасте старше 36 лет, у которых при беременности развилась тяжелая ПЭ (р=0,03 по сравнению с контролем), относительный риск при этом составил 3,4 (ДИ=1,1–12,6). Различий в социальном статусе обследованные женщины не имели, все получили среднее или высшее образование, большинство из них состояли в браке и являлись служащими (р>0,05 во всех случаях). В структуре экстрагенитальной патологии обращала на себя внимание более высокая частота встречаемости хронического пиелонефрита и мочекаменной болезни у пациенток с ПЭ относительно группы контроля (р<0,05 во всех случаях), наличие этих заболеваний повышало риск развития тяжелой ПЭ в 4,8 раза (ДИ=1,7–15,1) и 10,4 раза (ДИ=1,3–83,9) соответственно. Наследственность, отягощенная по гипертонической болезни, в незначительном проценте случаев наблюдалась в группе с ПЭ и в контрольной группе (30,5 и 22,9% соответственно, р=0,31). Гипертензивные расстройства при предыдущих беременностях чаще встречались в основной группе по сравнению с контрольной (р=0,001) у пациенток как с умеренной, так и с тяжелой ПЭ. Более половины обследованных женщин основной и контрольной групп были первородящими (р=0,52). Однако у пациенток с ПЭ в анамнезе чаще фигурировали перинатальные потери и самопроизвольные выкидыши в ранние сроки беременности (р=0,01 во всех случаях). Наличие выкидыша в анамнезе увеличивало риск развития тяжелой ПЭ в 3,1 раза (ДИ=1,1–10,1). В структуре гинекологической патологии у пациенток с ПЭ по сравнению с контрольной группой наблюдалась высокая частота миомы матки (р=0,001), относительный риск развития тяжелой ПЭ при наличии этой патологии повышался в 6,4 раза (ДИ=1,4–29,6). Индекс массы тела выше 30 при постановке на учет в женскую консультацию имели достоверно большее количество женщин основной группы по сравнению с контрольной (р=0,001), при этом относительный риск развития тяжелой ПЭ повышался в 2,4 раза (ДИ=1,1–7,3). Среднее артериальное давление (АД) при постановке на учет составило 84,8±0,8 мм рт. ст. у беременных основной группы, и 78,5±0,6 мм рт. ст. в группе контроля (р=0,001). Исходное диастолическое АД выше 80 мм рт. ст. достоверно чаще было зафиксировано у пациенток, беременность которых осложнилась ПЭ, чем в отсутствии таковой (р=0,01), причем в подгруппе с тяжелой ПЭ этот признак встречался чаще, чем при умеренной ПЭ (р=0,02). Относительный риск развития тяжелой ПЭ при исходном диастолическом АД выше 80 мм рт. ст. составил 5,4 (ДИ=1,5–19,9). При поступлении в стационар на момент обследования уровень среднего АД при ПЭ тяжелой степени составил 116,1±0,9 мм рт.ст., при умеренной – 110,1±0,7 мм рт. ст. и при физиологической беременности – 86,3±0,6 мм рт. ст. (р=0,001 во всех случаях). Уровень протеинурии при поступлении в стационар у женщин с ПЭ был достоверно выше, чем в контрольной группе (р=0,001), и при ее тяжелой степени составил 3,01±0,3 г/л, а при умеренной ПЭ – 1,1±0,2 г/л (р=0,0001). Пациентки с ПЭ чаще были родоразрешены досрочно, в сроке 33,8±0,4 недели гестации, а женщины группы контроля – в сроке 39,2±0,1 недели (р=0,001). Срок родоразрешения беременных с тяжелой ПЭ составил в среднем 32,7±0,4 недели, а с умеренной – 35,1±0,3 недели (р=0,001). Дети, рожденные от матерей с ПЭ, достоверно чаще по сравнению с контрольной группой рождались в состоянии неонатальной депрессии, с признаками гипотрофии, поэтому чаще переводились на лечение в отделение детской реанимации (р<0,05 во всех случаях).

При анализе полученных данных изменения в содержании клеток, экспрессирующих молекулы ранних этапов адгезии, были выявлены только в популяции нейтрофилов. Так, при ПЭ достоверно снижалось относительное содержание CD62L+ нейтрофилов (р=0,01), а содержание CD11b+ нейтрофилов повышалось по сравнению с женщинами контрольной группы (р=0,04) (таблица).
Оценка изученных показателей при умеренной и тяжелой ПЭ показала, что уровень нейтрофилов, экспрессирующих молекулы CD11b, не различался у пациенток с различной степенью тяжести ПЭ (р>0,05 во всех случаях). Однако беременные в группе с тяжелой формой ПЭ имели достоверно более низкое содержание CD62L+ нейтрофилов как по сравнению с группой контроля (р=0,01), так и по сравнению с беременными, имеющими умеренную ПЭ (р=0,04).
Показатели относительного содержания моноцитов венозной крови, экспрессирующих молекулы ранних этапов адгезии (CD62L, CD11b), в группах женщин с ПЭ, умеренной и тяжелой ПЭ не имели достоверных различий по сравнению с группой контроля (р>0,05 во всех случаях). Также не обнаружено достоверной разницы в данных показателях при различной степени тяжести ПЭ (р>0,05).
Исследования последних лет свидетельствуют о том, что развитие гипертензии у беременных инициируется эндотелиозом, который способствует усилению проницаемости монослоя эндотелия для лейкоцитов [13]. В ряде работ было показано, что при ПЭ в толще эндотелия, в интиме и в мышечном слое сосудов значительно повышается уровень нейтрофилов, но инфильтрация этих структур моноцитами не отличается от таковой при неосложненной беременности [14, 15]. Вероятно, эндотелиоз и сосудистая инфильтрация при ПЭ у беременных в меньшей степени опосредована пулом моноцитов, а осуществляется в основном нейтрофилами.
Контактное взаимодействие L-селектина (CD62L) с соответствующими лигандами на эндотелии обеспечивает распластывание клеток по поверхности эндотелиоцитов. Отмеченное нами снижение содержания CD62L+ нейтрофилов при тяжелой ПЭ могло вызываться, как истинным уменьшением уровня таких клеток, так и быстрым рекрутированием CD62L-позитивных клеток из свободного кровотока. Последнее предположение представляется более вероятным, так как по данным других исследователей у беременных с ПЭ отмечается увеличение растворимой формы L-селектина в сыворотке периферической крови [16, 17]. Повышение сывороточного уровня молекул L-селектина у женщин с ПЭ может происходить за счет элюции молекул CD62L с клеточной мембраны после взаимодействия с соответствующим лигандом эндотелия [18], под влиянием возрастающего при ПЭ уровня медиаторов воспаления [19] или при воздействии на клетки ангиотензина-II [20].
Активированные нейтрофилы при плотном взаимодействии с клетками эндотелия продуцируют факторы воспаления (интерлейкины, фактор некроза опухоли (TNF)-α, активные формы кислорода, тромбоксан, миелопероксидазы и др.), которые могут способствовать развитию эндотелиоза и гемореологических нарушений [9, 14]. В нашем исследовании в периферической крови женщин с ПЭ было выявлено незначительное повышение уровня CD11b+ нейтрофилов, по данным литературы для этого осложнения беременности характерно повышение экспрессии клетками эндотелия молекул ICAM-1, которые являются лигандами для данного интегрина [21]. Возможно, при ПЭ плотное присоединение нейтрофилов к эндотелию определяется активированным состоянием самих эндотелиальных клеток. Взаимодействие экспрессируемых клетками хемокиновых рецепторов с хемокинами, продуцируемыми в зоне поражения, является одним из ключевых механизмов воспаления. Этот процесс регулирует мобилизацию определенных популяций лейкоцитов в поврежденные ткани сквозь стенку сосуда, под воздействием хемокинов, содержащихся в эндотелии и периваскулярном пространстве [9].
При изучении параметров хемотаксиса нейтрофилов и моноцитов венозной крови у пациенток с ПЭ мы установили, что показатели содержания CCR2+ клеток в исследуемых популяциях лейкоцитов у пациенток с ПЭ, с умеренной и тяжелой ПЭ не имели значимых различий с показателями контрольной группы (р>0,05 во всех случаях) (таблица).
Значения относительного содержания CX3CR1+ клеток в популяции периферических моноцитов в группе с ПЭ не имели статистически значимых отличий от показателей в контрольной группе (p>0,05 во всех случаях). В тоже время в популяции нейтрофилов уровень CX3CR1+ клеток был достоверно более низким в группах женщин с ПЭ, умеренной и тяжелой ПЭ по сравнению с аналогичным показателем в контрольной группе (p=0,001, p=0,001, p=0,04 соответственно). Отличительной чертой группы женщин с тяжелой формой ПЭ было достоверно более высокое относительное содержание CX3CR1+ моноцитов и нейтрофилов по сравнению с показателями женщин с умеренной ПЭ (p=0,04 в обоих случаях).
Ранее нами было показано, что сывороточный уровень фракталкина достоверно повышается при развитии ПЭ [22]. Его продукция стимулируется при воздействии воспалительных цитокинов TNFα, интерферона (IFN)γ и интерлейкина (IL)-1 [23], уровень которых значительно повышается при ПЭ [24]. CX3CL1 синтезируется в виде мембранно-связанной молекулы, представленной на муцин-подобном стебле. Эта форма фракталкина опосредует прямой захват циркулирующих лейкоцитов и поддерживает интегрин-независимую лейкоцитарную адгезию [25]. Расщепление основания этого стебелька протеазой, а именно TNFα-превращающим ферментом, генерирует растворимый хемокин, которые функционируют в качестве мощного хемокина клеток-мишеней [26].
Так же как и при оценке экспрессии лейкоцитами молекул CD62L, нельзя сделать однозначных выводов и о значимости более высокого уровня CX3CR1 нейтрофилов и моноцитов в патогенезе тяжелой формы ПЭ. С одной стороны взаимодействие CX3CL1-CX3CR1 заметно увеличивает сродство клеток с молекулами интегринов, что приводит к гораздо более плотной адгезии. Установлено, что ко-экспрессия CX3CL1 и лигандов интегринов, таких как фактор межклеточной адгезии ICAM-1 и молекулы сосудистой адгезии VCAM-1, обеспечивает значительное усиление клеточной адгезии по сравнению с моно взаимодействием каждого лиганда с соответствующим рецептором [27]. С другой стороны, возможно, сочетание высокого уровня растворимого фракталкина и усиление экспрессии его рецепторов моноцитами и нейтрофилами удерживают часть активированных клеток в системном кровотоке, способствуя развитию системной воспалительной реакции.
При анализе данных о содержании ДЭ в венозной крови у женщин исследуемых групп было выявлено, что их уровень был достоверно выше у пациенток с ПЭ по сравнению с группой контроля (12 (8–18) кл/мкл и 4 (3–6) кл/мкл соответственно, р=0,0001), при этом при ПЭ тяжелой степени данный показатель был значительно выше, чем при умеренной (14 (9,5–22) кл/мкл и 9 (6–16) кл/мкл
соответственно, р=0,04). ДЭ – непосредственный наиболее специфический маркер повреждения внутренней выстилки сосудов. Слущивание в кровь эндотелиальных клеток происходит в определенном количестве и в физиологических условиях, и, как правило, не превышает 4×104 клеток в 1 мл крови. Повышение содержания ДЭ в крови беременных с гипертензивными расстройствами отражает сам процесс эндотелиоза, обусловленный воздействием эндотоксинов, супероксидных радикалов, гомоцистеина, гистамина и других повреждающих факторов [12]. В литературе имеются указания на увеличение циркулирующих эндотелиоцитов при гипертензивных расстройствах у беременных [11]. Полученные нами данные о повышении уровня ДЭ при тяжелой ПЭ свидетельствуют о том, что проявления эндотелиоза усиливаются при тяжелой форме данного осложнения, что создает условия для нарушения барьерного слоя эндотелия и появления межклеточных щелей с повышением проницаемости эндотелиального монослоя [28].
Проведенный ROC-анализ выявил наиболее точные, чувствительные и специфичные критерии диагностики тяжелой ПЭ. Одним из маркеров тяжелой ПЭ стал показатель относительного содержания CD62L+ нейтрофилов венозной крови (AUC=0,852, чувствительность – 81,5%, специфичность – 88,9%, пограничное значение – 57%) (рис. 1).
Так, относительное содержание CD62L+ нейтрофилов в венозной крови у беременных равное 57% и менее позволяет диагностировать тяжелую ПЭ, а значение показателя более 57% соответствует диагностическому критерию умеренной ПЭ. На основании данного пограничного значения был разработан «Способ диагностики тяжелой преэклампсии» (Патент № 2587781 от 27.05.2016).
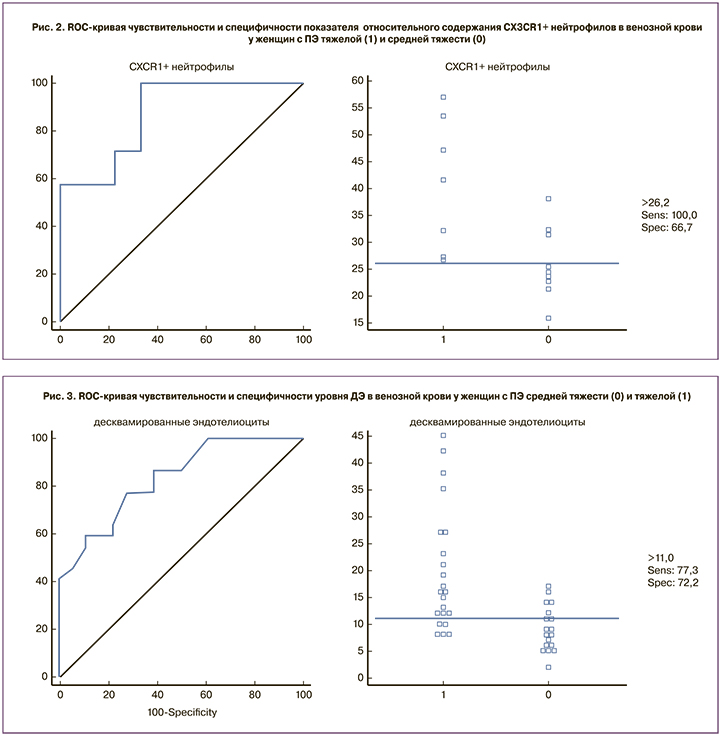
Другим информативным критерием тяжелой ПЭ стал показатель относительного уровня нейтрофилов, экспрессирующих рецепторы к фракталкину (CX3CR1) (AUC=0,873, точность 81,2%, чувствительность – 100,0%, специфичность – 66,7% пограничное значение – 26,2%) (рис. 2).
При этом значение показателя более 26,2% соответствует диагностическому критерию тяжелой ПЭ, при уровне его равном или менее 26,2% тяжесть ПЭ определяется как умеренная.
Также критерием степени тяжести ПЭ стал показатель содержания ДЭ (AUC=0,830, чувствительность – 77,3% и специфичность – 72,2%, пограничное значение – 11 кл/мкл) (рис. 3).
При уровне ДЭ более 11 кл/мкл диагностируется тяжелая ПЭ, при значении равном 11 кл/мкл и менее – умеренная ПЭ.
Заключение
Выявленные пограничные критерии содержания CD62L+ нейтрофилов, нейтрофилов, экспрессирующих рецепторы к фракталкину и ДЭ в венозной крови беременных женщин с ПЭ, могут служить дополнительными диагностическими критериями при определении тяжести этого грозного осложнения гестации, что позволит своевременно выбрать адекватную тактику ведения данной категории пациенток.



