Бесплодие в паре является чаще всего мультифакторной проблемой, включающей как клинико-биологические аспекты, так и генетические и психологические факторы. Продолжительность сна, уровень психологического и физического стресса могут играть определенную роль в имплантации эмбриона и в успешности беременности [1]. Нарушение ритмов биологических часов индуцирует сомнологические нарушения, развитие депрессивных состояний [2]; негативно влияет на репродуктивную функцию, индуцируя субфертильность [3]. В качестве хронотерапии, регулятора циркадных ритмов возможно применение экзогенного мелатонина как биологически ценного вещества, имеющего высокий профиль безопасности [4, 5]. Помимо системного эффекта мелатонина как фактора регуляции сна и бодрствования человека, выявлено, что его уровень в фолликулярной жидкости коррелирует с уровнями антимюллерова и фолликулостимулирующего гормона и может являться критерием овариального резерва [6–8]. Установлено, что мелатонин участвует в процессе фолликулогенеза: синтезируется интрафолликулярно, диффундирует в клетки кумулюса и ооциты, защищая их от окислительного повреждения [9]; установлена положительная связь между концентрацией мелатонина и диаметром фолликула [10]. Данный индол способен снижать процессы клеточного апоптоза, уменьшать рекрутирование лейкоцитов в области разрыва фолликула [11], поддерживать морфологию ооцитов после овуляции, ингибировать интенсивность постовуляторного старения [12], защищать ДНК ооцитов от окислительного повреждения и клеточной дегенерации [13]. Отмечено положительное влияние мелатонина на качество оплодотворения в виде повышения потенциала оплодотворения, поддержания специфического расположения и уровня белков-регуляторов оплодотворения [14], снижения активных форм кислорода, ингибирования процессов апоптоза как в процессе оплодотворения, так и культивирования эмбрионов [8]. Положительное влияние мелатонина на эмбриональное развитие частично объясняется его антиоксидантными свойствами, обеспечивающими снижение апоптоза среди бластоцист, повышение качества имплантации [14–17]. Понимание интрафолликулярных процессов, определение их биохимических механизмов действия на качество гамет и, как следствие, качество эмбрионов лежат в основе разработки схем метаболической коррекции в целях повышения клинической эффективности программ экстракорпорального оплодотворения (ЭКО). В связи с этим в ряде исследований рассматривается возможность применения экзогенного мелатонина в качестве метаболического компонента, улучшающего фертильность [18].
Цель данного исследования: оценить клиническую эффективность преконцепционной подготовки с включением экзогенного мелатонина в программах ЭКО.
Материалы и методы
Проведено нерандомизированное контролируемое исследование женщин, участвующих в программах ЭКО [19]. На первом этапе была сформирована группа наблюдения на основании критериев включения и невключения, а также диагностированного дефицита сна и повышенного уровня стрессорных реакций путем проведения психологического тестирования с использованием валидного опросника. У всех женщин проанализирована клинико-анамнестическая характеристика, проведено обследование в рамках приказа Минздрава России, 2020 [20], выявлены повышение уровня стресса, недостаточность физиологической потребности в сне.
Критерии включения в исследование: возраст женщин от 22 до 36 лет, первичное и вторичное женское бесплодие трубного и неясного генеза (N97.1 и N97.8 по классификации МКБ-10), достаточный овариальный резерв (1 и 2 группа Poseidon, 2016) [21], нарушение сна и повышенный уровень стрессорных реакций. Критерии невключения: возраст женщины более 36 лет, сниженные параметры овариального резерва (3 и 4 группы Poseidon, 2016) [21], бесплодие, связанное с отсутствием овуляции, с мужским фактором, а также маточного генеза (N97.0; N97.4; N97.2 по МКБ-10); женщины, не имевшие сомнологических и стрессовых нарушений, имевшие противопоказания к назначению препарата мелатонина в соответствии с инструкцией по его применению.
Была сформирована группа из 84 женщин с установленным диагнозом женского бесплодия. На втором этапе исследования случайным образом женщины были разделены на две группы. Группу 1 составили 39 пациенток, которым в течение 3 месяцев применялась преконцепционная подготовка в рамках клинического протокола МАРС [22]: за месяц до старта овариальной стимуляции начинался прием препарата мелатонина в дозе 3 мг перорально за 40 минут до сна. Применение экзогенного мелатонина основывалось на показаниях к применению препарата и информированном добровольном согласии. Группу 2 составили 45 пациенток, не получавших в преконцепционной подготовке препарат мелатонина.
Оценка эффективности использования мелатонина осуществлялась на основании результатов проведения протокола овариальной стимуляции, сравнительной оценки концентраций мелатонина в фолликулярной жидкости, мониторинга этапа культивации эмбрионов, определения генетического статуса эмбрионов.
Всем женщинам был проведен протокол овариальной стимуляции с использованием антагонистов гонадотропин-рилизинг-гормона [23]. Определение уровня мелатонина в фолликулярной жидкости осуществлялось методом ELISA. Проводилась морфологическая оценка ооцитов, оплодотворения; морфологическое качество эмбрионов определялось по классификации Гарднера [24]. Преимплантационное генетическое тестирование эмбрионов на анеуплоидии проводилось методом секвенирования следующего поколения (NGS, Next Generation Sequencing).
На 3-м этапе проанализирована частота наступления беременности в цикле стимуляции и в цикле криопереноса. Через 10 дней после переноса эмбриона препарат мелатонина был отменен в группе 1. На 14-e сутки после переноса эмбриона в полость матки оценивался уровень хорионического гонадотропина человека (β-ХГЧ).
Исследование выполнено в соответствии с этическими принципами и было утверждено локальным Этическим комитетом ФГБОУ ВО УГМУ Минздрава России (протокол № 8 от 19 октября 2018 г.).
Статистический анализ
При статистическом анализе использовали пакет прикладных статистических программ STATISTICA, версия 10.0 (StatSoft Inc, Original Articles США), Medcalc. Для описания количественных параметрических переменных рассчитывались среднее значение (М), стандартное отклонение (SD), параметрических и непараметрических переменных – медиана (МЕ) с расчетом 10, 25, 75 и 90‰. Все ряды переменных данных проверялись на нормальность распределения с помощью критерия Шапиро–Уилка. При сравнительном анализе независимых параметрических переменных использовали критерий Стьюдента, непараматерических переменных – критерий Манна–Уитни. При сравнительном анализе качественных номинальных переменных использовали критерий χ2 Пирсона в случае наличия в ячейках таблиц сопряженности чисел 5 и более, при этом рассчитывали поправку Йейтса; в случае наличия в ячейках таблиц сопряженности чисел менее 5 рассчитывали двусторонний точный критерий Фишера (F); за уровень статистической значимости различий принимали р<0,05.
Для оценки ассоциативной связи использовали показатель относительного риска с расчетом доверительных интервалов (ОР, 95% ДИ); для оценки величины эффекта медицинского вмешательства применяли показатель разности абсолютных рисков с расчетом 95% ДИ [19, 25, 26].
Результаты
Средний возраст наблюдаемых женщин составил 31,9 (3,5) года, возраст менархе – 13,2 (1,4) года, показатель АМГ – 3,1 (1,9) нг/мл, ФСГ – 6,9 (1,4) мМЕ/мл, средний индекс массы тела – 23 (3,9) кг/м2. Характер менструального цикла у женщин был нормопонирующим, не имел отличий в группах сравнения. У 44/84 (52,4%) женщин форма бесплодия была первичной, у 40/84 (47,6%) – вторичной. Продолжительность бесплодия составляла 5,3 (3,1) года и была сопоставима в группах. Трубный фактор бесплодия был диагностирован у 14/39 (36%) и 21/45 (47%), бесплодие неуточненной этиологии у 25/39 (64%) и 24/45 (53%) в группах 1 и 2 соответственно.
Более половины женщин, 45/84 (53,6%), с момента сексуального дебюта до планирования беременности не использовали методы контрацепции. 74/84 (88%) женщины перенесли в анамнезе инфекции бактериального и вирусного генеза. Среди доброкачественных пролиферативных заболеваний эндометрия и миометрия преобладали гиперплазия и полипоз эндометрия – 27/84 (32,1%) и 23/84 (27,4%). Доля оперативных вмешательств на органах малого таза составила 41/84 (48,8%), количество полостных операций на группу оперированных женщин (n=41) – 1,6 (1,0); частота вмешательств на полости матки – 65/84 (77,4%), количество вмешательств на полости матки – 2,1 (1,3).
В обеих группах на фоне преконцепционной подготовки зафиксировано по одному случаю самостоятельной беременности. Цикл овариальной стимуляции проведен в группе 1 у 38/39 (97,4%) женщин, в группе 2 – у 44/45 (97,8%).
Среднее количество антральных фолликулов по данным ультразвукового исследования на старт стимуляции в группах не различалось. Количество полученных ооцит-кумулюсных комплексов (ОКК), частота оплодотворения в группе 1 имели тенденцию к увеличению по сравнению с группой 2, однако статистически значимых отличий получено не было. У одной женщины в группе 1 ооциты были витрифицированы. На 5-е сутки культивации различия отсутствовали (табл. 1).
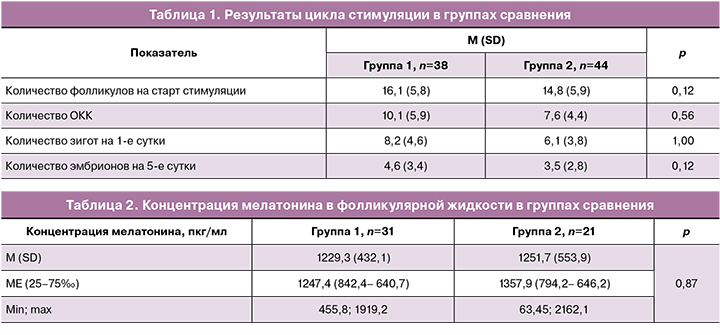
Концентрация мелатонина в фолликулярной жидкости в целом составила 1238,3 (479,9) пкг/мл, значимые отличия в группах 1 и 2 отсутствовали (табл. 2).
Проведено перцентильное распределение значений мелатонина в фолликулярной жидкости в зависимости от приема экзогенного мелатонина. Выявлено, что концентрации мелатонина, попавшие в интервал более 90‰, имели отчетливую тенденцию к преобладанию в группе женщин, не принимавших препараты экзогенного мелатонина (р=0,058). Концентрации мелатонина, попавшие в интервал нормальных значений, значимо чаще определялись в группе 1 (р=0,03) (табл. 3).
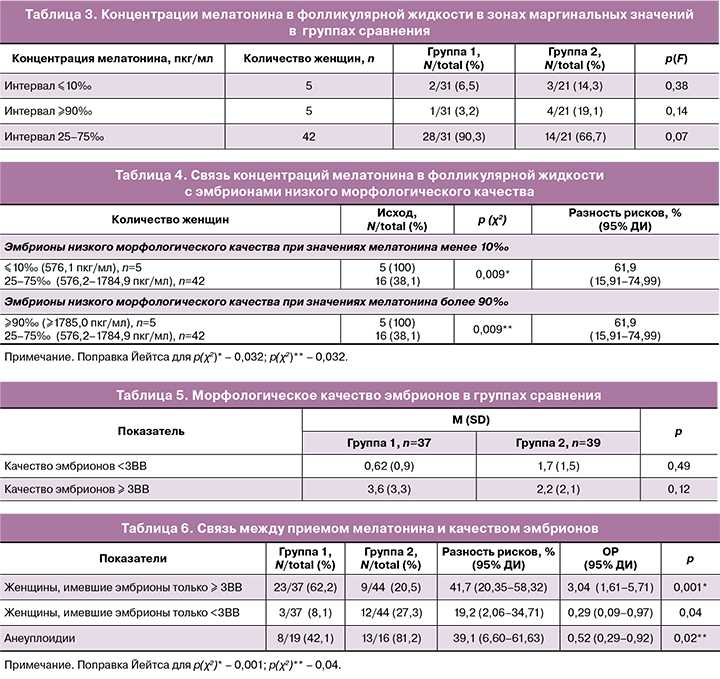
Установлено, что именно значения менее 10‰ и более 90‰ мелатонина ассоциировались с высоким риском развития эмбрионов низкого качества: атрибутивный риск развития эмбрионов низкого морфологического качества увеличивался на 62%, если женщина имела уровни интрафолликулярного мелатонина, попадающие в зоны крайних значений, в сравнении с теми, кто имел значения мелатонина в интервале 25–75‰ (табл. 4).
Из всех женщин полная остановка деления эмбрионов была у 5/82 (6,1%): в группе 2 – у 5/44 (11,4%); в группе 1 – ни в одном случае остановки деления не зафиксировано. Таким образом, выявлена отчетливая тенденция к повышению случаев полных остановок деления эмбрионов к 5-м суткам культивации в группе женщин, не принимавших препараты мелатонина: соответственно 5/44 (11,4%) и 0, р(F)≤0,06; р>0,05.
У всех женщин с полной остановкой деления эмбрионов концентрация мелатонина попадала в коридор более 90‰ (5, или 100%); в то же время у женщин, имевших значения мелатонина в зоне 25–75‰, ни в одном случае не зафиксировано полной остановки деления эмбрионов к 5-м суткам культивации, что было значимо ниже (р(χ2)=0,001).
Анализ эмбриологического этапа показал, что средние количества эмбрионов низкого и высокого морфологического качества не имели значимых отличий в группах наблюдения (табл. 5).
Однако количество женщин, имевших только эмбрионы высокого морфологического качества, превалировало в группе, принимавшей мелатонин (табл. 6).
Таким образом, определено повышение вероятности получения эмбрионов высокого качества на 41,7% (разность рисков=41,7%, р<0,001) при условии включения мелатонина в преконцепционную подготовку. Женщины, имевшие только бластоцисты низкого морфологического качества, встречались значимо реже в группе 1. Выявлено снижение абсолютного риска получения бластоцист низкого морфологического качества на 39,1% (разность рисков 39,1%, р<0,001), снижение вероятности (ОР=0,29 (0,09–0,97)) получения бластоцист только низкого качества в 3,37 раза (1/0,29) при условии применения женщиной мелатонина (табл. 6).
Преимплантационное генетическое тестирование эмбрионов проведено 19 женщинам в группе 1 и 16 – в группе 2. Женщины, имевшие анеуплоидные эмбрионы, значимо чаще встречались в группе 2, чем в группе 1, соответственно 13/16 (81,2%) и 8/19 (42,1%), (р(χ2)=0,02. Установлено снижение абсолютного риска получения бластоцист низкого морфологического качества на 39,1% (разность рисков 39,1% (6,60–61,63)), снижение риска (ОР=0,52 (0,29–0,92)) получения анеуплоидных бластоцист практически в 2 раза (1/0,52) при условии применения мелатонина. Женщины, имевшие эуплоидные эмбрионы, не имели значимых отличий в группах сравнения – 17/19 (89,5%) и 13/16 (81,2%), (р(χ2)=0,49. Среднее количество (M(SD)) полученных эуплоидных эмбрионов не имело отличий в группах 1 и 2: 1,1 (0,5) и 1,6 (0,5), р=0,19.
Частота наступления беременности в цикле проведения овариальной стимуляции в целом составила 11/34 (32,4%), в группе 1 – 4/14 (28,5%), в группе 2 – 7/20 (35%), что не имело статистически значимых различий (р(F)≤0,73; 0,05). Сегментация цикла ЭКО без переноса эмбриона в полость матки проведена у 23/37 (62,2%) в группе 1, у 20/40 (50%) – в группе 2. Кумулятивная частота наступления беременности в цикле криопереноса составила 22/46 (47,8%). Перенос эмбриона в криоцикле осуществлялся на фоне приема заместительной гормональной терапии. Средняя толщина эндометрия на старт гестагенов в группах сравнения не имела значимых отличий – 9,6 (1,7) мм и 9,5 (1,37) мм, р=0,07. Однако частота наступления беременности в криопротоколе была значимо больше в группе 1 (р(χ2)<0,008) (табл. 7).
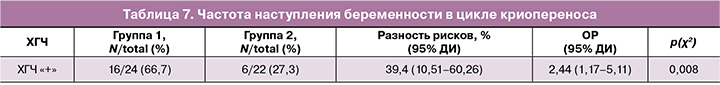
Таким образом, установлено, что если женщина принимала в схеме преконцепции препараты мелатонина, то вероятность наступления беременности повышалась практически в 2,5 раза (OР=2,44 (1,17–5,11)), а абсолютный риск наступления беременности увеличивался на 39% (разность рисков 39,4% (39,15–39,65)).
Обсуждение
Проведенное исследование показало, что женщины с бесплодием, участвующие в программах ЭКО, имели отягощенный гинекологический анамнез: высокую частоту инфицирования половых путей и оперативных вмешательств на органах малого таза, пролиферативных заболеваний эндометрия. Приведенные выше патологические состояния стимулируют оксидативные реакции, дискоординацию биологических ритмов, оказывая негативное влияние как на психологическое состояние, так и на репродуктивный потенциал. Назначение препарата мелатонина в схемах прегравидарной подготовки преследовало цель оценить его влияние на результативность клинико-биологических исходов программ ЭКО. Данные мировых исследований свидетельствуют о том, что интрафолликулярный мелатонин диффундирует в клетки кумулюса [27] и ооциты, защищая их от оксидативного повреждения [12], оказывая положительное влияние на процессы овуляции и ранние этапы эмбриогенеза [28]. В нашем исследовании не было получено статистически значимых различий в концентрациях мелатонина в фолликулярной жидкости в зависимости от применения экзогенного мелатонина. Однако анализ перцентильного распределения значений концентраций мелатонина выявил связь между маргинальными значениями мелатонина (менее 10‰ и более 90‰) и частотой получения эмбрионов низкого морфологического качества (61,9 (15,91–74,99), р(χ2)=0,009). Объясняя данный факт, можно предположить, что крайне низкие концентрации эндогенного мелатонина в фолликулярной жидкости не могли предотвратить оксидативное повреждение ооцитов, а крайне высокие концентрации внутрифолликулярного мелатонина способствовали прооксидативному повреждению ооцитов. При этом выявлена отчетливая тенденция к повышению случаев полных остановок деления эмбрионов к 5-м суткам культивации в группе женщин, не принимавших препараты мелатонина: соответственно 5/44 (11,4%) и 0, р(F)≤0,06; р>0,05. Обращает на себя внимание, что крайне высокие значения внутрифолликулярного мелатонина были выявлены только в группе женщин, не принимавших его. Данный факт, возможно, ассоциирован с диагностированным дефицитом сна и повышенным уровнем стресса у женщин, включенных в исследование. Можно предположить, что дополнительная дотация мелатонина не столько способствует увеличению его внутрифолликулярных концентраций, сколько регулирует его физиологический синтез, тем самым способствуя поддержанию нормальных концентраций и определяя своевременные ночные пики. В связи с этим становится актуальным вопрос поддержания циркадного синтеза мелатонина за счет его дополнительной дотации.
Положительное влияние мелатонина на эмбриональное развитие частично объясняется его антиоксидантными свойствами, позволяющими снизить частоту апоптоза среди бластоцист и, как следствие, улучшить развитие эмбрионов [14], повысить качество имплантации [15]. Данное положение подтверждается результатами проведенного нами исследования: установлено, что применение мелатонина в преконцепционной подготовке увеличивало вероятность получения бластоцист высокого морфологического качества на 41,7% (разность рисков 41,7%, р<0,001), снижало вероятность (ОР=0,29 (0,09–0,97)) получения бластоцист только низкого качества в 3,37 раза (1/0,29), снижало риск (ОР=0,52 (0,29–0,92)) получения анеуплоидных бластоцист практически в 2 раза (1/0,52), повышало вероятность наступления беременности в цикле криопереноса в 2,5 раза (OР=2,44 (1,17–5,11)).
Таким образом, проведенное исследование продемонстрировало в целом положительное влияние приема экзогенного мелатонина на клинико-биологические исходы программ ЭКО. Несмотря на то что данное вещество все чаще находит применение в клинической практике, требуется дальнейшее изучение влияния мелатонина на репродуктивную ось и формирование полноценной концепции влияния различных схем прегравидарной подготовки с включением мелатонина на повышение результативности программ ЭКО и снижение частоты репродуктивных потерь.
Ограничения
Ограничением данного исследования явилось отсутствие результатов оценки сомнологических нарушений у женщин и уровня стрессового состояния, что является фрагментом данного исследования, в настоящее время находящимся на этапе анализа. Кроме того, в данном исследовании представлен однофакторный анализ части оценки эффективности применения экзогенного мелатонина. Необходим многофакторный анализ для формирования прогноза успешности программ ЭКО. Для анализа связи маргинальных значений мелатонина необходим больший объем выборочной совокупности, что является дальнейшим предметом проведения данной работы.
Выводы
Назначение мелатонина в программах ЭКО не оказывало влияния на количество полученных ОКК и частоту оплодотворения. Не получено статистически значимых различий в уровне мелатонина в фолликулярной жидкости в зависимости от применения экзогенного мелатонина. Установлена связь между маргинальными значениями уровней мелатонина (менее 10‰ и более 90‰) и частотой получения эмбрионов низкого морфологического качества (разность рисков 61,9% (15,91–74,99)), р(χ2)<0,009). Установлено, что применение мелатонина увеличивало вероятность получения эмбрионов высокого качества на 41,7% (разность рисков 41,7%, р<0,001), снижало вероятность (ОР=0,29 (0,09–0,97)) получения бластоцист только низкого качества в 3,37 раза (1/0,29), снижало риск (ОР=0,52 (0,29–0,92)) получения анеуплоидных бластоцист практически в 2 раза (1/0,52), повышало вероятность наступления беременности в цикле криопереноса в 2,5 раза (OР=2,44 (1,17–5,11)).



