Преэклампсия (ПЭ) является опасным и непредсказуемым осложнением беременности, при котором в патологический процесс вовлекаются различные органы и системы человеческого организма. В клинической практике ПЭ может быть классифицирована по сроку манифестации на раннюю (<34 недель беременности) и позднюю (>34 недель), а также по степени тяжести – на умеренную и тяжелую (на основании артериального давления, клинических данных и степени протеинурии) [1]. Раннюю и позднюю формы ПЭ отличают сроки манифестации, особенности гемодинамики, степень влияния на рост плода. Однако определение тяжести ПЭ является относительно субъективной клинической оценкой, что в некоторых случаях затрудняет ее дифференциацию от менее тяжелых форм расстройства [2]. Изучение ПЭ привело к пониманию того, что ПЭ с ранним началом и тяжелой степени связана с более неблагоприятными материнскими и перинатальными исходами и более высоким риском развития сердечно-сосудистых заболеваний у женщины и ребенка в будущем [3, 4].
ПЭ посвящено много исследований, однако и сегодня она остается загадкой и «болезнью теорий» [5]. Предполагается, что основным механизмом, вовлеченным в патогенез заболевания, является маточно-плацентарная ишемия, которая возникает при неглубокой инвазии трофобласта и нарушении ремоделирования спиральных артерий матки [6]. При ишемии плаценты происходит повреждение синцитиотрофобласта и нарушение функции плацентарного барьера [7]. Это приводит к высвобождению в материнский кровоток факторов, включающих в себя провоспалительные цитокины, антиангиогенные агенты, чужеродные антигены плода и бесклеточную ДНК плода [6, 8]. Они разрушительно влияют на эндотелий сосудов матери, что в дальнейшем приводит к развитию системной воспалительной реакции и эндотелиальной дисфункции.
Инвазия клеток трофобласта в спиральные маточные артерии происходит с участием иммунных реакций воспалительной направленности. Важное место в воспалительном процессе занимает адгезия лейкоцитов к эндотелиальным клеткам с их последующей миграцией в периваскулярную ткань. Адгезия лейкоцитов к эндотелию опосредуется взаимодействием молекул адгезии и их лигандов, находящихся на поверхности этих клеток. В этих взаимодействиях играют роль 3 семейства молекул клеточной адгезии: селектины, интегрины и члены суперсемейства генов иммуноглобулинов. Селектины различают в зависимости от их месторасположения на различных клетках. Идентифицировано 3 вида селектинов: P-селектины располагаются на тромбоцитах, E-селектины – на эндотелии и L-селектины – на лейкоцитах. Интегрины состоят из α- и β-субъединиц и играют роль во многих процессах, протекающих в организме. Суперсемейство генов иммуноглобулинов включает ряд молекул, таких как молекулы межклеточной адгезии 1-го (ICAM-1), 2-го (ICAM-2) и 3-го типа (ICAM-3) и молекулы адгезии сосудистых клеток (VCAM-1).
Селектины участвуют в начальном связывании лейкоцитов с активированными эндотелиальными клетками, в то время как интегрины и суперсемейство генов иммуноглобулинов регулируют прочную адгезию с последующей трансмиграцией лейкоцитов. Повреждение молекул в одном из звеньев адгезии может привести к нарушению плацентации. Молекулы адгезии имеют мембранную и растворимую формы. При активации цитокинами или эндотоксинами молекулы клеточной адгезии высвобождаются из эндотелия, тромбоцитов или лейкоцитов. Разрыв связей между мембранным и внеклеточным доменом происходит путем протеолиза. Протеолитическое расщепление трансмембранных субстратов вблизи поверхности клетки приводит к высвобождению растворимых эктодоменов (shedding). Важнейшими в опосредовании расщепления мембранных форм молекул клеточной адгезии являются цинкзависимые эндопептидазы, включая матриксные металлопротеиназы (MMPS) мембранного типа (MT)-MMPS, а также члены семейства дезинтегранов и металлопротеиназ (ADAM) [9]. ADAMs (дезинтегран и металлопротеиназа) представляют собой семейство трансмембранных и секретируемых белков длиной около 750 аминокислот, выполняющих функции протеолитического процессинга эктодоменов различных рецепторов клеточной поверхности и сигнальных молекул.
Некоторые исследователи обнаружили повышение количества растворимых форм молекул клеточной адгезии в периферической крови при ПЭ [10–12]. Помимо этого, молекулы клеточной адгезии отражают функциональное состояние эндотелия сосудов. Молекулы рассматриваются исследователями как потенциальные диагностические и прогностические маркеры ПЭ, способные усовершенствовать тактику ведения пациенток с данным диагнозом. Однако в проводимых ранее работах, посвященных данным молекулам, получены неоднозначные и противоречивые данные [12, 13], что подчеркивает необходимость их дальнейшего изучения.
Целью данного исследования явилось определение уровня содержания растворимых форм молекул клеточной адгезии (sVCAM-1, sICAM-1, sE-селектин, sP-селектин) в материнской крови при ПЭ с учетом ее тяжести и фенотипа.
Материалы и методы
Нами было проведено исследование случай-контроль, которое включало 80 беременных женщин. Все они наблюдались в ФГБУ «НМИЦ АГП им. В.И. Кулакова» Минздрава РФ в период с 2019 по 2023 гг.
Критерии включения в исследование (группа контроля): возраст пациенток 18–45 лет, одноплодная беременность, информированное согласие на участие в исследовании, неосложненное течение беременности и родов. Критерии включения (основная группа): возраст пациенток 18–45 лет, одноплодная беременность, информированное согласие на участие в исследовании, а также беременность, осложненная ПЭ.
Критерии невключения (для всех групп): многоплодная беременность, соматические заболевания умеренной и тяжелой степени тяжести, онкологические заболевания, аутоиммунные заболевания, пороки развития в анамнезе, острая фаза и обострение хронических инфекционных заболеваний, отказ от участия в исследовании.
Обследованные женщины были разделены на 2 группы. В основную группу было включено 50 беременных с ПЭ. При этом у 39/50 (78%) пациенток ПЭ имела умеренную степень тяжести, у 11/50 (22%) – тяжелую. Ранняя манифестация ПЭ произошла у 19/50 (38%) пациенток, поздняя – у 31/50 (62%) пациентки. При ранней манифестации в 9/19 (47,3%) наблюдениях развилась тяжелая ПЭ, а в 10/19 (52,6%) наблюдениях – умеренная. При поздней манифестации тяжелая ПЭ наблюдалась у 2/31 (6,5%) пациенток, умеренная – у 29/31 (93,5%). Ранняя ПЭ диагностировалась при ее манифестации ранее 34 недель беременности, а поздняя – после 34 недель. Критериями умеренной ПЭ являлось повышение артериального давления (АД) выше 140/90 мм рт. ст. (до 160/110), впервые выявленное после 20 недель беременности, сопровождающееся протеинурией >0,3 г/л (до 5 г/сутки или 3 г/л в двух порциях мочи). Тяжелая ПЭ диагностировалась при повышении систолического АД ≥160 мм рт. ст. и/или диастолического АД ≥110 мм рт. ст. в сочетании с протеинурией ≥5 г в сутки или ≥3 г/л в двух порциях мочи либо признаках полиорганной недостаточности.
Образцы материнской периферической крови собирали в пробирки емкостью 5 мл с этилендиаминтетраацетатом (ЭДТА) и обрабатывали в течение 30 минут после отбора проб. Затем центрифугировали и хранили в биобанке ФГБУ «НМИЦ АГП им. академика В.И. Кулакова» Минздрава России. Для определения содержания sICAM-1, sVCAM-1, sE-selectin, sP-selectin в плазме крови беременных использовались набор Luminex Perfomance Assay Human Adhesion Molecule Multiplex Kit (США) и мультиплексный анализ. Расчет концентрации молекул адгезии проводился на двухлазерном проточном анализаторе сортировки и обнаружения Luminex 100/200.
Проведение данного исследования было одобрено локальным этическим комитетом ФГБУ «НМИЦ АГП им. В.И. Кулакова».
Статистический анализ
Результаты клинических наблюдений, лабораторно-инструментальных и дополнительных методов исследования проанализированы с помощью программы для статистической обработки данных Stattech (Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). Описание непараметрических данных проводилось с помощью медианы (Ме) и нижнего–верхнего квартилей (Q1–Q3). Сравнение двух групп по количественному показателю выполняли с помощью U-критерия Манна–Уитни. Категориальные показатели представлены абсолютным значением (n) и процентными долями. Для сравнения групп между собой по качественному признаку использовали критерий хи-квадрат Пирсона. Диагностическая и прогностическая значимость исследуемых показателей оценивалась с помощью ROC-анализа. Диаграммы размаха на рисунках представлены в виде 5; 25; 50; 75; 95 процентилей. Разделяющее значение исследуемых показателей в точке cut-off определялось по наивысшему значению индекса Юдена. За статистически значимые различия принимали при p<0,05.
Результаты
Характеристика обследованных беременных и их новорожденных детей представлена в таблице. Группы были сходны по возрасту и индексу массы тела. Не было выявлено различий в частоте курения и ПЭ во время предыдущих беременностей. В группе ПЭ в 11/50 (22%) наблюдениях ПЭ предшествовала хроническая артериальная гипертензия. Срок на момент родоразрешения, вес и рост новорожденных был статистически значимо ниже в группе ПЭ (p<0,001, p<0,001, p<0,001), что связано с большим количеством преждевременных родов при ПЭ.
sP-селектин
Концентрация sP-селектина в плазме крови женщин с физиологически протекающей беременностью и при ПЭ статистически не различалась (p=0,551). Содержание sP-селектина в контрольной группе составило 3566,0 (3236,50; 4587,875) пг/мл, а у женщин с ПЭ – 3831,50 (3370,50; 4353,750) пг/мл.
sE-селектин
При сравнении содержания sE-селектина в плазме крови женщин с физиологически протекающей беременностью и при ПЭ также не было выявлено статистически значимых различий (p=0,077). Содержание sE-селектина в контрольной группе составило 2476,750 (2079,750; 3414,250) пг/мл. При ПЭ содержание sE-селектина составило 2939,00 (2456,375; 3564,125) пг/мл.
sICAM-1
Анализ содержания sICAM-1 в плазме крови женщин с физиологически протекающей беременностью и ПЭ показал отсутствие статистически значимых различий (p=0,548). Содержание sICAM-1 в контрольной группе составило 310,50 (190,50; 526,750) пг/мл, а у женщин с ПЭ – 378,50 (245,250; 610,250) пг/мл.
sVCAM-1
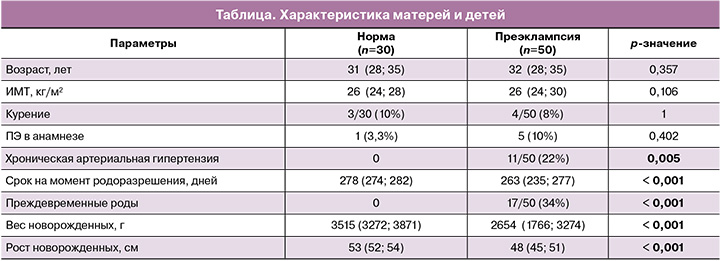
В группе с физиологически протекающей беременностью содержание sVCAM-1 составило 492,0 (393,0; 586,125) пг/мл. При ПЭ концентрация sVCAM-1 в материнской крови была 987,0 (772,250; 1239, 375) пг/мл (р<0,001) (рис. 1).
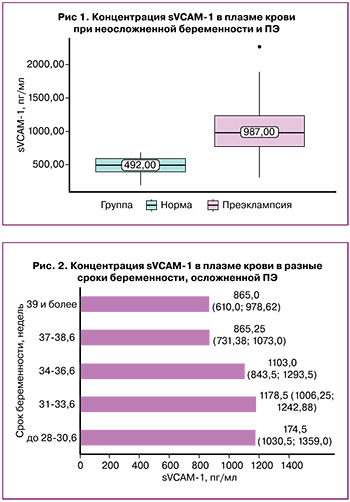
Распределение уровня содержания sVCAM-1 в зависимости от срока беременности при ПЭ представлено на рисунке 2.
Для выявления значимости sVCAM-1 при определении степени тяжести ПЭ мы сравнили концентрацию sVCAM-1 в плазме крови женщин с умеренной ПЭ (39/50) и тяжелой ПЭ (11/50). При умеренной ПЭ концентрация sVCAM-1 составила 940,0 (713,750; 1181,50) пг/мл. Статистически значимое повышение концентрации sVCAM-1 выявлено при тяжелой ПЭ – 1174,50 (1065,250; 1318,50) пг/мл (p=0,014) (рис. 3).
Для определения уровня, который позволит оценивать тяжесть ПЭ, проведен ROC-анализ. Площадь под ROC-кривой составила 0,744±0,092 с 95% ДИ 0,562–0,925. Полученная модель была статистически значимой (p=0,014). Пороговое значение sVCAM-1, выше которого диагностировалась тяжелая ПЭ, составило 1062,0 (рис. 4). Чувствительность и специфичность модели – 69,2 и 81,8% соответственно. Положительное прогностическое значение составило 93,1%, а отрицательное прогностическое значение – 42,9%.

Концентрации sVCAM-1 различались при ПЭ с разным сроком манифестации. При поздней ПЭ медиана содержания sVCAM-1 составила 931,00 (713,75; 1130,00) пг/мл. При ранней ПЭ содержание sVCAM-1 было 1151,00 (973,75; 1263,00) пг/мл. Выявленные различия были статистически значимыми (p=0,027).
Для исключения вмешивающегося влияния тяжести ПЭ на оценку зависимости уровня sVCAM-1 от ее фенотипа нами было проведено сравнение уровня sVCAM-1 между женщинами с умеренной и тяжелой ПЭ в группе ранней ПЭ. При тяжелой ПЭ уровень sVCAM-1 был выше, но различия не были значимыми: 1034,25 (906,75–1227,38) пг/мл и 1174,50 (1068,0–1372,0) пг/мл (p=0,253) (рис. 5).
Сравнение уровня sVCAM-1 при умеренной ПЭ в зависимости от фенотипа (ранняя и поздняя ПЭ) обнаружило, что при умеренной ранней ПЭ концентрация sVCAM-1 была значимо выше и составила 1125,5 (1015,88; 1242,88) пг/мл, чем при умеренной поздней ПЭ 848,0 (661,12; 1048,25) пг/мл (p=0,018) (рис. 6).
Обсуждение
Имеющиеся в литературе сведения о результатах исследований концентраций молекул клеточной адгезии в материнской крови при ПЭ неоднозначны и противоречивы. В основном для определения молекул адгезии собирали сыворотку крови и использовали иммуноферментный анализ. В нашем исследовании мы собирали плазму крови и определяли содержание молекул адгезии мультиплексным методом, который, как предполагается, должен показывать более достоверные результаты.
Результаты нашего исследования показали значительное повышение sVCAM-1 у беременных с ПЭ. Молекула адгезии клеток VCAM-1 присутствует в активированных эндотелиальных клетках и играет важную роль в привлечении лейкоцитов в очаг воспаления. VCAM-1 опосредует адгезию лимфоцитов, моноцитов и эозинофилов к эндотелию. При патологических процессах происходит высвобождение и повышение циркулирующих в кровотоке растворимых форм VCAM-1. Экспрессия растворимой формы VCAM-1 (sVCAM-1) обычно индуцируется провоспалительными цитокинами в эндотелии кровеносных сосудов для привлечения, адгезии и трансмиграции моноцитов и лимфоцитов. При ПЭ происходит нарушение структуры мембранной формы VCAM-1 с образованием ее растворимой формы sVCAM-1.
Одним из звеньев механизма инвазии трофобласта является взаимодействие мембранного VCAM-1 с интегринами, находящимися на поверхности лейкоцитов. Таким образом, VCAM-1 способствует инвазии трофобласта, удерживая его на поверхности эндотелия [14]. sVCAM-1, в свою очередь, блокирует взаимодействие VCAM-1 и интегринов, что может привести к уменьшению плацентарной инвазии и к осложнениям беременности. Таким образом, VCAM-1 и sVCAM-1 играют важную роль в регуляции плацентарной инвазии и, следовательно, в развитии беременности [15]. Повышенное содержание sVCAM-1 может уменьшать инвазию клеток трофобласта с сопутствующим повреждением сосудов. Помимо этого, sVCAM-1 может быть индикатором системной воспалительной реакции и эндотелиальной дисфункции при ПЭ [16].
Наши результаты частично согласуются с некоторыми исследованиями содержания молекул клеточной адгезии при ПЭ, проведенными ранее. Chaiworapongsa T. et al. (2002) изучили содержание sL-селектина, sE-селектина, sP-селектина, sVCAM-1, sICAM-1 и sPECAM-1 в периферической крови при нормальной беременности и ПЭ. В результате было выявлено, что во время нормальной беременности значительно увеличивается концентрация sP-селектина в плазме крови матери, снижается концентрация sL-селектина и отсутствуют изменения в содержании sE-селектина, sVCAM-1, sICAM-1 и sPECAM-1. При ПЭ происходит значительное увеличение уровней sP-селектина, sE-селектина, sVCAM-1 и снижается концентрация sL-селектина. Концентрации sICAM-1 и sPECAM-1 остаются без изменений [12]. Также повышение sVCAM-1 при ПЭ было зафиксировано в исследовании Docheva N. et al. (2018) [17], Pasaribu H.P. et al. [18]. Однако в нашем исследовании не было выявлено повышения sE-селектина и sP-селектина при ПЭ. Farzadnia M. et al. [13] показали увеличение при ПЭ концентрации не только sVCAM-1, но и sICAM-1. Результаты, полученные нами, не показали повышения sICAM-1 при ПЭ.
Нами показано значимое различие между содержанием sVCAM-1 при умеренной и тяжелой ПЭ. Это свидетельствует о том, что прогрессирование ПЭ сочетается с повышением уровня содержания sVCAM-1. Похожие результаты в отношении концентрации sVCAM-1 были показаны в работе Kim S.-Y. et al., в которой изучались концентрации sVCAM-1, sICAM-1 и sE-селектина в сыворотке периферической крови при нормальной беременности, а также при умеренной и тяжелой ПЭ. Однако в этом исследовании показано статистически значимое повышение уровня sICAM-1 и sE-селектина при тяжелой ПЭ по сравнению с нормальными беременностями, что не согласуется с нашими результатами [19]. Увеличение концентрации sVCAM-1 может сигнализировать как о нарушенной плацентации, так и о нарастании эндотелиальной дисфункции, которая сопровождает ПЭ.
Проведенное сравнение содержания уровня sVCAM-1 в зависимости от фенотипа ПЭ выявило значимые различия, которые заключаются в более высоких значениях этой молекулы при ранней ПЭ. Учитывая возможное влияние тяжести ПЭ на результаты исследования, нами проведен анализ отдельно при ранней и поздней ПЭ умеренной степени, который подтвердил выявленную зависимость. В то же время анализ в группе ранней ПЭ не выявил значимых различий в зависимости от тяжести. Таким образом, можно предположить, что при ранней ПЭ выделение умеренной и тяжелой степени носит условный характер, так как уровень эндотелиальной дисфункции одинаково высокий.
Нами не было найдено исследований, в которых сравниваются концентрации растворимых форм молекул клеточной адгезии в зависимости от фенотипа ПЭ. Однако есть исследование, проведенное Liu B. et. al., в котором показано уменьшение содержания мембранной формы VCAM-1 в плацентарной ткани при ранней ПЭ, по сравнению с нормальной беременностью [20]. Учитывая обратную корреляцию между VCAM-1 и sVCAM-1, выявленная зависимость укладывается в современные представления о патогенезе эндотелиальной дисфункции при ПЭ.
При этом выявленное повышение уровня sVCAM-1 при ранней манифестации ПЭ указывает на то, что данный фенотип имеет более высокую вероятность неблагоприятных материнских и перинатальных исходов в связи с более выраженным течением эндотелиальной дисфункции.
Заключение
Таким образом, проведенное нами исследование показало значимое повышение содержания sVCAM-1 в периферической крови у беременных с ПЭ и прямую корреляцию с тяжестью заболевания, что указывает на участие этой молекулы в развитии ПЭ. Выявленные различия в уровне содержания sVCAM-1 при ранней и поздней формах ПЭ подтверждают особенности патогенеза данного осложнения.



