Лейомиома (ЛМ) матки – наиболее часто встречающаяся доброкачественная опухоль половых органов у женщин репродуктивного возраста [1]. В последнее время отмечена тенденция к «омоложению» пациенток с миомой матки (ММ) у женщин в условиях планирования беременности [2], а также увеличение числа беременных женщин позднего репродуктивного возраста с ММ. Имея все признаки доброкачественной опухоли, ЛМ матки характеризуется чрезмерной аккумуляцией экстрацеллюлярного матрикса (ЭЦМ), представленного преимущественно фибриллами коллагена, фибронектином и протеогликанами [3]. Предполагается, что комбинированное воздействие гормонов, ростовых факторов и цитокинов на клетки миоматозного узла инициирует клеточную пролиферацию и способствует накоплению коллагена в ткани. Изучение механизмов развития и роста опухоли данного типа выявило особую роль иммунных нарушений в этом процессе. Основной контроль и продукция цитокинов и ростовых факторов в миоматозном узле и окружающих тканях осуществляется иммунокомпетентными клетками [4, 5]. Однако к настоящему времени недостаточно изучены особенности функционирования естественных киллеров (ЕК) при этом заболевании. ЕК играют особую роль в противоопухолевом иммунитете, уровень их цитотоксичности зависит от активации мембранных рецепторов. Известно, что к таким рецепторам относятся лектиноподобные рецепторы, киллерные иммуноглобулин-подобные рецепторы (KIR), а также рецепторы естественной цитотоксичности (NCR) [6]. Ранее показано, что при ЛМ матки, независимо от клинических вариантов, увеличивается активность ЕК, инвазирующих эндометрий, в частности, быстрый рост опухоли наблюдался на фоне снижения экспрессии KIR-рецепторов эндометриальными ЕК [7]. Считается, что лиганды NCR-рецепторов присутствуют на мембране опухолевых клеток, в результате активации ЕК через рецепторы данного типа запускается каскад цитотоксических реакций [8]. Однако механизмы их функционирования при ЛМ матки изучены недостаточно.
Целью исследования было выявление особенностей экспрессии NCR-рецепторов естественными киллерами, инвазирующими эндометрий, расположенный в проекции миоматозного узла, и особенностей синтеза коллагена при различных вариантах ЛМ матки.
Материалы и методы
Исследования проводили на базе эндоскопического отделения гинекологической клиники ФГБУ «Ив НИИ МиД им. В.Н. Городкова» Минздрава России. В исследование была включена 51 женщина в возрасте 27–42 лет с симптомной ЛМ матки. Всем пациенткам было выполнено общеклиническое и специальное исследования, в том числе ультразвуковое исследование (УЗИ) органов малого таза, а в последующем, – миомэктомия лапароскопическим доступом. Контрольную группу составили 10 пациенток без пролиферативных заболеваний матки на момент исследования, обратившихся к гинекологу с целью подбора метода контрацепции. В исследование не были включены пациентки с аденомиозом и гиперпластическим процессом эндометрия.
В зависимости от размера миоматозного узла пациентки были распределены по двум подгруппам: в 1-ю, с размером миоматозного узла свыше 6 см, вошли 25 женщин, во 2-ю, с размером узла, не превышающим 6 см, – 26 женщин. Также основная группа женщин была разделена в зависимости от активности пролиферативных процессов, происходящих в ткани миоматозного узла. По данным оценки маркера пролиферации (Ki67), у 12 пациенток наблюдался высокий уровень активности пролиферации в ткани миоматозного узла, у 19 – низкий.
Материалом для молекулярно-генетического исследования служили полученные в ходе оперативного лечения биоптаты миоматозных узлов и биоптаты эндометрия, расположенного в проекции миоматозного узла. У пациенток контрольной группы была выполнена пайпель-биопсия эндометрия с целью подбора рационального метода контрацепции, в том числе при удалении внутриматочной спирали. Исследования проводили с одобрения локального этического комитета (протокол № 3 от 27.11.2017 г.).
Мононуклеарные клетки эндометрия выделяли стандартным бесферментативным механическим методом. Экспрессию поверхностных молекул оценивали методом многоцветной проточной цитометрии с использованием моноклональных антител анти-CD3, анти-CD56, анти-NKp44, анти-NKp46 (eBioscience, США). Из образцов ткани выделяли тотальную РНК феноловым методом, которую переводили в кДНК (комплементарную ДНК) с использованием коммерческого набора для постановки обратной транскрипции производства ООО «Фрактал Био» (Санкт-Петербург, Россия). В полученных образцах определяли уровень экспрессии мРНК маркера клеточной пролиферации (Ki67) и альфа-1 цепи коллагена-1 (COL1A1) методом количественной полимеразной цепной реакции (ПЦР) в режиме реального времени. В работе использовали наборы ферментов, праймеров и зондов производства ООО «Фрактал Био» (Санкт-Петербург, Россия). Реакцию амплификации и обработку данных проводили на приборе iCycler iQ (BioRad, USA). Результаты по экспрессии генов представлены как нормализованное относительно уровня экспрессии мРНК гена домашнего хозяйства (β-актин) количество копий специфического гена в образце х 103/мкл для мРНК ki67 и COL1A1.
Статистический анализ полученных данных осуществляли в пакете прикладных лицензионных программ Microsoft Office 2010, Statistica for Windows 6.0. В случаях, если хотя бы в одной из сравниваемых подгрупп значение выборки было от 5 до 9, уровень статистической значимости различий качественных признаков между группами оценивали при помощи χ2 Пирсона с поправкой Йейтса, а если хотя бы в одной из сравниваемых подгрупп значение выборки было менее 5, то использовали точный критерий Фишера. При статистической обработке данных проводили расчет нормальности распределения в выборках с использованием критерия Колмогорова–Смирнова и Лиллиефорса. Распределение в большинстве выборок отличалось от нормального, поэтому для оценки уровня статистической значимости различий использовали непараметрический критерий Манна–Уитни. Все полученные данные представлены в виде медианы (Me) и квартилей Q1 и Q3 (Ме (Q1; Q3)). Уровень статистической значимости признавался при значении р<0,05.
Результаты и обсуждение
Все пациентки с ММ находились в пределах репродуктивного возраста, их средний возраст составил 37 (32; 40) лет. Основными клиническими проявлениями ЛМ матки являлись: синдром хронических тазовых болей, аномальные маточные кровотечения по типу обильных маточных кровотечений, дизурия и бесплодие. Обильные менструации в 9,8% (n=5) случаев приводили к анемии легкой степени тяжести. Бесплодие во всех случаях служило поводом обращения пациентки в стационар и в 8% (n=4) случаев являлось первичным, а в 9,8%(n=5) – вторичным. У 18% (n=9) женщин в анамнезе выявлено самопроизвольное прерывание беременности в ранние сроки. По результатам УЗИ у всех женщин диагностирована интрамурально-субсерозная ЛМ матки. У 25 женщин выявлена ЛМ матки больших размеров (свыше 6 см), у 26 – малых размеров. Отмечено, что дизурия в группе пациенток с ММ больших размеров встречалась чаще (28% (n=7) случаев), по сравнению с группой женщин с ММ малых размеров (4% (n=1) (р=0,02). В 63% (n=32) случаев ММ была представлена единичным миоматозным узлом. Средний объем миоматозного узла или же доминантного при множественной ММ, по данным УЗИ, составил 137,3 (47,0;187,0) см3.
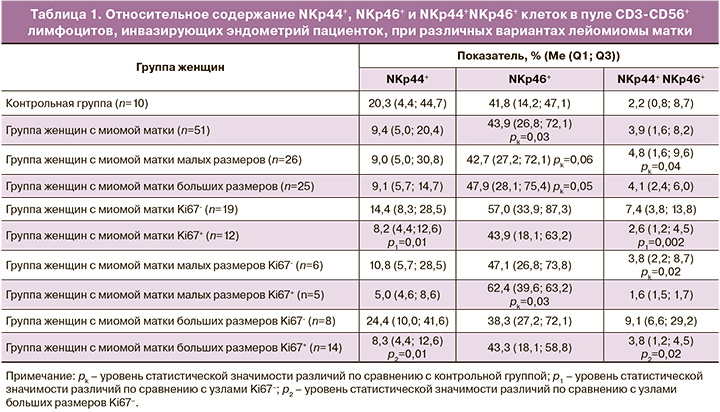
Уровень экспрессии рецепторов NKp44 (NCR2) и NKp46 (NCR1) ЕК относительно всех CD3-CD56+ лимфоцитов эндометрия у женщин при различных вариантах ЛМ матки представлены в табл. 1. В ходе исследования было выявлено, что для пациенток с ЛМ матки, независимо от размера миоматозного узла, характерен высокий уровень экспрессии рецептора NKp46 ЕК по сравнению с показателями контрольной группы. Анализ данных в зависимости от размера миоматозного узла выявил статистически значимое повышение доли NKp44+NKp46+ ЕК в эндометрии, расположенном в проекции миоматозных узлов малых размеров по сравнению с показателями контрольной группы. В миоматозных узлах с минимальной пролиферативной активностью уровень NKp44+ и NKp44+NKp46+ ЕК в ткани эндометрия был повышен. В эндометрии миоматозных узлов малых размеров с высокой пролиферативной активностью отмечено статистически значимое повышение активности рецепторов NKp46+, с низкой пролиферативной активностью – повышение активности даблпозитивных рецепторов NKp44+NKp46+ по сравнению с показателями контрольной группы. Миоматозные узлы больших размеров с высокой интенсивностью пролиферативных процессов характеризуются снижением экспрессии рецепторов NKp44+ и NKp44+NKp46+ ЕК эндометрия.
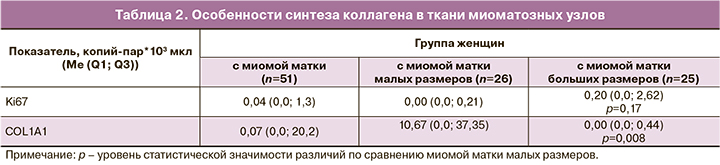
Данные по особенностям синтеза коллагена в миоматозных узлах представлены в табл. 2. В результате проведенного исследования нами выявлено, что миоматозные узлы больших размеров характеризуются повышенной пролиферативной активностью на фоне сниженного синтеза коллагена.
Известно, что NCR-рецепторы активируются опухолевыми и вирус-инфицированными клетками [9, 10]. Показано, что низкая экспрессия этих рецепторов приводит к прогрессированию опухолевого роста в различных органах, таких как головной мозг, желудок, печень, кожа [11].
Учитывая выраженную способность NKp44- и NKp46-рецепторов к индукции реакций цитотоксичности у ЕК, можно предположить, что сниженный уровень эндометриальных ЕК, одновременно экспрессирующих оба рецептора, приводит к срыву локальных цитотоксических реакций и снижению противоопухолевого ответа в тканях матки. В результате недостаточной цитотоксической активности эндометриальных ЕК происходит снижение лимитирующего влияния иммунных реакций на опухоль, что формирует благоприятный фон для увеличения пролиферативной активности опухолевых клеток и последующего роста миоматозного узла. На основе полученных нами данных был разработан способ диагностики пролиферативной активности клеток ЛМ матки, получен патент на изобретение № 2700003 от 12.09.2019 г.
Высказывались предположения, что различная способность к росту миоматозных узлов зависит от особенностей клеточного состава ЛМ матки малых и больших размеров [12]. По-видимому, повышенная экспрессия рецепторов цитотоксичности эндометриальными ЕК сдерживает пролиферацию лейомиоцитов, при этом опосредованно усиливая синтез коллагена, преимущественно в миоматозных узлах малых размеров. Ранее показано, что при активации ЕК происходит увеличение концентрации ионов кальция, который участвует в процессах межклеточной адгезии и формирования соединительной ткани, синтеза компонентов ЭЦМ, в частности коллагена, за счет стимуляции деления фибробластов в почках и сердце [13, 14].
Воспалительные реакции и поддержание клеточного гомеостаза имеют решающее значение для нормальных защитных механизмов и процессов регенерации тканей. Любой сбой в механизмах регуляции, приводящий к хроническому воспалению, формирует специфическое микроокружение, способствующее возникновению и прогрессированию фибриногенеза и туморогенеза [15].
Известно, что наступление беременности происходит на фоне умеренной активации эндометриальных ЕК [16,17]. Как повышение, так и подавление активации ЕК в эндометрии под влиянием растущего миоматозного узла, может привести к нарушению баланса в продукции цитокинов, регулирующих имплантацию и формирование плаценты, что приводит к самопроизвольному прерыванию беременности в ранние сроки, к первичному и вторичному бесплодию. Данный факт подтверждается увеличением процента женщин с бесплодием и невынашиванием беременности в исследованной нами группе пациенток с миомой матки. Нарушение формирования плаценты на фоне миомы матки оказывает неблагоприятное влияние на течение и исход беременности, приводя к таким осложнениям, как гестоз, фетоплацентарная недостаточность, задержка роста плода [18].
Заключение
Проведенные нами исследования показали, что уровень активации эндометриальных ЕК различается в зависимости от активности пролиферации лейомиоцитов. Имеющиеся изменения в виде выраженной активации экспрессии NCR в популяции ЕК отмечены в миоматозных узлах с минимальным уровнем пролиферации. Изменение активации ЕК эндометрия может быть одним из механизмов нарушений репродуктивной функции при ММ.



