За последние несколько лет наблюдается растущий интерес к методикам сохранения фертильности у онкологических больных [1]. Это связано с улучшением показателей выживаемости, повышением внимания к качеству жизни онкологических больных в ремиссии, а также постоянным прогрессом в области вспомогательных репродуктивных технологий [2].
Одним из самых важных и ответственных шагов в развитии направления предварительного забора и сохранения репродуктивного материала онкологических больных является создание комплексной программы, позволяющей четко и быстро определить тактику лечения в зависимости от индивидуальных онкологических и репродуктивных характеристик пациенток. Прежде всего необходимо предоставить пациентам своевременные и информативные сведения о перспективах излечения и потери функции яичников вследствие гонадотоксичного лечения. Во-вторых, ознакомить с возможными методами, направленными на сохранение репродуктивного материала, их эффективностью и безопасностью. В большинстве международных клинических рекомендаций прописано, что решение пациентка принимает самостоятельно, при условии предоставления ей полной, консолидированной между онкологами и репродуктологами информации [3–5].
Существует несколько проблем, связанных с принятием решений, касающихся сохранения репродуктивного материала у онкологических больных. Ключевыми из них являются имеющееся временное ограничение и вопросы, связанные с безопасностью и влиянием методов вспомогательных репродуктивных технологий на течение основного заболевания [6]. Обсуждение вариантов сохранения репродуктивного материала у онкологических больных сопровождается специфическими сложностями, поскольку каждый вариант (криоконсервация ооцитов, эмбрионов и ткани яичника) несет в себе определенный риск [7]. Ряд специалистов вполне обоснованно считают, что для того, чтобы гарантировать сохранение репродуктивного материала, пациенткам с онкологическими заболеваниями необходимо использовать все имеющиеся возможности и комбинировать различные методики [8–10].
В последние годы при консервации ткани яичников дополнительно используют новую, пока еще экспериментальную методику выделения из яичника незрелых ооцитов, их доращивания до стадии зрелых и консервации [11, 12]. Важно при обращении больных как можно быстрее и полнее предоставить всю информацию как о характере онкологического заболевания, так и о состоянии репродуктивной системы, что поможет принять оптимальное решение. В этой связи необходимо создавать регистры больных, определять структуру онкологических заболеваний у обращающихся пациенток. Подобные работы проводятся во всех странах и имеют важное значение для развития этого направления [13–16].
Цель работы: разработать дифференцированную тактику ведения пациенток, имеющих онкологическое заболевание и направленных для забора и криоконсервации репродуктивного материала, на основании определения структуры онкологических заболеваний по обращаемости, онкологического и репродуктивного статуса, индивидуальных характеристик больных, характера планируемого/проведенного лечения.
Материалы и методы
Собирали и анализировали данные пациенток, направленных онкологами с целью предварительного забора репродуктивного материала перед гонадотоксичной терапией или радикальным хирургическим лечением, а также пациенток, находящихся в состоянии стойкой ремиссии и обратившихся с целью достижения беременности в период с февраля по декабрь 2019 г. в ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова». Провели анализ медицинских документов, предоставленных онкологами, о характере, локализации и типе онкологического процесса, стадии заболевания, характере предстоящего лечения, прогнозе потери или резкого снижения репродуктивной функции. Оценивали состояние репродуктивной функции пациенток на основании репродуктивного анамнеза, характера менструального цикла, уровней гормонов в плазме крови, состояния овариального резерва. Совокупность полученных данных позволила определить перспективность программ, направленных на сохранение репродуктивного материала, и выбрать методы, оптимальные для конкретной больной. Решение принимали в течение 2 дней с момента обращения пациентки.
Все пациентки подписывали информированное согласие, в котором разъяснялись последствия планируемого лечения для репродуктивной системы, методика проведения программ по сохранению репродуктивного материала, возможные риски лечения.
Пациентки были разделены на группы. I группу составили 203 женщины, обратившиеся до начала гонадотоксичной терапии или радикальной операции; при этом 68 из них проводили стимуляцию яичников, забор и криоконсервацию ооцитов/эмбрионов; 61 пациентке проводили забор ткани яичников во время операции с извлечением из яичников незрелых ооцитов с последующими доращиванием in vitro до стадии зрелых и их криоконсервацией. Во II группу (n=56) были выделены пациентки, обратившиеся уже после окончания лечения по поводу онкологического заболевания; при этом только 17 из них проведена программа ЭКО. 113 женщинам проведена лишь консультация; у большинства из них вследствие истощения яичников невозможно было получить собственную яйцеклетку, часть женщин отказались от лечения по личным мотивам.
Статистический анализ
Для количественных показателей были определены среднее арифметическое значение и стандартное отклонение (для показателей, имеющих нормальное распределение), медиана и квартили (для остальных показателей). Для качественных показателей были посчитаны частоты. Для проверки соответствия количественных данных нормальному закону распределения перед проведением сравнительного анализа в исследуемых группах проводили теcт Шапиро–Уилка. Для проверки равенства дисперсий нормальных показателей в группах использовали критерий Фишера. Так как рассматриваемые количественные показатели не отвечают условиям нормальности данных и равенства дисперсий в группах сравнения, для сравнения всех количественных показателей применяли непараметрический тест Манна–Уитни. Для сравнения частот в группах использовали точный тест Фишера. Различия признавались статистически значимыми на уровне р<0,05.
Расчеты выполнялись в R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria).
Результаты и обсуждение
В указанный период времени по направлению онкологов для решения вопроса о возможности предварительной криоконсервации репродуктивного материала, а также о достижении беременности после окончания лечения обратились 259 женщин. В таблице представлены клинико-анамнестические характеристики пациенток, которые разделены на 2 группы: I группа – 203 женщины, обратившиеся до начала гонадотоксичной терапии, II группа – 56 пациенток после окончания лечения.

Полученные данные подчеркивают необходимость проведения мероприятий, направленных на сохранение репродуктивного материала для отсроченного деторождения у этой категории больных, т.к. подавляющее большинство женщин были молодого возраста и не имели детей; 26 (13%) из пациенток I группы родили одного ребенка до манифестации заболевания, а после лечения удалось родить лишь одной. Обращают на себя внимание неблагополучный семейный онкологический анамнез и значительная доля пациенток, имеющих нарушения менструального цикла, в частности синдром поликистозных яичников (СПКЯ) – у 34 (17%) пациенток. Кроме того, наружный генитальный эндометриоз выявлен у 3% больных, а миома матки – у 8%. Указанные сведения позволяют высказать предположение, что возникновение онкологического заболевания сопряжено с неблагоприятным гинекологическим и репродуктивным анамнезом пациенток. Значимые различия между группами обнаружены в состоянии овариального резерва. Несмотря на то что пациентки не различались по возрасту, сниженные показатели резерва диагностированы у 66% женщин, обратившихся после лечения онкологического заболевания, тогда как у обратившихся для предварительной криоконсервации репродуктивного материала снижение функции яичников обнаружено у 34% больных в возрасте 38–40 лет. Представленные данные однозначно подтверждают необходимость обращения больных с целью сохранения их репродуктивного материала до лечения онкологического заболевания, что постулировано во всех международных документах [1–3].
Естественно, что предварительный забор и криоконсервация репродуктивного материала возможны в случаях благоприятного прогноза выживаемости больных. На рисунке 1 представлено распределение пациенток по локализации онкологического процесса.
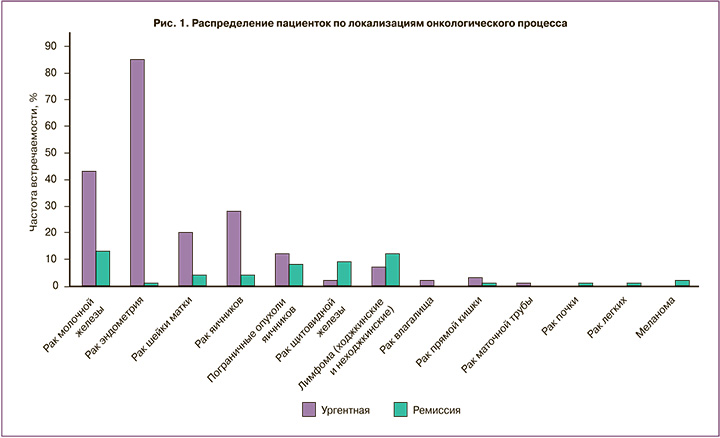
Анализируя нозологические формы онкологических заболеваний по обращаемости, нетрудно заметить, что гинекологические формы рака и рак молочной железы преобладают в структуре обращений. Это подчеркивают другие исследователи, определяя рак молочной железы как приоритетную группу больных, нуждающихся в сохранении репродуктивного материала [9]. Кроме того, специфика учреждения, занимающегося проблемами онкогинекологии, обусловила обращение больных с гинекологической локализацией рака. К сожалению, незначительную долю в настоящем исследовании составили гематологические формы рака, тогда как в международных регистрах эти формы занимают 2-е место после рака молочной железы, характеризуются хорошими перспективами выживаемости, в то же время – высоким риском утраты репродуктивной функции [10]. Это подтверждается довольно высокой частотой обращения пациенток после лечения гематологического рака и рака щитовидной железы как нозологий, имеющих хороший прогноз выживаемости.
Естественно, что предварительная консервация репродуктивного материала, равно как и терапия, направленная на достижение беременности, возможна при благоприятных перспективах излечения и выживания пациенток. При проведении статистического анализа стадии онкологического процесса у пациенток двух групп были выявлены некоторые различия, которые не имели принципиального значения. Результаты обследования показывают, что большинство пациенток имели I и II стадии рака и благоприятный прогноз выживаемости. Все женщины выказывали настойчивое желание сохранить свои яйцеклетки и в будущем иметь детей.
При анализе молекулярно-биологических подтипов опухолей молочной железы отмечена более частая встречаемость люминального подтипа В и люминального подтипа А.
Совокупность онкологических и репродуктивных характеристик с оценкой состояния овариального резерва определила выбор тактики ведения больных, направленной на сохранение репродуктивного материала или достижение беременности после завершения лечения.
А – 68 женщин, которым проведена стимуляция яичников, забор и криоконсервация ооцитов/эмбрионов. Нозологические формы рака: рак молочной железы, рак шейки матки, рак нижней трети влагалища, рак прямой кишки, лимфомы, пограничные опухоли яичников, рак матки I стадии и атипическая гиперплазия эндометрия. Средний возраст пациенток 33,38 (3,73) года. У всех участвующих в исследовании отмечали нормальный женский тип телосложения с правильным развитием вторичных половых признаков. Среднее значение индекса массы тела составило 22,1±2,0 кг/м2.
В соответствии с анализом концентраций фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ), антимюллерова (АМГ) гормонов, эстрадиола, а также определения числа антральных фолликулов в яичниках у пациенток определялись хорошие показатели овариального резерва и, как следствие, перспективы для проведения стимуляции яичников и получения ооцитов в программе ЭКО. В зависимости от дня обращения и ургентности ситуации пациенткам проводили стимуляцию яичников по классическому протоколу с антагонистом гонадотропин-рилизинг-гормона или по «random start» протоколу. Женщинам, имеющим рак молочной железы с высокой экспрессией рецепторов к эстрогенам, в схему стимуляции включали ингибиторы ароматазы (Летрозол) в дозе от 2,5 до 5 мг, согласно международным клиническим рекомендациям.
Б – 61 женщина, которым провели забор и криоконсервацию ткани яичников с извлечением из яичников незрелых ооцитов с последующим доращиванием in vitro до стадии зрелых и их криоконсервации или же оплодотворения и криоконсервации эмбрионов. Указанная процедура проведена при хирургической лапароскопии с удалением яичника или его части. По нозологическим формам заболевания и мотивации проведения именно этого вида лечения пациентки распределились следующим образом: хирургическое лечение по онкологическим показаниям – 8 женщин с рецидивами пограничных опухолей яичника; 19 пациенток – с раком яичника; 8 случаев рака молочной железы и 10 пациенток – с раком матки; 12 – с раком шейки матки. Проведена криоконсервация 31 образца ткани яичника, криоконсервирован 161 ооцит и 13 бластоцист.
В – 56 пациенток, находящихся в стадии стойкой ремиссии и обратившхеся для достижения беременности с использованием вспомогательных репродуктивных технологий. У большинства женщин, перенесших химио/лучевую терапию, получение собственных ооцитов оказалось невозможным вследствие резкого снижения и истощения функции яичников. У 10 из 27 пациенток, которым проводилась химиотерапия, несмотря на предпринятые попытки медикаментозной защиты яичников (применение агонистов гонадотропин-рилизинг-гормона, комбинированных оральных контрацептивов и др.), восстановление менструального цикла не наблюдалось.
Попытки стимуляции функции яичников проведены 17 пациенткам из 56, у которых регистрировались регулярные менструации, а уровень АМГ был выше 0,7 нг/мл. Однако необходимо отметить, что в группе пациенток, прошедших химиотерапию, даже в случае сохранного менструального цикла и овариального резерва наблюдаются чрезвычайно сниженные потенции к получению компетентных ооцитов и эмбрионов. В большинстве программ, проведенных после гонадотоксичной терапии, нам не удалось получить эмбрионы, пригодные для переноса, а именно в 10 (58,8%) программах; в 7 (41,2%) программах был произведен перенос эмбриона в полость матки, но беременность не наступила ни в одном случае.
Указанные факты, бесспорно, подтверждают необходимость предварительной криоконсервации ооцитов даже в тех случаях, когда лечение не относится к разряду гонадотоксичного, как, например, при длительной терапии тамоксифеном.
Г – 113 женщинам проведена лишь консультация: 39 (69,6% из числа обратившихся после лечения) – в стойкой ремиссии и 74 (36,8% из числа направленных онкологами) – до начала лечения. Основной причиной невозможности проведения программ, направленных на забор и сохранение репродуктивного материала, явилось резкое снижение овариального резерва вплоть до его истощения у подавляющего большинства пациенток из этой группы, а также ряд субъективных причин: нехватка материальных средств, чувство страха, инициированное, как правило, врачами-онкологами или родственниками.
Заключение
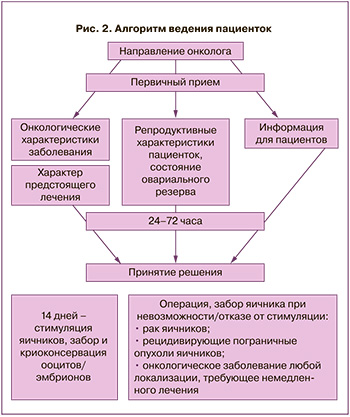 Проведенное исследование позволило сформулировать и рекомендовать тактику ведения онкологических больных, нуждающихся в сохранении репродуктивного материала для отсроченного деторождения (рис. 2).
Проведенное исследование позволило сформулировать и рекомендовать тактику ведения онкологических больных, нуждающихся в сохранении репродуктивного материала для отсроченного деторождения (рис. 2).
- Решение о возможности сохранения репродуктивного материала принимают совместно онкологи и репродуктологи, исходя из онкологических показаний – стадия процесса, прогноз выживаемости, высокий риск потери репродуктивной функции; репродуктивных характеристик – состояние овариального резерва, обеспечивающее получение ооцитов.
- Окончательное решение принимает женщина, исходя из полной информации, предоставленной врачами.
- Забор и криоконсервация репродуктивного материала проводятся до начала лечения основного заболевания.
- В случае решения о возможности провести стимуляцию яичников с целью забора и криоконсервации ооцитов/эмбрионов протокол стимуляции, выбор и дозы вводимых индукторов определяет репродуктолог; онколог может ограничить сроки проводимого лечения, но не менее чем до 14 дней.
- В случаях невозможности провести стимуляцию (рак яичников) или отказа больной от этого метода лечения следует обсудить вопрос о проведении забора и криоконсервации ткани яичников с извлечением из яичников незрелых ооцитов с последующим доращиванием in vitro до стадии зрелых. Необходимо информировать пациентку, что процедура проводится при хирургической лапароскопии с удалением яичника или его части. Также необходимо довести до сведения больной, что на сегодняшний день метод является экспериментальным и проводится в тех случаях, когда нельзя использовать другие методики.



