Традиционным указанием на важную роль наследственных факторов в развитии той или иной патологии является описание семейного и популяционного накопления случаев заболевания. И то и другое описано для аденомиоза, хотя семейные случаи этой патологии являются достаточно редкими. Еще в 1962 г. Emge L.A. [1] описал семь семей, в которых оперативное вмешательство по поводу аденомиоза в течение 15 лет было выполнено как у матери, так и у дочери; несколько позже Arnold L.L. et al. [2] описал семью, в трех поколениях которой наблюдалось развитие тяжелых форм аденомиоза. Прямое сравнение эпидемиологических данных достаточно проблематично вследствие отсутствия единых критериев постановки диагноза и различий применяемых диагностических подходов. Тем не менее некоторое количество исследований позволяет сделать выводы о том, что межэтнические различия по частоте аденомиоза также существуют. Заслуживает упоминания большое исследование Templeman C. et al. [3], в ходе которого были обследованы более 133 тыс. женщин – учителей и сотрудниц администраций школ в штате Калифорния. Cогласно полученным результатам, заболевание чаще встречалось у женщин латинского происхождения (OR=1,26 по сравнению с белыми американками) и реже – у афроамериканок (OR=0,82) и выходцев из азиатско‑тихоокеанского региона (OR=0,83).
В этой статье мы рассмотрим результаты современных исследований, посвященных разнообразным генетическим аспектам аденомиоза: анализу ассоциаций полиморфных вариантов генов с развитием аденомиоза, исследований способов регуляции генов и изменений их экспрессии при этом заболевании. Кроме того, мы обсудим новое, недавно появившееся направление исследований, посвященное изучению роли соматических мутаций при аденомиозе.
Роль генетического полиморфизма в патогенезе аденомиоза
Согласно классическим представлениям, генетическая предрасположенность к тем или иным мультифакторным заболеваниям (МФЗ), к числу которых относится и аденомиоз, может зависеть от наличия у человека определенного набора полиморфных вариантов генов. Эти варианты (аллели) сами по себе не оказывают существенного воздействия на жизнеспособность организма, поэтому очень мало подвержены действию естественного отбора и широко распространены в популяции. Однако различия в эффективности работы разных аллелей одного и того же гена могут быть весьма существенными. Накопление у одного человека нескольких неблагоприятных аллельных вариантов, относящихся к одной генной сети, может формировать генетическую предрасположенность к заболеванию [4]. В отличие от наружного генитального эндометриоза, роль генетического полиморфизма при аденомиозе изучена довольно слабо; основное внимание исследователей было привлечено к двум генным сетям – ответа на эстрогены (а также в местном синтезе и биодеградации эстрогенов) и неоангиогенеза (а также в связанных с ним процессах ремоделирования внеклеточного матрикса).
Гиперэстрогенемия является ведущей причиной развития гормонзависимых пролиферативных заболеваний женской половой системы, однако простое определение уровня гормонов в крови не всегда отражает истинную картину локального гормонального фона. Весомый вклад вносят соотношение уровней гормонов (эстрогенов, андрогенов, прогестинов), соотношение уровней экспрессии рецепторов и изоформ рецепторов (например, ERα и ERb). Наконец, крайне важную роль играют местные, тканевые особенности захвата, синтеза и метаболизма стероидов [5]. Исходя из этих представлений, в число генов‑кандидатов, изучаемых при аденомиозе, были включены гены рецепторов половых стероидов (ESR1, ESR2 (гены рецепторов эстрогена альфа и бета соответственно), PGR (рецептор прогестерона), GREP (известный также как GPR30, сопряженный с G‑белком неклассический рецептор эстрогена)) и гены метаболизма эстрогенов.
К числу последних относятся гены, кодирующие белки суперсемейства цитохрома P450 (CYP1A1, CYP1A2, CYP17, CYP19, CYP1B1), и другие гены, продукты которых могут метаболизировать эстрогены (SULT1A1 (сульфотрансфераза А1), COMT (катехол‑О‑метилтрансфераза)). Другие гены отвечают за синтез ферментов, участвующих в инактивации стероидов (CYP1A1, CYP1A2, CYP17, CYP1B1, COMT). Результаты, полученные разными исследователями при анализе этой генной сети, суммированы в таблице.
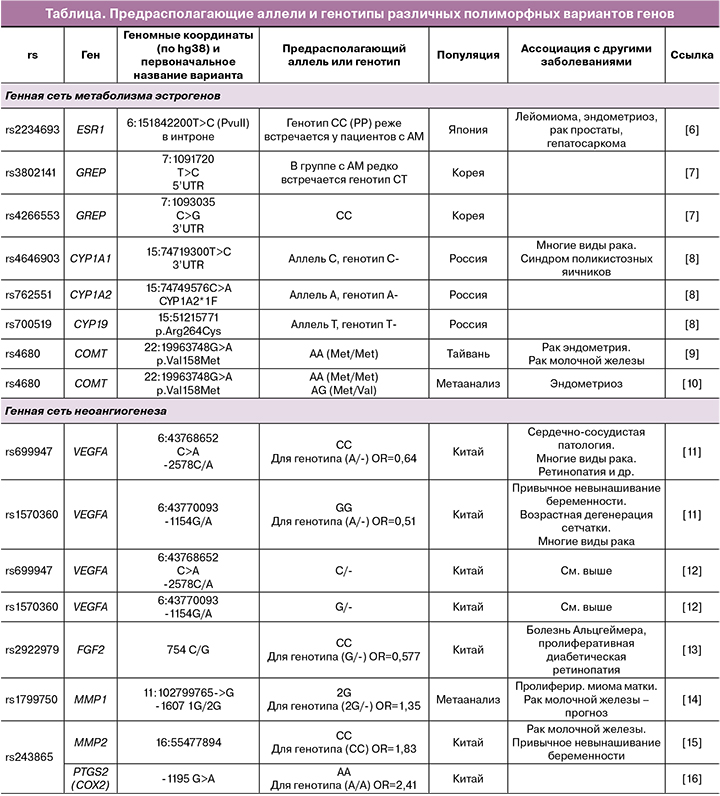
Другим биологическим процессом, принципиально важным для развития аденомиоза, является неоангиогенез. В ходе развития и роста новых структур клетки растущей ткани выделяют факторы роста, способные взаимодействовать с эндотелиальными клетками, активируя их способность к делению, миграции и образованию новой капиллярной сети. Главную роль в процессе неоангиогенеза играет фактор роста эндотелия сосудов (VEGF‑A, Vascular endothelial growth factor А). Кроме того, в клетках‑мишенях повышается экспрессия матриксных металлопротеаз (MMP) и урокиназы, под воздействием которых начинается деградация базальной мембраны эндотелия, что является необходимым условием для последующей миграции эндотелиальных клеток. Помимо VEGF, ангиогенез могут стимулировать и другие факторы роста – основной фактор роста фибробластов (FGF2), тромбоцитарный фактор роста (PDGF), трансформирующие факторы роста (TGFα и TGFβ1), эпидермальный фактор роста (EGF). Частота полиморфных вариантов ряда генов этой сети у пациенток с аденомиозом была исследована в рамках анализа ассоциаций, результаты некоторых из этих исследований приведены в таблице. Были получены результаты по полиморфным вариантам генов VEGFA, FGF1 и FGF2, MMP1, MMP2, MMP3, а также гена COX2, кодирующего циклооксигеназу 2 (фермент, отвечающий за синтез простагландинов – основных медиаторов воспаления).
По результатам этих исследований можно сказать, что в целом существование генетической предрасположенности к развитию аденомиоза, опосредованное некоторыми полиморфными вариантами генов, не вызывает сомнений. Однако стоит отметить, что, как и при очень многих других МФЗ, все выявленные варианты генов вносят лишь небольшой вклад в развитие заболевания; в большинстве случаев для носителей неблагоприятных полиморфных вариантов значение соотношения шансов развития патологии не превышает 1,2–1,3. По‑видимому, в большинстве случаев полиморфные варианты генов не являются непосредственной причиной развития МФЗ (включая аденомиоз), а лишь способствуют этим процессам, делая развитие болезни несколько более вероятным.
Анализ экспрессии генов и способов ее регуляции при аденомиозе
Другой подход к изучению генетических детерминант развития МФЗ состоит в сравнительном анализе уровня экспрессии генов‑кандидатов. При этом производится сравнение уровня мРНК или соответствующего белка в поражаемых тканях у пациентов и в группе контроля; также в рамках этого подхода могут быть исследованы способы регуляции экспрессии этих генов (в частности, эпигенетические нарушения и изменения содержания коротких РНК).
Ряд данных указывает на то, что в патогенезе аденомиоза могут быть задействованы эпигенетические механизмы, которые способны обеспечивать долговременную регуляцию (активацию или, напротив, подавление работы) отдельных генов или целых блоков генов. К таким механизмам относят метилирование ДНК. Аномалии метилирования хорошо известны как способ инактивации антионкогенов (при гиперметилировании) и активации протоонкогенов (при гипометилировании) и активно изучаются как один из механизмов канцерогенеза. Вторым механизмом являются модификации белков хроматина, которые в ядре связаны с ДНК, и этот комплекс способен формировать структуры разной степени открытости для молекул (РНКполимераз и факторов транскрипции), отвечающих за экспрессию генов.
По‑видимому, для аденомиоза характерны как нарушения в работе генов, отвечающих за общие эпигенетические механизмы, так и аномальное метилирование конкретных участков ДНК. Так, Liu X. и Guo S.W. [17] показали, что в эктопическом эндометрии у некоторых пациенток с аденомиозом наблюдается увеличение экспрессии двух метилтрансфераз (ферментов, отвечающих за метилирование ДНК), DNMT1 и DNMT3B; аберрантная экспрессия этих ферментов может приводить к глобальным нарушениям метилирования ДНК в клетках. Интересно, что, по данным этих авторов, увеличение экспрессии DNMT1 можно наблюдать также в эутопическом эндометрии у некоторых пациенток с аденомиозом, и этот показатель коррелирует с тяжестью дисменореи. Эти же авторы [18] исследовали экспрессию гистоновых деацетилаз – белков, вовлеченных в регуляцию структуры хроматина. У женщин с аденомиозом как в эктопическом, так и в эутопическом миометрии наблюдается аберрантное повышение экспрессии белков HDAC1, HDAC2 и HDAC3. Таким образом, для эктопического и эутопического миометрия, по крайней мере, у некоторых пациенток, характерны глобальные нарушения работы эпигенетических механизмов. В то же время в этих тканях могут быть выявлены и локальные аномалии метилирования. Так, исследование транскриптома, проведенное на образцах эутопического эндометрия пациенток с аденомиозом, показало, что экспрессия гена CEBPB в этих образцах повышена по сравнению с контрольной группой. Белок CEBPB (CCAAT/энхансерсвязывающий белок бета) является транскрипционным фактором, регулирующим важные гены, участвующие в воспалении и иммунном ответе, в том числе гены интерлейкинов‑1 и ‑6 и фактора некроза опухоли (TNF)a. Дальнейший анализ показал, что увеличение количества продукта данного гена связано с его гипометилированием [19].
В ряде работ продемонстрировано глобальное изменение экспрессии множества генов в эутопическом эндометрии у пациенток с аденомиозом по сравнению со здоровыми женщинами. Herndon et al. [20] впервые изучили полный транскриптом изолированного эутопического эндометрия в пролиферативной фазе у женщин с клинически значимым аденомиозом и выявили 140 активированных и 884 подавляемых гена. В число генов, экспрессия которых в эндометрии оказалась повышена при аденомиозе, вошли гены, продукты которых участвуют в регуляции апоптоза, реакции на стероидные гормоны, ремоделировании внеклеточного матрикса, а также некоторое количество РНК, функция которых неизвестна. Таким образом, эутопический эндометрий у пациенток с аденомиозом имеет фундаментальные отличия от нормального эндометрия, что может быть обусловлено действием эпигенетических факторов.
Мы проанализировали экспрессию генов WNT4, HOXA10 и HOXA11 в образцах эндометрия пролиферативной фазы пациенток с аденомиозом и в группе контроля. Выбор этих генов для анализа объясняется важнейшей ролью, которую они играют как в формировании женской репродуктивной системы (в частности, в дифференцировке клеток), так и в функционировании эндометрия в репродуктивном периоде. Было выявлено статистически достоверное повышение уровня экспрессии генов WNT4 (почти в 2 раза), HOXA10 и HOXA11 (в 1,5–2 раза). У 88% пациенток с аденомиозом отмечается значительное повышение экспрессии по крайней мере одного из этих генов; при этом для эндометрия женщин группы контроля такие изменения не характерны. С нашей точки зрения, подобные изменения экспрессии могут быть обусловлены эпигенетическими нарушениями и способны приводить к изменению тканевого гомеостаза в эндометрии и миометрии, способствуя формированию и росту очагов аденомиоза [21].
К эпигенетическим механизмам иногда также относят способ регуляции экспрессии генов с помощью некодирующих РНК – длинных (lncRNA, long noncoding RNA), микроРНК (miRNA), а также относительно недавно открытых кольцевых РНК (circRNA). Исследования этих молекул (прежде всего микроРНК) представляются весьма привлекательными и перспективными по причине того, что они могут быть выделены из разных типов биологических жидкостей – крови, мочи, слюны, а также могут служить биомаркерами разных видов патологии, в том числе в целях дифференциальной диагностики некоторых заболеваний. К сожалению, в настоящее время работы по исследованию некодирующих РНК при аденомиозе весьма немногочисленны и не демонстрируют воспроизводимых результатов; возможно, дальнейшие исследования помогут пролить свет на роль этого класса молекул в патогенезе аденомиоза.
Соматические мутации и аденомиоз
Внедрение в практику NGS‑секвенирования довольно сильно изменило наши представления о роли соматических мутаций при различных заболеваниях. Соматические мутации (то есть мутации, возникающие в соматических клетках и не передающиеся потомству) возникают довольно часто, но большая их часть не имеет никаких последствий. Однако накопление в одной клетке нескольких мутаций в критически важных генах, отвечающих за позитивный и негативный контроль деления клеток, является, согласно современным представлениям, необходимым этапом возникновения злокачественных опухолей. Для большинства типов опухолей существует специфичный набор генов, соматические мутации в которых характерны для этого вида патологии. Среди таких генов выделяют позитивные регуляторы роста (протоонкогены, или доминантные онкогены, всего их известно около 100) и негативные регуляторы (антионкогены, или рецессивные онкогены, их описано около 150). Канцерогенный эффект нарушений работы этих двух групп генов реализуется принципиально разным способом. Мутации, превращающие протоонкоген в онкоген, являются активирующими доминантными мутациями, благодаря которым в клетке начинает синтезироваться продукт этого гена с измененной функцией – например, рецептор (или другой белок в цепи передачи сигнала), способный активироваться без взаимодействия с лигандом или другим внешним стимулом. Число таких активирующих мутаций для каждого гена очень невелико, они являются рекуррентными и возникают независимо в разных опухолях у разных пациентов. Так, активирующие мутации в протоонкогене KRAS, который будет активно обсуждаться немного ниже, в большинстве случаев затрагивают лишь несколько нуклеотидов, кодирующих аминокислоты в положении 12 и 61, и приводят лишь к пяти вариантам замен в белке – G12A, G12C, G12V, G12D и Q61H. Мутации в антионкогенах (известных также как гены‑супрессоры опухолей), напротив, очень разнообразны, всегда связаны с потерей функции гена, являются рецессивными и в некоторых случаях могут передаваться по наследству (наиболее известны мутации в генах BRCA1 и BRCA2, связанные с наследственным раком молочной железы/яичников). Согласно двухударной модели канцерогенеза, для развития злокачественных опухолей необходимо, чтобы в одной клетке произошла активирующая мутация в протоонкогене (причем именно в том, который может активировать деление данного типа клеток) и были инактивированы оба аллеля по крайней мере одного из антионкогенов, хотя реальная картина развития опухолей, безусловно, гораздо сложнее.
С использованием NGS‑секвенирования была выявлена важная роль соматических мутаций в патогенезе доброкачественных пролиферативных заболеваний, в том числе при гинекологической патологии. Так, весьма значимым было открытие ведущей роли активирующих соматических мутаций преимущественно во втором экзоне гена MED12 в развитии лейомиомы матки [22]. Исследования эктопического и эутопического эндометрия, проведенные у пациенток с наружным генитальным эндометриозом и аденомиозом, также свидетельствуют о важной роли соматических мутаций ряда генов в развитии этих заболеваний.
Как уже было отмечено выше, соматические мутации в нормальных тканях возникают довольно часто. Однако, по сравнению с другими тканями, железы эндометрия несут особенно большое количество соматических мутаций, в то время как стромальные клетки преимущественно остаются интактными [23]. По‑видимому, эпителиальные клетки, в которых такие мутации возникли один раз, сохраняются в базальном слое и могут со временем диффузно распространяться по эндометрию. Moore L. et al. [24] исследовали образцы желез нормального эндометрия, полученные от 28 женщин разных возрастов (от 19 до 81 года), не имевших заболеваний, связанных с нарушениями пролиферации эндометрия. Соматические мутации были обнаружены в большом количестве во всех образцах эндометрия, при этом количество выявленных мутаций положительно коррелировало с возрастом. По подсчетам авторов, в норме в год в эндометриальном эпителии возникает в среднем 29 мутаций (стоит отметить, что это на несколько порядков меньше частоты возникновения соматических мутаций при карциноме эндометрия). Среди прочих у 89% женщин были выявлены и рекуррентные (драйверные) мутации в онкогенах PIK3CA, PIK3R1, FBXW7, KRAS, PPP2R1A и некоторых других. Чаще всего у пациенток из группы контроля были обнаружены мутации в протоонкогене PIK3CA (были выявлены по крайней мере в одной железе у 54% женщин); также довольно часто встречаются мутации в генах KRAS (37%) и PPP2R1A. Таким образом, само по себе наличие соматических драйверных мутаций протоонкогенов в железах эутопического эндометрия является совершенно обычным явлением; однако существует ряд черт, которые принципиально отличают ситуацию в нормальном эндометрии здоровой женщины и в карциноме эндометрия – это спектр мутировавших генов (он гораздо шире при опухолевом процессе, где с высокой частотой выявляются мутации генов PTEN, CTCF, CTNNB1, ARID1A и TP53) и частота мутантного аллеля. Последний показатель существенно выше в опухоли, где он может составлять 20–70%, в то время как в нормальном эндометрии здоровой женщины его частота не превышает 1–3% [24, 25].
Спектры соматических мутаций, выявляемых в эктопическом эндометрии при наружном генитальном эндометриозе и аденомиозе, имеют свои характерные особенности и различаются для этих двух заболеваний. В железах овариальных кист и эндометриоидных инфильтратов выявляются мутации практически в том же наборе генов, что и в эутопическом миометрии; однако чаще всего могут быть обнаружены рекуррентные мутации генов PIK3CA и KRAS (практически с равной частотой выявляются у 35–40% пациентов, причем значительная часть их имеют мутации в обоих генах). Кроме того, у 8–10% пациенток обнаруживаются инактивирующие мутации в гене ARID1A, которые не были найдены в эутопическом эндометрии. В железах эктопического эндометрия женщин с аденомиозом может быть выявлено большое количество соматических мутаций, однако из драйверных мутаций протоонкогенов обнаруживаются преимущественно мутации KRAS. Так, в работе Inoue S. et al. они были выявлены у 26 из 70 обследованных пациенток, а мутации генов PIK3CA и PPP2R1A присутствовали только у 2 и 1 женщины соответственно [25]. Частота мутантного аллеля в эктопическом эндометрии у пациенток с наружным генитальным эндометриозом и аденомиозом была несколько выше, чем в эутопическом эндометрии (при аденомиозе в среднем 4,8%, при наружном генитальном эндометриозе частота сопоставима), но никогда не достигала величин, характерных для соматических драйверных мутаций при карциноме эндометрия. Таким образом, тот факт, что эктопический эндометрий при наружном генитальном эндометриозе и аденомиозе отличается по спектру соматических мутаций, не вызывает сомнений.
Интересно отметить, что при исследовании нескольких биоптатов эктопического эндометрия, полученных от одной пациентки с аденомиозом, мутации KRAS обнаруживаются не во всех образцах, а у пациенток с сочетанием наружного генитального эндометриоза и аденомиоза соматические мутации в протоонкогенах могут различаться в парных очагах аденомиоза и эндометриоза [25]. Таким образом, очевидно, что соматические мутации гена KRAS вряд ли являются первопричиной роста эктопических очагов, и роль, которую играют эти мутации в патогенезе аденомиоза и эндометриоза, остается также не вполне понятной. Известно, что активация протоонкогена KRAS ведет к лиганд‑независимой активации сигнального пути Ras/MAPK и PI3K/AKT, что может приводить к усилению клеточной пролиферации и уменьшению апоптоза, а также влиять на экспрессию большого числа генов. В результате клетки, несущие подобные мутации, могут получать селективное преимущество в росте, по сравнению с интактными клетками. Выявление соматических мутаций определенного типа может быть важно для выбора способа лечения. Индивидуальные различия у разных пациентов могут быть весьма значительны, и это обстоятельство, по‑видимому, вносит значительный вклад в формирование разных вариантов фенотипа данного заболевания и ответа на лекарственную терапию [26, 27]. Inoue S. et al. показали, что у женщин с выявленными мутациями KRAS чаще наблюдается устойчивость к терапии диеногестом, и доказали, что это связано с отсутствием у значительной части таких пациенток экспрессии рецепторов прогестерона в эктопическом эндометрии. Эксперименты, проведенные на клеточной модели, убедительно показали, что активация протоонкогена KRAS приводит к репрессии гена PGR за счет метилирования его промотора (эпигенетический механизм регуляции) [25].
Характерные особенности соматических мутаций в эктопическом эндометрии при аденомиозе были открыты совсем недавно, в 2019 г. [23, 25]. Эти данные, безусловно, нуждаются в дополнительных исследованиях, но уже сейчас они внесли свой вклад в понимание механизмов развития данной патологии. Так, исходя из имеющихся в настоящее время сведений, становится очевидным, что аденомиоз – это олигоклональное заболевание, при котором развитие эктопической ткани происходит из нескольких эпителиальных и ассоциированных с ними стромальных клеток. Однако множество вопросов о роли мутаций гена KRAS в молекулярных механизмах развития аденомиоза остаются открытыми и ждут своих исследователей.
Заключение
Рассмотренные нами выше генетические аспекты патогенеза аденомиоза свидетельствуют о полиэтиологичном возникновении данного заболевания. Наличие неблагоприятных аллелей, нарушающих работу генных сетей, связанных с патогенезом заболевания, долговременные изменения экспрессии генов и связанные с этим нарушения тканевого гомеостаза в органах‑мишенях и, наконец, возникновение соматических мутаций в клетках желез эктопического и эутопического эндометрия, действуя совокупно, формируют основание для развития данной патологии.



